我院2016 – 2017年341例使用万古霉素患者的用药分析
王震寰,侯嘉娜,万里燕,魏建英(.清华大学第一附属医院药学部,北京 0006;2.北京大学药学院药事管理与临床药学系,北京 009)
万古霉素(vancomycin,VAN)是第一个三环糖肽类抗生素,主要通过抑制细菌细胞壁的合成,对革兰阳性菌发挥强大的杀菌作用[1-2]。VAN作为耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)的一线治疗药物,具有较低的耐药率,目前全球范围内仅发现33株耐万古霉素金黄色葡萄球菌(vancomycin-resistantStaphylococcus aureus,VRSA),可见VAN具有良好的治疗作用和应用前景[3-4]。
为了使VAN更长久的在临床发挥作用,2012年原卫生部颁布的《抗菌药物临床应用管理办法》[5],将VAN列为特殊使用级抗菌药物,加大了对其的监管力度,同年9月,原北京市卫生局发布了《万古霉素/去甲万古霉素病例点评指南(试行)》(简称“点评指南”)[6]为医院药师对VAN处方点评提供了方法与原则。本研究旨在通过回顾性分析近两年我院使用VAN进行治疗的病例,分析其合理性,并提出可行的干预和改进意见,为临床合理使用VAN提供参考。
1 资料与方法
1.1 病例采集
通过医院信息系统(hospital information system,HIS),调取我院2016年1月– 2017年12月的全部住院患者病历,参照点评指南中各项要求进行数据填报和分析。
1.2 病例筛选
根据点评指南的要求,纳入标准为:当月出院并且在住院期间使用过VAN的病历,年龄、病种不限。剔除标准:非静脉给药(口服或腹腔给药)和死亡病例。
1.3 研究方法
通过查看患者病例,收集患者的基本信息(包括性别、年龄和体重)、科室、用药诊断、管理指标(处方医师权限、病程中有无抗菌药物特殊用药申请和查房意见或会诊意见)、用药目的、经验用药前是否进行病原学送检、病原学情况、药物使用方案、临床治疗效果,是否需要进行治疗药物监测(therapeutic drug monitoring,TDM)、药品不良反应等信息,采取双人录入并核对的方式,使用Microsoft Excel 2017软件对数据进行处理和分析。
1.4 万古霉素用药合理性点评标准
本研究以点评指南[6]、《抗菌药物临床应用指导原则》(2015版)[2](简称“指导原则”)、《万古霉素临床应用中国专家共识》(2011版)[1](简称“专家共识”)、《美国感染病学会治疗成人及儿童甲氧西林耐药金黄色葡萄球菌感染临床实践指南》(2011版)[7]和注射用盐酸万古霉素说明书中的相关内容作为评估用药合理性的参考,对VAN的管理指标、病原学检测和用药适宜性等方面判断其合理性。
1.5 疗效评价标准
点评指南规定,VAN作为治疗用药时,疗效评价标准如下,根据患者的症状、体征、实验室和影像学检查以及病原学检测结果分为:①痊愈:病情好转,各项临床指标恢复正常;②好转:病情好转,临床指标部分恢复正常;③无效:病情恶化或未见好转;④其他:用药不足3 d、转院或自动出院者等不能评价的情况。其中,痊愈和好转视为有效。作为预防用药时,标准如下:①有效:按照预防用药原则应用,未发生可能的感染;②无效:发生感染或需要使用抗菌药物进行治疗[6]。
2 结果
2.1 病例基本信息
最终纳入住院患者病例共计341例,其中男性205例(60.1%),女性136例(39.9%),年龄分布新生儿至老年人(出生15 min ~ 96岁),平均年龄68.0岁,其中新生儿(0 ~ 28 d)占11.1%,儿童(0 ~ 18岁)占17.2%,老年患者(> 65岁)占55.8%。
2.2 患者科室分布情况和用药诊断
共纳入19个科室,用药比例最高的是血液肿瘤科,最低的是产科,见表1(其他科室包括心脏成人科12例、神经内科8例、胸外科8例、骨外科7例、脑外科5例、消化内科5例、心脏血管科4例、妇科2例和产科1例)。用药诊断主要集中在肺部感染、血流感染、泌尿系统感染和术后感染,其中治疗用药339例,预防用药2例,部分患者存在同时合并两种感染的情况,见表2(其他包括动静脉内瘘感染1例、盆腔炎1例、透析后发热1例、休克待查1例、肠道菌群紊乱1例和右侧上颌窦炎1例)。

表1 科室分布情况Tab 1 Distribution of clinical departments
2.3 处方医师权限及相关病程记录情况
所有处方均由高级职称医师开具,但其中有17例(2016年13例,2017年4例,占5.0%)使用VAN前,没有提出抗菌药物特殊用药申请,或在病程中未记录副高级以上医师查房或会诊意见等。
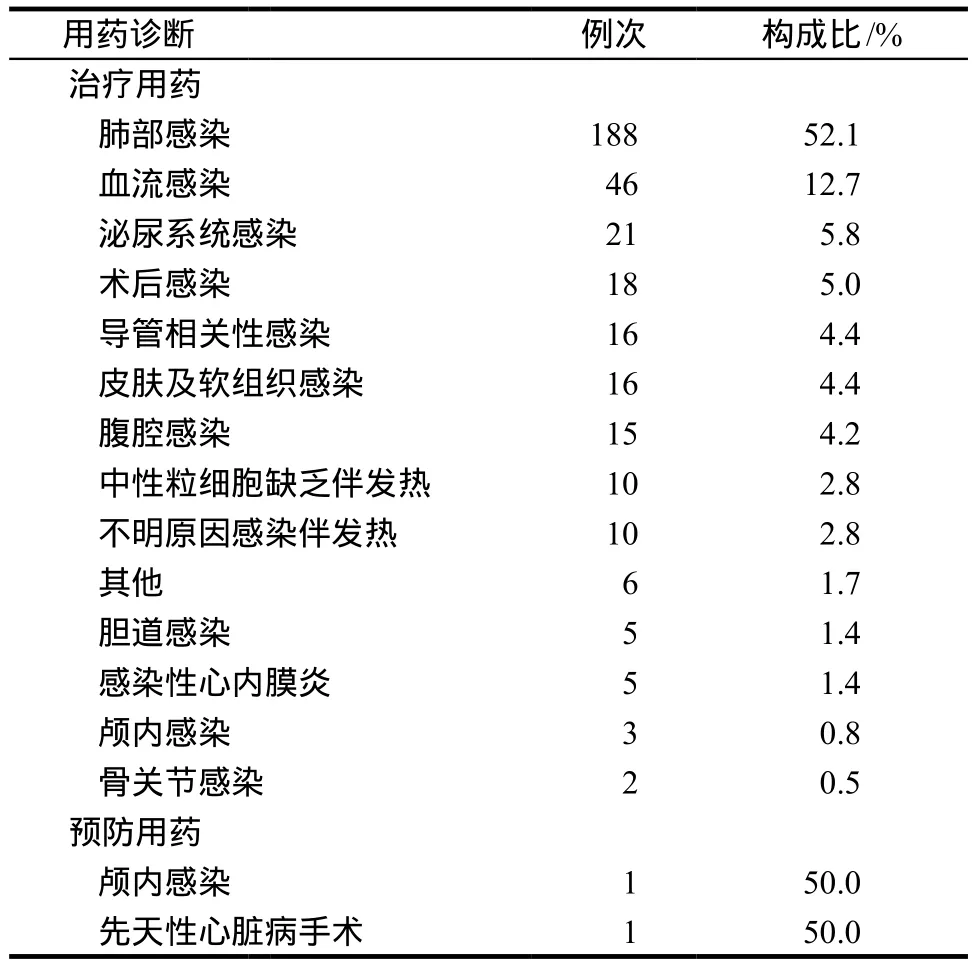
表2 用药诊断情况Tab 2 Statistics of the medical diagnosis
2.4 病原学送检及药敏试验情况
在339例VAN治疗用药患者中,经验用药268例(79.1%),目标用药71例(20.9%)。用药前留取病原学检测260例,送检率为76.7%,其中71例(27.3%)为根据药敏结果选择用药,其余189例(72.7%)为经验用药;189例经验用药的病原学检测标本中,47例(24.9%)与药敏结果一致,142例(75.1%)与药敏结果不一致。
260例病原学送检标本中包括痰液最多,其中91例未找到病原学证据,169例病原学检查为阳性,见表3和表4。
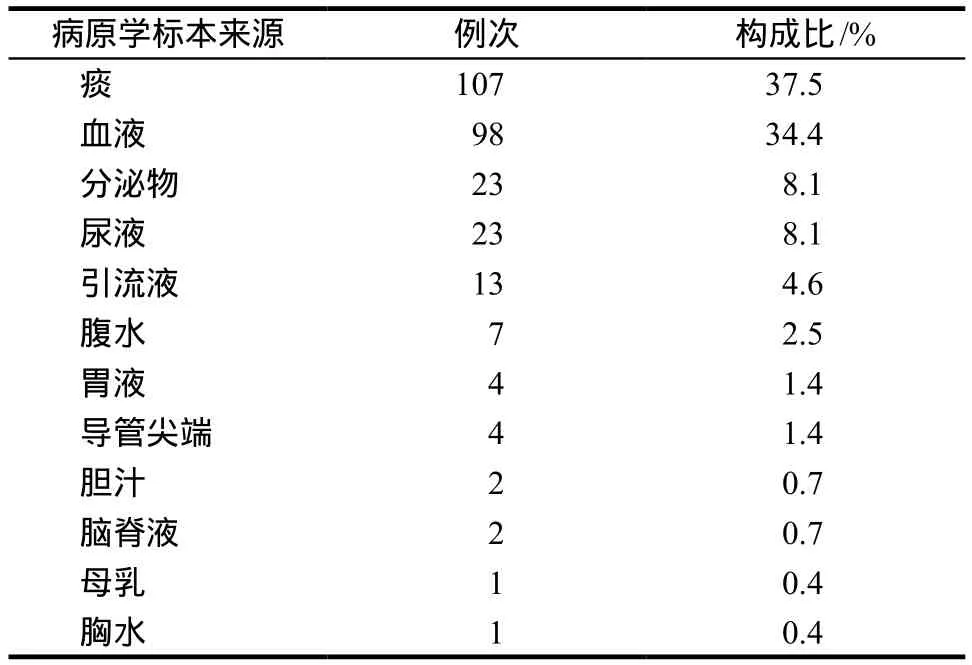
表3 病原学标本来源情况Tab 3 Source of the pathogen specimen
病原学检测结果显示,共检测出133株革兰阳性细菌,包括88株葡萄球菌、37株肠球菌和8株链球菌,其中葡萄球菌包括金黄色葡萄球菌29株,凝固酶阴性葡萄球菌59株,药敏结果显示,MRSA 20株,甲氧西林敏感金黄色葡萄球菌(methicillin-susceptibleStaphylococcus aureus,MSSA)9株,甲氧西林耐药凝固酶阴性葡萄球菌(methicillin-resistant coagulase negativeStaphylococcus,MRCNS)55株,甲氧西林敏感凝固酶阴性葡萄球菌(methicillin-susceptible coagulase negativeStaphylococcus,MSCNS)株4例,未发现VAN耐药葡萄球菌;37株肠球菌中,30株为氨苄西林耐药肠球菌,包括6株粪肠球菌和24株屎肠球菌。发现2株万古霉素耐药肠球菌(vancomycinresistantEnterococcus,VRE),均为尿液标本来源;8株链球菌均对头孢曲松或莫西沙星敏感,其中2株为青霉素耐药肺炎链球菌(penicillin-resistantStreptococcuspneumoniae,PRSP),见表4(59株凝固酶阴性葡萄球菌包括19株表皮葡萄球菌、18株溶血葡萄球菌、11株人葡萄球菌、6株头状葡萄球菌、4株沃氏葡萄球菌和1株模仿葡萄球菌)。
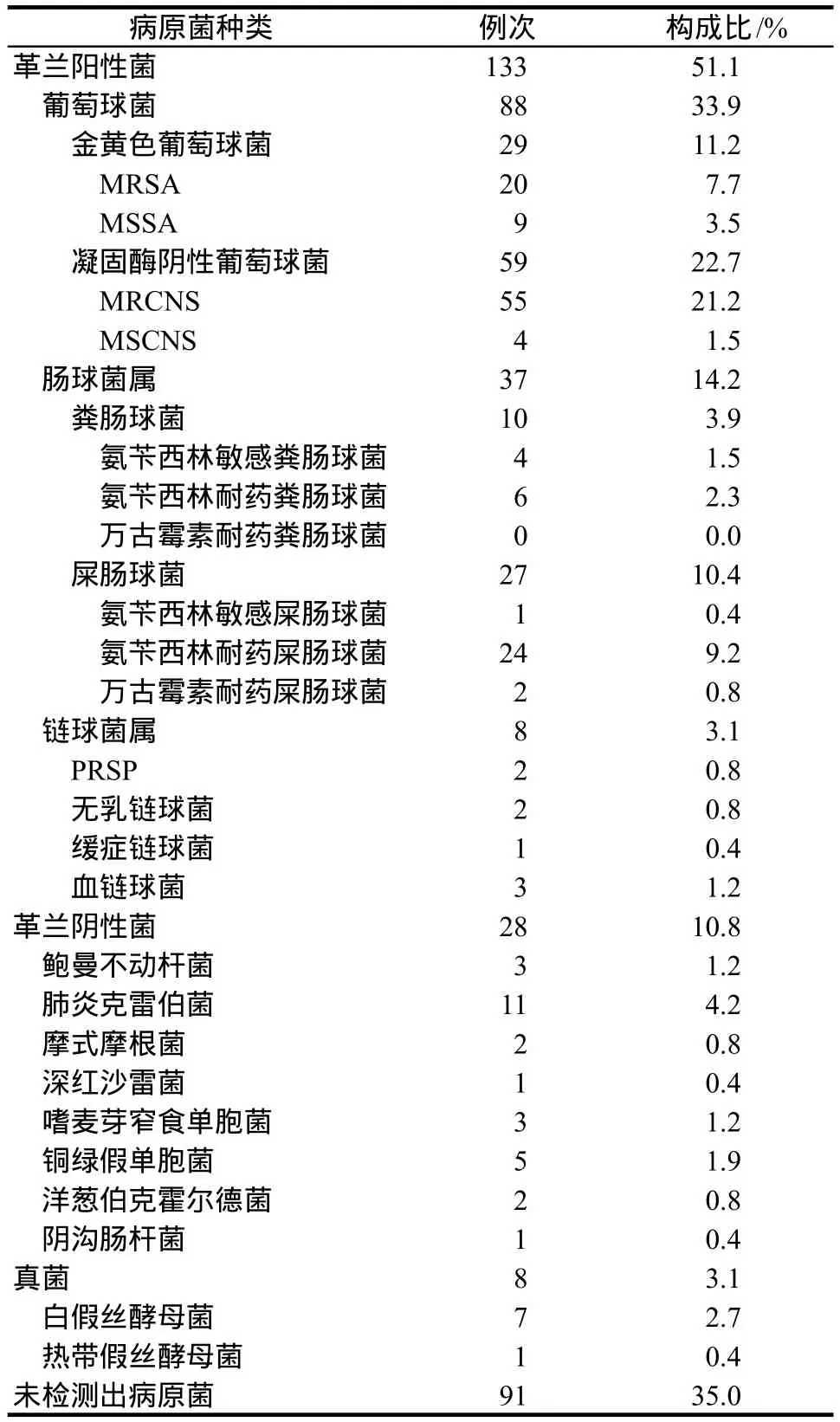
表4 病原菌种类分布Tab 4 Distribution of species of pathogens
2.5 万古霉素用药适宜性评价
对VAN进行用药适宜性的评价内容详见表5。

表5 用药适宜性的点评结果Tab 5 Comments on the suitability of medication
2.5.1 适应证 根据用药合理性列出的参考依据判断VAN的适应证是否适宜。我院20例(5.9%)患者选择VAN起点过高。
2.5.2 溶媒适宜性 VAN可用0.9%氯化钠注射液、5%葡萄糖注射液和乳酸钠林格氏液作为溶媒[1]。我院VAN使用的溶媒均为0.9%氯化钠注射液或5%葡萄糖注射液。
2.5.3 用法用量适宜性 根据点评指南[6]、专家共识[1]和药品说明书,VAN给药剂量通常为2 g·d-1,q 12 h或q 6 h,按照年龄、体重和病情严重程度适量增减。老年患者为1 g·d-1,qd或q 12 h;儿童、婴儿按40 mg·kg-1·d-1,分2 ~ 4次给药;新生儿按每次10 ~ 15 mg·kg-1,< 1周龄为q 12 h,1周 ~ 1月龄为q 8 h。由于我院未开展TDM,儿童、婴儿、新生儿、老年人均按照上述方法给药,肾功能不全患者根据肌酐清除率计算药物用量。此外,药物浓度应低于0.5%,静滴60 min以上,或者以不高于10 mg·min-1的速度给药[6]。341例患者中有104例(30.5%)溶媒使用量过少,如1 g药物使用100 mL 0.9%氯化钠注射液或5%葡萄糖注射液稀释,医嘱中也未规定药物的输注速度。
2.5.4 疗程适宜性 71例目标用药中患者的疗程平均为11.9 d(1 ~ 36 d),有18例患者疗程< 1周,1例>30 d的是由屎肠球菌引起的泌尿系统感染。268例经验用药中,平均疗程为10.4 d(1 ~ 36 d),有107例患者疗程< 1周,2例> 30 d的分别是感染性心内膜炎和导管相关性感染。2例预防用药中,1例疗程为24 h,另一例为14 d。
2.5.5 配伍禁忌适宜性 VAN在pH 3 ~ 5的环境下稳定[1],故不宜与碱性药物配伍,如氨茶碱、磷酸地塞米松、苯巴比妥钠等碱性溶液[8]。我院VAN均为单独输注给药,不与其他药物配伍使用。
2.5.6 相互作用适宜性 共有87例(25.5%)患者合用了114个具有肾毒性的药物,其中联合一种64例(73.6%),联合两种19例(21.8%),联合三种4例(4.6%),包括利尿剂79个(69.3%),氨基糖苷类抗生素17个(14.9%)和哌拉西林钠他唑巴坦钠18个(15.8%),其中32例(9.4%)患者出现肾毒性。
2.6 疗效评价
2例预防用药未发生可能的感染,评价为有效。其余339例治疗用药中,有效270例(79.6%),无效43例(12.7%),其他26例(7.7%)。
3 讨论
3.1 加强医院信息系统的建设
点评指南中规定,在处方医师权限方面,VAN必须由高级职称的医师开具;在病程记录方面,有特殊级抗菌药物使用申请,或在病程中有副高及以上医师查房意见或请专科进行会诊等。本次分析结果显示,所有病例中,均无越权医生开药情况。病程记录方面,在我院信息中心的配合下,特殊级抗菌药物申请表由最初的纸质版改为嵌入病历系统中,缩短了以往审批所需时间,为临床急重症患者争取了宝贵的时间,同时,也提高了VAN病程记录的规范性,病程不合理率由2016年的13例,下降至2017年的4例,体现出运用信息化手段可以改善用药的管理指标。
3.2 提高合格微生物标本送检,并根据药敏试验结果合理用药
《2012年抗菌药物临床应用专项整治活动方案》[9]指出,医疗机构应该根据病原学送检结果合理选择抗菌药物,接受特殊级抗菌药物治疗的住院患者用药前病原学送检率应不低于80%。本研究结果显示,用药前进行病原学送检率为76.7%,略低于80%的要求,可能原因是部分医生考虑微生物送检结果回报时间较长,患者病情较重,因此必须尽快经验性使用抗菌药物,而忽略了病原学送检,或是患者多次在我院治疗,根据既往药敏结果选择VAN治疗,故本次用药前并未进行病原学送检。
260例病原学送检标本中,痰液标本最多(37.5%),根据合格痰标本的定义[10],不合格率为18.9%。由于痰液标本结果可信度不高,可影响肺部感染的病原学诊断,易造成VAN的滥用,相关科室在规范痰标本留取的同时,可考虑肺泡灌洗液或增加无菌体液标本如血培养的送检率,提高检测结果的准确性,防止药物滥用。
189例经验用药的病原学检测标本中,142例(75.1%)与药敏结果不一致,提示经验用药可能会导致治疗失败或者选择的抗菌药物级别过高及过低,因此建议在使用VAN之前留取病原学送检,并及时根据药敏结果进行调整。
3.3 用药适宜性评价
3.3.1 关注经验用药时药物的起点选择 VAN的适应证为耐药革兰阳性细菌所致的严重感染,包括MRSA、MRCNS、氨苄西林耐药肠球菌属及PRSP所致的感染[2]。纳入病例中有9株MSSA使用VAN,尽管经治疗后好转,但仍应该根据药敏结果选择低级别β-内酰胺类抗生素。对于MSSA感染,VAN的疗效并不优于其他β-内酰胺类药物,故在患者不过敏的情况下,应该选择β-内酰胺类药物[7,11]。举例说明,研究纳入的一例老年女性患者,头颅CT和MRI提示急性脑梗死,行右侧脑室外引流术后出现肺部感染,痰培养提示金黄色葡萄球菌,药敏结果显示其对青霉素和磺胺类耐药,其他药物均敏感,但临床使用万古霉素进行治疗。由于痰培养为MSSA,因此使用万古霉素起点过高,应选择其他低级别β-内酰胺类抗生素,如一、二代头孢菌素或含有酶抑制剂的青霉素类复方制剂,从而降低万古霉素的耐药风险。
另有5株氨苄西林敏感肠球菌可以使用氨苄西林、阿莫西林或哌拉西林等治疗,使用VAN起点过高[12]。4株为头孢曲松敏感的缓症链球菌或血链球菌,建议根据药敏结果选择头孢曲松或头孢吡肟治疗。2株无乳链球菌,均为新生儿,对青霉素类、头孢菌素类、喹诺酮类、糖肽类和替加环素敏感,应首选青霉素类药物治疗,对于存在青霉素过敏风险较低的患者,可选择第一、二代头孢菌素,由于VAN对新生儿具有较大的耳肾毒性,在其他药物治疗效果不佳或存在青霉素过敏的时候,可换用VAN,其不应作为常规药物使用[13]。
在实际治疗过程中,由于药敏结果回报时间较长,多数患者病情危重,当痰涂片或血培养中发现革兰阳性细菌时,就开始经验性使用VAN治疗,使得部分患者的用药起点过高,其次还要根据病原学结果和临床情况评估其临床意义,判断是否为定植、污染或致病,以免造成药物滥用。所以,在经验用药时,应考虑患者是否有耐药菌感染的高危因素,并结合病原学结果和临床情况选择相应级别抗生素,避免过高级别抗生素的使用。
3.3.2 重视药物的配制浓度和输注速度 VAN给药速度过快或浓度过高,可能会引起不良反应,如红人综合征。341例患者中有104例(30.5%)溶媒使用量过少,其中62例(59.6%)的患者为老年人和新生儿,此类患者通常需要限制每日的出入量,使用过多的液体会加重心脏等器官的负担,临床医师在重视给药剂量的同时忽略了配制浓度。若药物浓度提高至1%或更高,应在医嘱中标明输注速度或给药时间,也可以尝试将VAN使用溶媒的信息增加到特殊级抗菌药物使用申请表中,从而加强对药物浓度的管理。
本研究发现3例患者发生红人综合征,药物浓度均为1%且输注时间小于1 h,考虑与药物浓度过高、输注过快有关。其中1例患者静脉输注万古霉素后出现颈部皮疹伴瘙痒,未予以重视,第2日用药后再次出现颈部充血性皮疹伴瘙痒,有融合,无明显溃破,并出现眼皮红肿,遂停用万古霉素,使用葡萄糖酸钙对症治疗后好转,故在使用万古霉素时,应严格控制药物的浓度和滴速,防止不良反应的发生;另有1例在药物浓度小于0.5%也发生了红人综合征的反应,相关的文献也报道了这种情况[14]。
3.3.3 预防用药给药时机不合理,疗程过长 分析发现,1例患者因意识障碍入院,脑部CT示脑室出血,行双侧侧脑室穿刺引流术,在术后第12天开始预防性使用VAN,疗程14 d,对于手术预防用药点评指南指出,VAN可用于MRSA检出率高的医疗机构,由于我院MRSA的检出率较高,使用VAN进行预防是合理的,但是对于预防用药,应术前给予不超过24 h的抗菌药物,预防给药时机不合理。手术预防用药在我院使用相对较少,需要加强这方面的点评工作。
3.3.4 联用具有肾毒性药物时需进行TDM VAN的治疗窗较窄,血药浓度过低会导致处在耐药突变选择窗(mutant selection window,MSW)中的菌株不能被VAN杀死,继而发生耐药,而浓度过高又会增加肾毒性[15-16]。由于VAN具有一定的肾毒性,故一般情况下不应与具有肾毒性的药物联用。研究发现,单用VAN引起肾毒性的发生率为1% ~ 5%,合用氨基糖苷类抗生素后,肾毒性的发生率可达14% ~ 35%[17]。另外,VAN联合哌拉西林钠他唑巴坦钠也可增加成人或新生儿的肾毒性风险[18-19]。VAN的TDM可以明显增加临床有效率并降低肾毒性的发生风险[20]。结果显示,我院新生儿和老年人占总体使用VAN的66.9%,有25.0%的老年患者合并心脏功能的疾病或混合感染,使用利尿剂或氨基糖苷类及哌拉西林钠他唑巴坦钠联合治疗,因此这类人群发生肾毒性风险增加,需积极监测肾功能并尽可能开展VAN的TDM。本次点评的病例均未进行TDM,根据VAN肾毒性的定义[21],有32例(9.4%)患者在用药期间血肌酐较基线升高了至少50%,最严重的升高了3.4倍,其中18例(7.1%)单用VAN,14例(16.1%)合用了具有肾毒性的药物,这使肾毒性的发生率升高了1倍多,应得到临床广泛的关注。例如1例患者,基础血肌酐55 µmol·L-1,使用注射用万古霉素(1 g,q 12 h),联合注射用哌拉西林钠他唑巴坦钠(4.5 g,q 8 h)和依替米星(300 mg,qd)后,血肌酐持续上升,最高至209 µmol·L-1,遂停用哌拉西林钠他唑巴坦钠,并将依替米星剂量减至150 mg,qd,血肌酐降至78 µmol·L-1。故有必要对这类患者进行TDM,从而减少不良反应的发生,实现患者的个体化给药。
本研究的优势在于,纳入样本量较大且为近两年的病例数据,从多个角度较为深入和全面地分析了VAN用药合理性的问题,强调了正确的病原学检测和评估对用药选择的重要性以及进行TDM的必要性等,具有一定的外推性,可为其他同级医院提供参考。但也存在一定的局限性,尽管从多个维度讨论VAN使用的合理性,但患者个体情况和临床治疗环境复杂,本文提出改进意见的可行性尚需更多证实和实践。
综上所述,我院VAN使用情况整体上趋于合理,问题主要集中在规范病原学送检、药物选择起点过高、配制浓度过高和未进行TDM等。药师通过结合相应的点评指南和相关资料,对VAN病例进行回顾性点评与分析,有助于发现VAN在临床实际应用过程中存在的问题,并提出可行的改进措施,在提供药学服务和干预的同时,加强药学部门与临床科室的合作,共同促进VAN在临床的合理使用。

