肺动脉窦起源的室性心律失常的电生理特点及射频消融治疗
王芸 梁卓 张涛 任学军
心室流出道是特发性室性心律失常(ventricular arrhythmias,VAs)的常见起源点 。少数VAs可起源于肺动脉。近来研究[1-3]通过心脏组织病理解剖发现部分心室肌可跨过半月瓣向大动脉延伸,使主动脉及肺动脉根部存在具有异常自律性及可触发激动的心室肌细胞,继而促使该部位产生相应的VAs。主动脉根部起源VAs可于冠状窦(常见于左冠窦、右冠窦)内消融成功[4-6], 而多数肺动脉起源的VAs定位于肺动脉瓣上1cm以上,并可分别于瓣上、瓣下消融成功[7-9]。Liao等[10]研究发现对于通过传统方法在RVOT消融失败的病例,倒U法在肺动脉窦(PSC)内标测和消融不失为新的选择。目前对于PSC起源的VAs研究甚少。笔者推测PSC起源VAs的发病率远高于目前报道的结果,对于体表心电图定位于RVOT起源的VAs,首选PSC标测和消融或许可提高手术效率及成功率。
1 资料与方法
1.1一般资料 入选2015年5月至2017年5月期间就诊于北京安贞医院心内科,室性早搏(简称室早)时体表心电图表现为左束支阻滞图形,电轴向下,胸导联移行晚于V3,拟行室早射频消融术者70例。其中男38例,年龄[44±24(12~67)]岁,70例患者均有VAs相关症状,症状持续时间(28±17)个月,其中16例表现为非持续性室性心动过速(简称室速)合并室早。所有患者均无明显的心脏结构和功能异常,窦性心律时体表心电图完全正常。所有患者在接受射频消融治疗前均使用过至少一种抗心律失常药物,且药物治疗难以控制VAs。
1.2电生理检查、标测和消融 应用Bard电生理记录系统记录患者窦性心律和VAs时的心电图,走屏速度为100 mm/s。分析室性心律失常时Ⅰ, Ⅱ, Ⅲ, aVR, aVL,V1,V2导联的QRS波形态;Ⅰ, Ⅱ, Ⅲ, V1,V2导联的R波振幅;aVR,aVL导联Q波振幅;V1,V2导联S波振幅;V2导联R、S波振幅比;Ⅱ导联QRS波时程;观察胸前导联R/S移行比。
术前签署知情同意书,停用抗心律失常药5个半衰期以上。确保准确放置心电图电极片,心内双极电图滤波30~500 Hz,单极电图滤波0.05~500 Hz。穿刺右股静脉,使用8.5F长鞘以增加导管稳定性。在三维系统(CARTO, Biosense Webster, Diamond Bar, CA, USA)下标测,采用激动顺序标测联合起搏标测以确定VAs起源部位。起搏标测时起搏周长为500 ms,刺激电流选择能够夺获局部心肌的最低电流(5~20 mA),较好的起搏标测结果表现为11~12个导联的起搏电图与临床心律失常相同。如术中无或极少有自发VAs,则给予静脉滴注异丙肾上腺素(2~5 μg/min)诱发临床VAs。
所有患者首先在PSC内标测,记录局部最早激动点(EAS),随后使用普通弯在肺动脉、RVOT前中后间隔侧及游离壁侧进行标测,确定EAS位置后进行消融。采用温控消融,设定消融温度为55℃,功率为35~40 W。如果放电10s内可见室早或室速消失或明显减少,则持续放电60~90 s,否则终止放电并调整导管位置。如果PSC内消融失败,则行RVOT内或主动脉瓣上瓣下消融。消融终点为VAs消失,并且静脉滴注异丙肾上腺素(2~5μg /min)不能诱发VAs。消融成功定义为术后停用抗心律失常药物,且无相同自发VAs或静脉滴注异丙肾上腺素、程序刺激均不能诱发室早、室速发作。
1.3统计学方法 使用SPSS19统计软件进行分析,计量参数以均数±标准差表示,正态分布参数组间比较使用单因素方差分析,偏态分布数据采用非参数检验。以P<0.05为差异有显著性。
2 结果
2.1体表心电图特征 PSC起源VAs,在体表心电图形态与既往定义为RVOT起源者无明显差异,均表现为QRS形态呈左束支阻滞图形,Ⅱ、Ⅲ、aVF导联R波直立(图1)。最终14例于PSC右窦(RC)、18例于PSC左窦(LC)、28例于PSC前窦(AC)消融成功,RC起源VAs体表心电图形态与RVOT游离壁起源者相似,下壁导联R波多有切迹。Ⅰ导联QRS波LC组表现为rs(与RVOT间隔侧相似),AC组表现为QS有切迹,后部表现为R(与RVOT游离壁偏前相似)。胸导联移行区RC组平均位于V4导联,AC及LC组平均位于V3导联;所有患者aVR、aVL导联均表现为QS形。三组室早体表心电图数据见表1。
2.2标测与消融 60例患者最终于PSC内消融成功。10例患者于RVOT不同部位消融成功。
10例患者最终消融成功靶点位于肺动脉瓣下RVOT后间隔部6例,前间隔4例。消融大头在靶点处单极电位呈QS型,双极电位表现为尖峰电位,平均领先QRS波(21±9.8)ms。其记录到的是窦性心律下出现在心室波(V波)终末段或与心室波融合,室早或室速时跃至V波前方的高频尖峰电位。
PSC组所有患者在肺动脉瓣下RVOT标测时,EAS位于RVOT后间隔24例,中间隔13例,前间隔8例,前游离壁5例,中游离壁4例,后游离壁6例。双极电图记录到的EAS大头局部电位领先体表QRS波(20.2±2.4 )ms,约55%的患者单极电图记录到QS波。靶点处EAS进行起搏标测,平均起搏电流为(7.5±2.4) mA,34%(21/60)患者在最早激动点起搏标测与自发VAs图形大致类似。其中1例为11个导联相似,5例为10个导联图形相似,15例为10个导联相似(图2)。

图1PSC各组随机选取1例室早时体表12导联心电图形态(C1~C6胸导联)
在PSC内标测时,EAS位于RC14例,AC28例,LC18例(图2) 。双极电图记录到PSC内靶点电位领先QRS波(26.2±2.5) ms,远大于RVOT处标测结果。PSC内靶点处单极电图均表现为QS形,RVOT标测到的最早激动点距PSC内相对靶点平均距离为(3.9±2.8) mm。PSC内标测到的EAS窦性心律时电位有近场和远场两种组分电位,表现为较钝的碎裂电位后紧跟尖峰电位。VAs时二者信号相反,双极电位表现较离散的碎裂电位,单极电位表现为QS形。所有患者均于该处进行起搏标测,平均起搏电流为(12.5±2.3)mA,76%(46/60)患者在最早激动点起搏标测与自发VAs图形大致类似。其中2例为12导联均相似,12例为11个导联图形相似,32例为10个导联相似,主要区别在于胸导联V1、V2不同,与RVOT处相似。消融成功后窦性心律下可见QRS波后部融合有碎裂电位。PSC内消融成功的60例,有52例于窦底消融成功,8例在前缘平均高于窦底(3.8±2.2)mm消融成功。初始放电5~10 s后室早明显减少,且QRS波形态无明显改变。

表1 临床室早体表心电图数据分析
注:RC=肺动脉右窦;AC=肺动脉前窦;LC=肺动脉左窦。与AC、LC组比较,*P<0.05;与AC组比较,△P<0.05
2.3并发症与预后 所有患者均无卒中、心包压塞、冠状动脉损伤、急性心肌梗死或心脏瓣膜损伤等。术后定期随访,所有患者停用抗心律失常药物且无VAs发作。
3 讨论
3.1主要发现 本文通过对PSC起源VAs的心电图及电生理特点研究发现:①PSC起源的VAs与RVOT起源者相比在体表心电图上无明显差异,均表现为左束支阻滞图形,下壁导联R波直立。②激动标测获得EAS部位,RVOT中后间隔与PSC-LC相对,RVOT前间隔、前游离壁部位与PSC-AC相对,RVOT中后游离壁与PSC-RC相对;但PSC内靶点电位领先QRS波时程明显长于RVOT标测结果。③成功消融靶点多位于PSC窦底部,少部分位于窦前缘或高于窦底;④碎裂电位合并尖峰电位可能是PSC起源VAs成功消融的预测因子;⑤因在解剖上PSC与RVOT紧密连接近,因此部分PSC起源VAs在RVOT标测到的EAS处进行放电消融,可一过性有效。
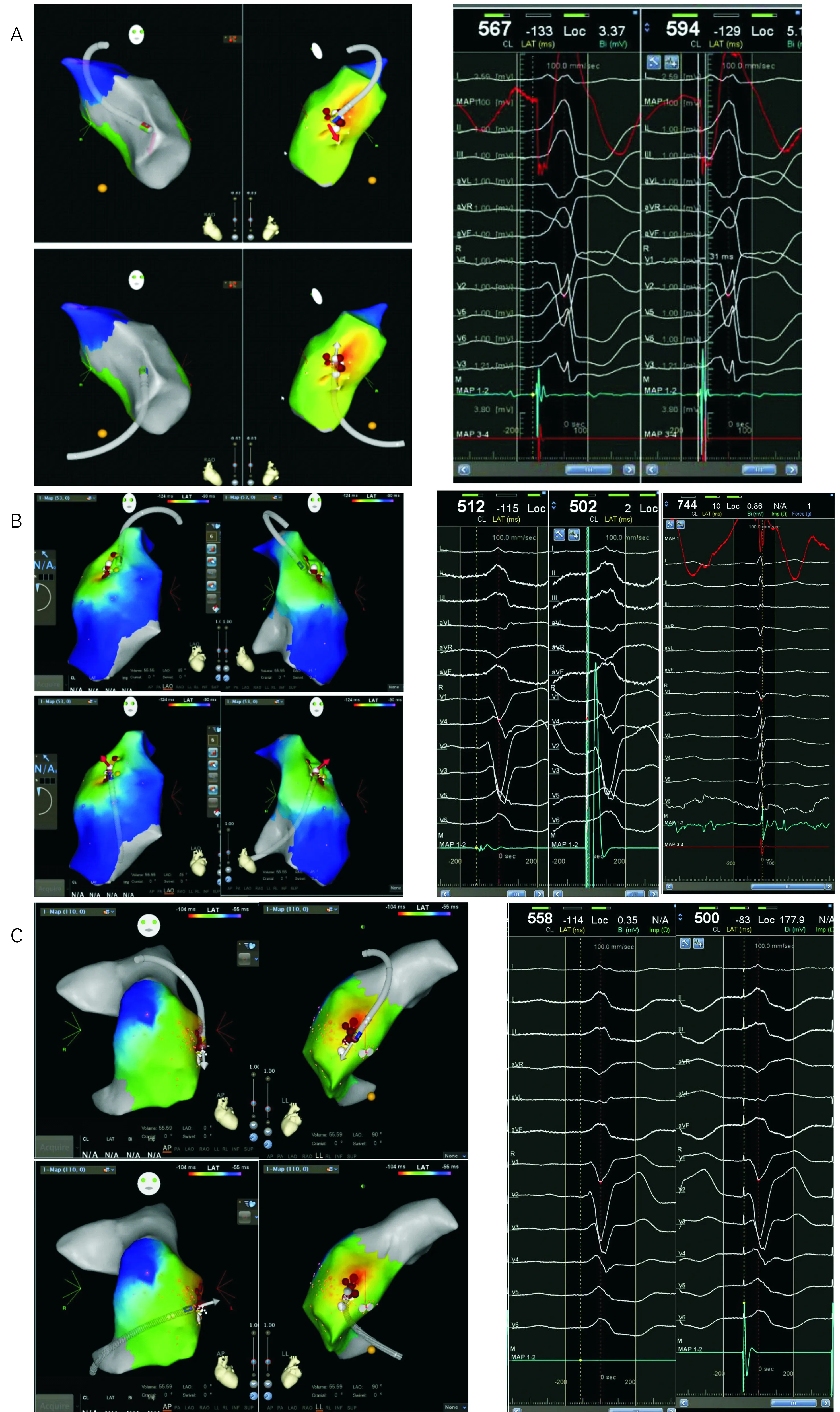
A:右前斜(RAO)及左前斜(LAO)体位观察,PSC-LC与RVOT间隔侧相对应,RVOT间隔标测到的EAS正对PSC-LC标测的EAS下方(左图)。 PSC-LC VAs腔内电图,靶点处大头电位图(右图)。B:右前斜(RAO)及左前斜(LAO)体位观察, PSC-RC与RVOT游离壁偏后处相对,RVOT游离壁标测到的EAS正对PSC-RC标测的EAS下方(左图)。 PSC-RC窦性心律、VAs、及起搏标测腔内电图(右图)。C:后前位(PA)及左侧位(LL)体位观察 PSC-AC起源VAs的靶点位置。PSC-AC与RVOT游离壁偏前部位相对,RVOT游离壁偏前处标测到的EAS正对PSC-RC标测的EAS下方(左图)。 PSC-RC内 VAs及起搏标测腔内电图(右图)
图2三维标测下PSC与RVOT处标测到EAS的相互位置关系及腔内靶点电位图
3.2解剖学基础 RVOT远端为漏斗部心室肌与肺动脉瓣的连接,半月瓣附着在窦管交界处,将PSC与肺动脉干隔开。既往研究[2,7]报道RVOT室早中约21%~46%起源于肺动脉瓣上,且大部分位于瓣上8 mm以上。Gami等[3]通过尸检发现正常人群中有74%存在心室肌向动脉干延伸,其中右室心肌60%向上延伸到PSC-RC,52%延伸到PSC-LC,45%到PSC-AC。Liu等[2]通过心内超声发现,46% RVOT室早起源于肺动脉瓣上,88%的RVOT室早患者存在心室肌延伸。因此,笔者推测PSC内存在心室肌延伸从而多发VAs,这与肺静脉肌袖诱发心房颤动类似。既往鲜有关于PSC起源VAs的报道,可能与对PSC解剖学研究较少相关,且术者较少进行PSC造影或心内超声来精确定位消融位点。近2年关于PSC起源VAs的相关研究逐渐增加[10-11],因此笔者的研究中通过体表心电图定位于RVOT起源的VAs,优先进行PSC标测及消融,得到的结果提示PSC起源VAs的发生率较高。
3.3PSC标测与消融优势 既往常规使用普通弯在流出道及高位的肺动脉进行标测与消融,而Liao等[10]使用倒U的方法可使导管稳定在PSC内,并通过局部造影精确定位消融导管的位置。本研究中,笔者也使用倒U的方法,将消融导管送入右肺动脉或左肺动脉主干,打弯后顺时针或逆时针旋转依次到达各PSC内。起初使用8.5F长鞘以增加导管稳定性,在后续部分病例使用8F短鞘进行操作,同样可以稳定的到位并进行标测及消融。
我们所有患者首先行PSC标测,最早激动点分布在RC、LC、AC,测量最早激动点平均领先体表QRS波(26.2±2.5)ms,明显较RVOT组领先。窦性心律时PSC内可记录到尖峰样晚电位,室早时该电位提前出现,消融成功后该电位均消失,这可能为PSC内向上延伸的心室肌局部激活的近场电位。
RVOT VAs约20% ~30%为游离壁起源,体表心电图表现为QRS波时程较长,下壁导联R波有切迹。游离壁起源室早射频消融术中出现心包压塞的比例较间隔部起源者高。笔者的研究中,体表心电图表现及激动标测最早激动点均提示RVOT游离壁起源者15例,均在PSC RC消融成功。解剖上二者相邻,通过倒U的方法在PSC底部垂直贴靠进行消融比常规方法在RVOT消融具有更高的安全性。

