利用废弃埋藏式心脏转复除颤器行心房高频刺激制作犬心房颤动模型*
刘俊 张浩 夏雨 李晓枫 方丕华
心房颤动(简称房颤)动物模型制作是研究人房颤机制的实验基础。快速心房起搏诱发房颤是常见的房颤模型制作方法之一。然而,该方法的缺点是刺激器的刺激频率固定、并发症发生率高、模型制作时间长难度较大,尤其是制作慢性房颤模型[1]。通过心房高频刺激诱发和制作房颤模型是最近国外常用的一种方法[2],但是需要购置特殊的刺激仪器且价格昂贵。基于在埋藏式心脏转复除颤器(implantable cardioverter defibrillator, ICD)植入术中采用高频刺激可诱发心室颤动的原理,笔者探索采用该方法制作犬阵发性房颤和持续性房颤模型的可行性。
1 材料与方法
1.1实验动物和起搏器 采用成年杂种犬,雌雄不拘,体重在20~25 Kg之间。起搏器采用废弃的植入人体的ICD脉冲发生器(Medtronic Consulta CRT-D, 美国美敦力公司)。起搏脉冲发生器经过表面清洗干净、干燥等处理后再进行环氧乙烷灭菌消毒备用。起搏电极采用标准激素洗脱心房和/或心室被动电极。体外程控仪采用带有远程遥测功能的美敦力公司起搏器体外程控仪。本研究通过阜外医院动物实验伦理委员会批准(伦理批号:2014-3-5-XH)。本动物实验在心血管植入材料临床前研究评价中心北京市重点实验室完成(依托单位阜外心血管病医院动物实验中心)。
1.2起搏器和电极植入术 犬术前6 h禁食、禁饮。静脉注射戊巴比妥钠和地西泮麻醉后固定于动物手术台上。颈部和项背部备皮,气管插管,呼吸机辅助呼吸,连接心电监护仪。常规消毒铺巾右侧颈部和项背部区域,切开皮肤和皮下组织,分离出颈内静脉。在X线透视下经右侧颈内静脉途径将起搏电极放置在右心耳部或/和右室心尖部(图1)。在测试起搏位点参数满意后固定起搏导线,再经皮下隧道送至项背部,连接起搏器脉冲发生器后逐层缝合。植入起搏器术后起搏器基础参数设置为AAI或DDI模式、频率30次/分,心房不应期设置为150 ms,其他参数设置为默认模式。术前和术后肌注青霉素480万单位预防感染治疗3天。动物复苏后开始口服氨酰心安(12.5 mg/次,2次/日)控制心室率。
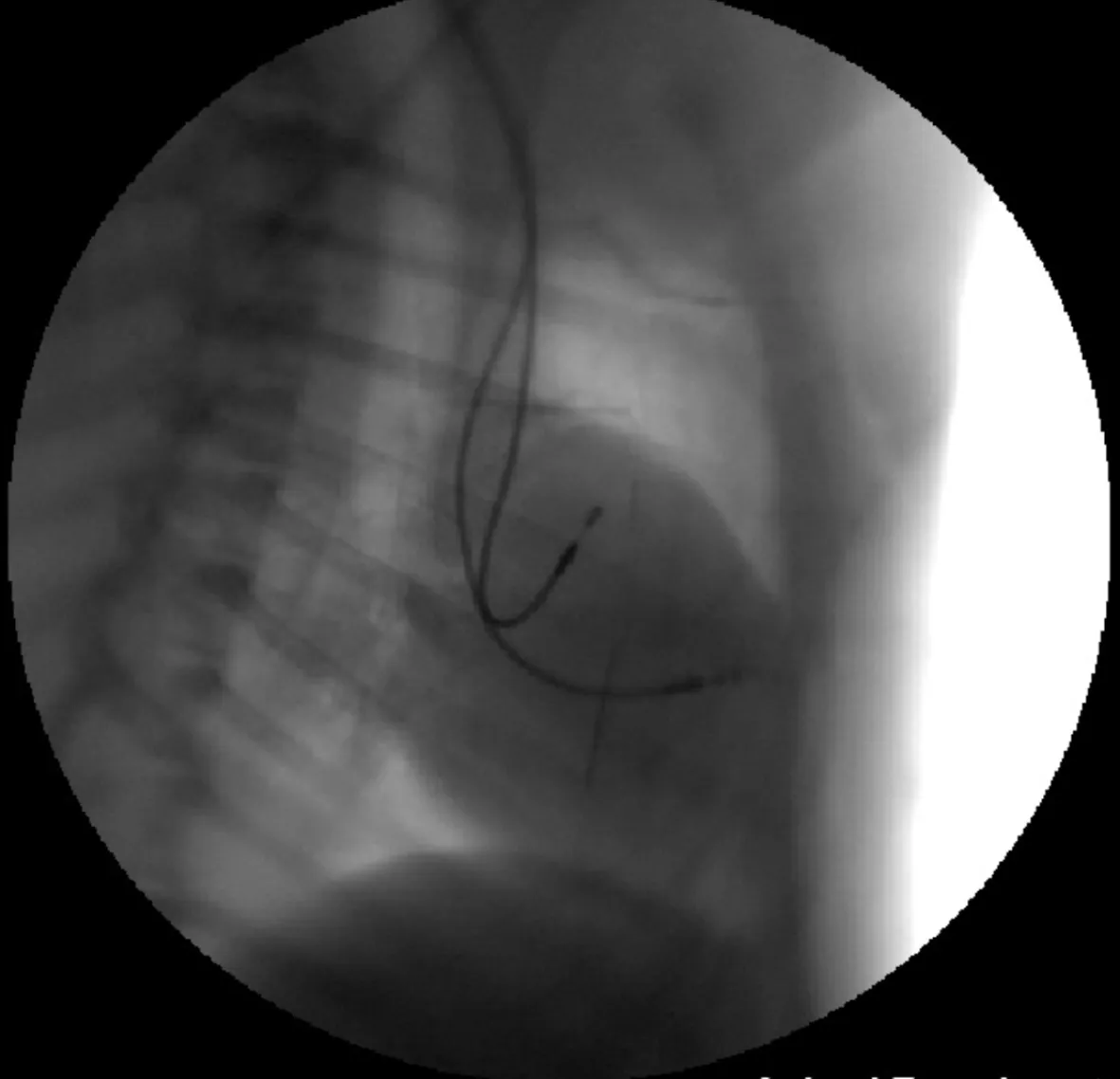
右侧位可见两根电极分别位于心房和心室
1.3高频刺激诱发房颤 植入起搏器1周后开始诱发房颤。打开程控仪,将程控仪探头放置在犬起搏器囊袋附近1~2 s,激活远程遥测功能,无线连接起搏器程控仪与起搏器。心房高频刺激模式参数设置如下:刺激波振幅为4 V、脉宽0.5 ms。持续按压50 Hz Busrt即可释放高频刺激。每次刺激10 s,每日连续刺激2 h或诱发出房颤持续10 min以上。图2显示高频刺激诱发房颤的腔内心电图过程。
1.4房颤及其类型的定义 房颤定义为心房通道记录快速不规律的心电信号,心房通道显示AR(即心房不应期感知)或/和心室通道电信号频率不规则且低于心房通道。阵发性房颤定义为房颤持续时间为2~30 min,持续性房颤定义为房颤持续时间超过30 min以上[1]。
1.5房颤发作事件记录 记录每次刺激后是否出现房颤。如果出现房颤发作,通过程控仪器冻结并存储房颤发作与终止时的信号条图,以便进行离线分析房颤持续的时间。
1.6统计学方法 正态分布的连续性变量以均数±标准差表示,非正态分布的连续性变量以中位数(5%分位数,95%分位数)表示,离散性变量以比值表示。统计分析应用SAS统计软件(Version 9.1版,SAS Institute Inc., Cary, NC, USA.)。
2 结果
2.1基本情况 6只犬均成功植入永久起搏器,其中前3只犬植入心房和心室电极,后3只犬仅植入心房电极。第3只犬在起搏器植入术后第10天因囊袋感染行清创术中死亡,考虑与麻醉意外有关。其余5只犬均顺利完成房颤模型制作。模型制作成功率83%(5/6),犬死亡率17%(1/6)。
2.2房颤模型 采用高频刺激平均刺激18[12, 25]次均可诱发出阵发性房颤模型,平均所需时间3.6[3, 5]日,平均耗电量0.01V。而制成持续性房颤模型需要平均刺激97[83, 117]次,平均所需时间18.6(15, 20)日,平均耗电量0.09[0.07~0.11]V(表1)。
3 讨论
诱发出稳定的房颤是制作房颤动物模型的关键上图显示刺激释放开始前心房和心室通道记录的信号显示规则的窦性心律;心房通道释放高频刺激后诱发出房颤,表现为:①心房通道电信号明显快于心室通道;②由于心房电激动周长<150 ms故表现为心房不应期感知(AR)(中图);③心室通道电信号绝对不规律且频率低于心房通道(下图)。AS为心房自身激动波,AR为心房不应期感知心房波,VS为心室感知自身心室激动波性技术。常见的制作方法包括快速心房起搏、迷走神经刺激、心力衰竭致房颤等方法。快速心房起搏诱发房颤的方法是给予固定频率(300~500次/分)刺激或程序递减刺激直至达到心房不应期,进而诱发房颤[3]。而高频刺激诱发房颤则是通过高频刺激直接诱发房颤发作[2, 4]。高频刺激的范围通常在20~50 Hz。

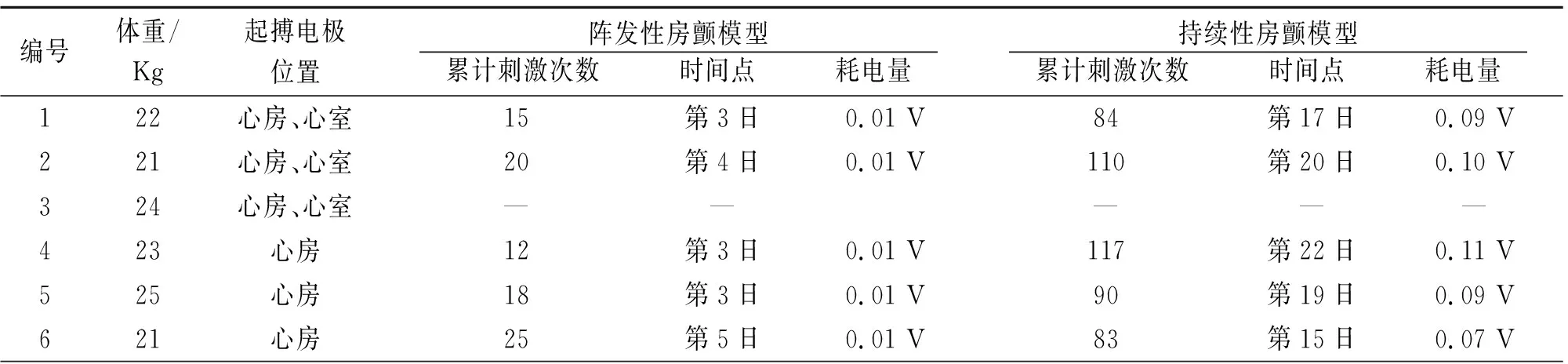
图2 起搏器程控记录心房高频刺激后诱发房颤发作
基于ICD除颤阈值测试时采用高频心室刺激可诱发心室颤动的原理,我们推测利用ICD起搏器程控进行高频心房刺激亦可诱发房颤。本研究结果证实:采用该方法可成功诱发和制作急性和慢性房颤模型。本研究中6只实验犬均成功植入起搏器,5只均成功诱发房颤模型。其中1只犬在清创过程中麻醉意外死亡,与心房高频刺激诱发房颤无关。故本研究证实采用高频刺激制作犬房颤模型是安全有效的。
采用快速心房起搏方法制作犬房颤模型存在下述弊端:①设备费用昂贵。由于目前国内无动物起搏器生产厂家,故该类型起搏器均为进口或定制,费用昂贵且为一次性使用。②起搏频率不能随意更改。目前动物起搏器频率是预设置的,故起搏器植入动物后就不能修改刺激频率。③动物死亡率高。采用固定频率起搏模式,常常因过快的心室率造成实验动物因心力衰竭而死亡。④起搏刺激控制不方便。固定频率起搏器常常利用磁铁功能控制起搏的开启和关闭。由于杂种犬是烈性动物,难以长时间接触,故每次程控均需要麻醉,增加实验动物死亡风险。因此,目前采用快速心房刺激制作犬房颤模型需要寻找一种价格低廉、程控方便、安全且有效的方法。
采用本研究所述方法制作犬房颤模型能有效地解决了上述问题。我们的体会是:①制作成本低。我们对人体废弃的起搏器进行再利用,大大降低了耗材成本。本研究中成功制作犬房颤模型所需耗电量极少,故同一个起搏脉冲发生器可以重复使用,进一步降低实验成本。②起搏频率可控。由于起搏脉冲器可通过程控仪调整参数,故刺激频率和时间均可控,进而避免不适当快速心房频率1∶1快速下传心室诱发心力衰竭等并发症,有利于降低实验动物死亡风险。③起搏刺激方便。我们选择带有遥测功能的起搏器,实现远距离刺激和监测,有效地保护了犬和实验人员的安全。采用这种功能只需要在程控询问时打开遥测功能,程控探头仅需与犬接触1~2 s即可,随后的各种刺激操作均远离试验动物。由于杂种犬为烈性动物,这样可以避免实验人员长时间与犬接触导致误伤的风险。④远程实时观察和记录腔内心电图。通过程控仪器可实时观察心房腔内心电图,准确判断房颤发作状态。利用起搏器房性心律失常事件统计功能还能客观准确评估房颤发作时间和负荷程度。
综上所述,本研究证实采用废弃的具有遥测功能的ICD制作犬房颤模型具有操作简单、安全有效、经济实用等优点,值得推广应用。

