植烟土壤二氯喹啉酸残留检测及对烟株的安全性评估
刘咏松 李磊 杨森 李扬 罗优 张易成 刘文涛 李荣玉 尹显慧


摘要:二氯喹啉酸在土壤中残留易使后茬烟草产生药害。为初步摸清毕节地区植烟土壤中二氯喹啉酸的残留状况,通过高效液相色谱法,测定了烟区土壤中二氯喹啉酸残留量,并观察二氯喹啉酸土壤残留致烟草药害症状及测定其致害临界值,对采样烟区进行植烟安全性评估。结果表明:在添加水平为0.05~0.5 mg/kg范围内,土壤中二氯喹啉酸的平均回收率为89.61%~93.08%,相对标准偏差为3.46%~7.65%。采用该方法对大方县不同烟区土壤样品进行检测,发现5个烟区中黄泥塘镇黄泥村五里组所采土样二氯喹啉酸的残留量最大,为0.506 mg/kg,高于试验所确定的二氯喹啉酸致害临界值0.1 mg/kg,在烤烟生产中存在二氯喹啉酸药害风险的可能性较大。
关键词:二氯喹啉酸;残留;高效液相色谱;植烟土壤;安全性评估
Determination of Auinclorac Residues in Tobacco-planting Soil and Safety Assessment of Tobacco Plants
LIU Yong song,LI Lei,YANG Sen,LI Yang,LUO You,ZHANG Yi cheng,LIU Wen tao,LI Rong yu,YIN Xian hui*
(Institute of Crop Protection, Guizhou University, Guiyang, Guizhou 550025, China)
Abstract:The residue of quinclorac in the soil tends to cause phytotoxicity in the post-mortem tobacco. In order to find out the residual condition of quinclorac in tobacco-planting soil in Bijie area,the detection method of quinclorac was established by high performance liquid chromatography to determine theresidue of quinclorac in soil. Symptoms of the tobacco phytotoxicity caused by the residualquincloracwere observed and the threshold value of damage by quincloracwas tested. According to the test results, safety assessment of the tobacco-planting soil was carried out in the sample area. The results showed that the average recovery rate of quinclorac in soil ranged from 89.61% ~ 93.08% and the relative standard deviation was 3.46%~7.65% in the range of 0.05~0.5 mg/kg. The method was applied todetect soil samples from different tobacco areas in Dafang County. Among the five tobacco areas,the maximum residue of quinclorac in the soil was 0.506 mg/kg, samples collected from Huangni Village,Huangnitang Town. This was higher than the threshold value of damageof 0.1 mg/kg determined by the test. The risk of phytotoxicity from quincloracis more likely to present in flue-cured tobacco production.
Key words:quinclorac; residue; high performance liquid chromatography(HPLC); tobacco-planting soil; safety assessment.
二氯喹啉酸(Quinclorac),3,7-二氯喹啉-8-羧酸,俗名快殺稗、稗草净、神锄和Facet等。德国巴斯夫公司针对稗草、马唐等单子叶杂草和部分阔叶杂草进行研发的一类选择性除草剂,属激素型内吸式喹啉羧酸类除草剂。具有用量少、残效期长、对稗草具有特效等特点,易导致后茬敏感作物产生药害[1-2]。二氯喹啉酸因价格便宜、用量少、药效好等特点,在我国农业生产中对稻田稗草及其他杂草的防除使用较为普遍[3-4];其残留会导致自然生态平衡受到破坏[5-7],且二氯喹啉酸的过量使用将会对作物或后茬轮作作物产生极为严重的药害,并会导致烟草畸形生长[8]。如在小麦-烟草轮作地区,由于前茬麦田使用二氯喹啉酸进行除草,在土壤中的残留会导致后茬烟草出现植株畸形生长,新叶向叶背面内卷皱缩,并逐渐发展成为线型状鼠尾状叶形[9-10]。二氯喹啉酸残留极易对后茬种植的烟草造成药害,严重影响烟草的产量和质量,从而给烟农造成损失[11-12]。
近年来,国内外主要研究二氯喹啉酸的残留检测方法包括液相色谱法、气相色谱法、液质联用法以及毛细管电泳法等。通过这些检测方法对于二氯喹啉酸的药害进行深入的探究,Zhen Mei L等[12]研究表明, pH值在7~8的范围内可有效提高细菌对二氯喹啉酸的降解速率。然而,国内外还鲜有研究报道关于二氯喹啉酸药害烟草植株的安全性评估。本研究通过高效液相色谱法建立二氯喹啉酸残留量检测分析方法,观察二氯喹啉酸土壤残留致烟草药害症状及测定致害临界值,并对烟株的安全性进行评估,探索二氯喹啉酸残留量对烟草生长情况的影响,以期为二氯喹啉酸的安全合理使用提供参考。
1材料与方法
1.1样品的采集与制备
供试土壤采自贵州省毕节市大方县,采集土壤为烟区调查中出现烟株药害现象的植烟土壤,采样时已发生严重药害。使用取土器随机采集5点土壤,混合均匀,进行碎石风干处理,剔除去可见有机物及其他杂物,过 2 mm孔径分样筛,放入-20℃冰箱内保存,用于土壤中二氯喹啉酸残留检测。
1.2仪器与试剂
Waters 600E液相色谱仪(美国 Waters);YS-02型高速粉碎机(北京燕山正德机械设备有限公司);TG 18M型高速离心机(厦门中村光学仪器厂);DHG-9023A电热恒温鼓风干燥箱(上海一恒科技有限公司);JA2003电子天平(上海良平仪器仪表有限公司);HIS10260D超声波清洗机(天津恒奥科技发展有限公司)。二氯喹啉酸标准品(99.07%,国家农药质量监督检验中心)、甲醇(色谱纯)、磷酸(分析纯)、纯净水、50%二氯喹啉酸可湿性粉剂(江苏快达农化股份有限公司)。
1.3分析方法
1.3.1提取
称取10 g土壤样品于250 mL具塞锥形瓶中,加入30 mL甲醇/0.01%磷酸水溶液(3∶1,V/V),浸泡2 h后转至恒温振荡器中震荡提取1 h,将提取液转移至50 mL离心管中,5000 r/min离心机离心5 min,滤纸过滤,取上清液30 mL旋转蒸发仪进行蒸发,使用10 mL色谱纯进行定容后用0.45 μm的有机膜过滤,待高效液相色谱测定。
1.3.2高效液相色谱检测条件
色谱柱:Agilent 300SB-C18(4.6×250 mm,5 μm);检测器:Waters 2487紫外检测器;流动相:甲醇/水(50∶50,V/V),使用前用0.45 μm的滤膜过滤;流速:1.0 mL/min;柱温:27℃;检测波长:220 nm;进样量:10 μL。
1.4二氯喹啉酸土壤残留致烟草药害症状及其致害临界值
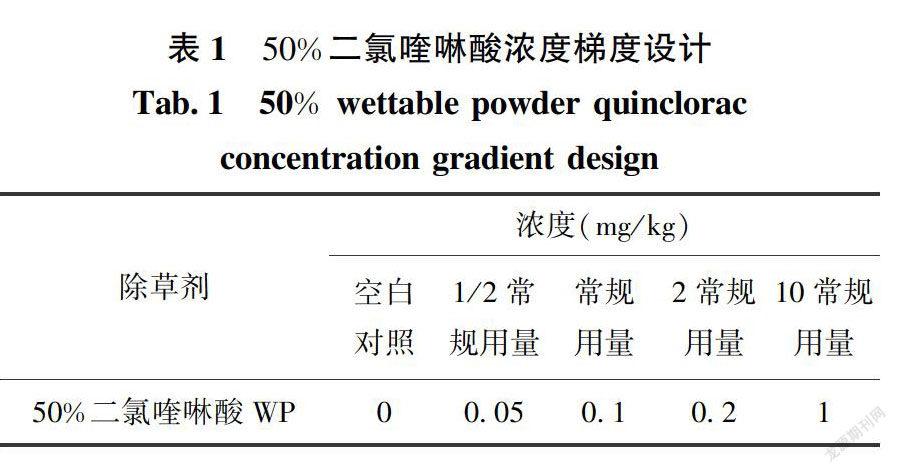
试验设计二氯喹啉酸浓度梯度如下表1所示。
育苗:选取颗粒饱满的烟草种子,先用0.5%CuSO4溶液浸泡15 min,再用蒸馏水冲洗数次,并用MS培养液进行浸泡并置于光照培养箱中,进行催芽,12 h光照12 h黑暗,温度为26℃,催芽时间48 h。待种子露白时,进行土表播种,采用漂浮育苗。待其长至三叶期进行移栽。
施药:称取无二氯喹啉酸残留的供试土壤若干份,分别向其喷洒不同浓度的二氯喹啉酸溶液,使其在土壤中的浓度符合设定的浓度,并保持土壤含水量在60%左右。
移栽:对于每一种浓度的二氯喹啉酸,选取长势相近的健壮烟苗进行移栽至花盆(d=25 cm,h=20 cm)中。定期观察烟株长势情况并测量烟株株高,以及从下到上数第4~5片叶的叶宽、叶长,计算株高、叶长、叶宽抑制率。
临界值取值:株高抑制率、叶长抑制率及叶宽抑制率为10%~15%时的施药浓度,以株高抑制率作为主要参考标准。
1.5烟叶药害标准
烟叶药害标准参照烟草行业标准YC/T526-2015。按照药害的严重程度分为6级。 0级:全株无畸形;1级:心叶轻微皱缩或变形,叶宽抑制率5%以下,其他叶平展;3级:全株三分之一以下叶片出现叶缘、叶尖向叶背轻微卷曲,叶宽抑制率6%~10%;5级:全株三分之一至二分之一叶片出现叶缘向叶背卷曲或叶面扭曲,叶宽抑制率11%~30%;7级:全株二分之一以上叶缘严重向叶背面翻卷,叶宽抑制率在31%~50%;9级:所有叶片叶面向叶背严重翻卷,叶宽抑制率在50%以上。
2结果与分析
2.1标准曲线的绘制
将二氯喹啉酸标准品用甲醇配制成质量浓度分别为0.1、0.5、1、5、10 mg/L系列标准工作溶液,在最佳色谱条件下进行测定,得到不同浓度下标准溶液的峰面积。以色谱峰面积为纵坐标,进样质量浓度为横坐标,绘制标准曲线。質量浓度为1 mg/L二氯喹啉酸标样的色谱图如图1所示,其保留时间为4.1 min。在0.1~10 mg/L范围内,二氯喹啉酸色谱峰面积和进样质量浓度间均呈良好的线性关系(见图2),所得回归方程为:y=23446x-181.7,相关系数r为0.9995。
2.2最低检出浓度
在上述最佳检测条件下,二氯喹啉酸的最低检出量为1.0×10-10 g,土壤中的最低检出浓度为0.05 mg/kg。
2.3准确度和精密度
准确称取10 g土壤,分别添加二氯喹啉酸0.05 mg/kg、0.1 mg/kg、0.5 mg/kg三个水平,重复3次,按照上述处理方法和仪器条件进行测定,得到不同质量浓度下的回收率(见表2)。在0.05~0.5 mg/kg添加浓度范围内,土壤中二氯喹啉酸的平均回收率为89.61%~93.08%,相对偏差为3.46%~7.65%。
2.4二氯喹啉酸施用量对烟草生长的影响
通过图3可以看出,60天后土壤中常规含量的叶长的抑制率为9.65%;叶宽的抑制率为15.93%;株高抑制率为5.47%。随着二氯喹啉酸使用浓度的升高,叶长、叶宽、株高的抑制率升高。可见,二氯喹啉酸土壤残留致烟草药害临界值为0.1 mg/kg,因此,只要土壤中二氯喹啉酸含量超过临界值,二氯喹啉酸就会对烟株产生药害,影响烟苗的生长,特别是对烟株的叶宽有显著影响。当浓度为1 mg/kg时,即常规浓度的10倍,农艺性状抑制率最高,植株的所有叶片严重往叶背翻卷,叶宽的抑制率为82.24%。
2.5测定结果
从贵州省毕节市大方烟区采集到的不同植烟土壤样品,按照样品的提取方法进行提取,后用液相色谱检测。分别测定了5 份植烟土壤样品,检测结果见表3。由表3可以看出,植烟土壤样品中二氯喹啉酸的残留量在0.190~0.506 mg/kg之间。其中采集于黄泥塘镇黄泥村五里组的土壤样品中二氯喹啉酸的检出量最高,为0.506 mg/kg;采集自黄泥塘镇黄泥村六合组的土壤样品次之,为0.362 mg/kg;采集自黄泥塘镇化联村的土壤样品二氯喹啉酸的检出含量最低,为0.190 mg/kg。根据试验所确定的二氯喹啉酸致害临界值为0.1 mg/kg,可知采样区域不适宜种植烟草,在该区域种植烟草会产生不同程度的残留药害。
3结论与讨论
目前对二氯喹啉酸的研究主要集中在药效试验、在稻田上的残留动态和降解等方面。二氯喹啉酸的测定方法主要有液相色谱法[13-16]、气相色谱法[17]、毛细管电泳法[18]等。相对而言,液相色谱法的测定更为广泛,样品前处理较为简单。
通过对贵州省毕节市大方县烟草种植基地的植烟土壤进行采样检测分析,采样地区植烟土壤中的二氯喹啉酸残留量均超过了二氯喹啉酸对烟草的致害临界值。因此,在该地区进行烟草种植会产生药害,而在该地区进行烟草种植的药害风险程度也各不相同,部分残留严重的地块可能会出现线状或鼠尾状叶型。另一方面由于试验的局限性,各地域小气候不同,仍需对该地区进行进一步的探讨,如土壤中二氯喹啉酸残留的降解方法,能否使该地区二氯喹啉酸的残留量趋近于甚至低于其致害临界值以减小发生药害的可能性,尽可能的降低在该地区种植烟草发生除草剂药害的风险,这些问题还有待研究。
参考文献:
[1]张勇,张志国,苑学霞.几种冷季型草坪草苗期对二氯喹啉酸的耐药性试验[J].中国草地,2004(04):51-56.
[2]陈泽鹏,王静,万树青,等.广东部分地区烟叶畸形生长的原因及治理的研究[J].中国烟草学报,2004,10(3):34-37.
[3]苏瑞芳,阮海根.快杀稗防除直播稻田稗草的研究[J].杂草学报,1991,5(3):32-38.
[4]张勇,张志国,苑学霞.几种冷季型草坪草苗期对二氯喹啉酸的耐药性试验[J].中国草地,2004,26 (4):51-56.
[5]Pretto A, Loro V L,Menezes C,et al.Commercial formulation containing quinclorac and metsulfuron-methyl herbicides inhibit acetylcholinesterase and induce biochemical alterations in tissues of Leporinus obtusidens[J].Ecotoxicology and Environmental Safety,2011,74(3):336-341.
[6]Grossmann K, Kwiatkowski J.The mechanism ofquinclorac selectivity in grasses[J].Pesticide Biochemistry & Physiology, 2000, 66(2):83-91.
[7]Ueji M,Inao K.Rice paddy field herbicides and their effects on the environment and ecosystems[J].Weed Biology and Management,2001,1(1):71-79.
[8]谢建平,练德进.二氯喹啉酸对水稻秧苗的药害及预防措施[J].湖北植保,2013(1):45-46.
[9]陈荣华,张祖清,申昌优,等.烟叶生产中的除草剂药害[J].江西农业学报,2008,20(7):116-117.
[10]杨森,黄化刚,龙友华,等.除草剂土壤残留臻烟草药害及其修复技术[J].2017,36(3):061-067.
[11]宰文珊,吴永汉,李妙寿.水稻—番茄轮作注意预防除草剂药害[J].中国蔬菜,2011(9):28.
[12]王广元,关成宏,王险峰.几种除草剂对后茬作物的影响[J].现代化农业,1998(8):11-12.
[13]朱流红,黄化刚,李荣玉,等.50%二氯喹啉酸WP替代药剂的筛选[J].2017,36(4):039-042.
[14]Zhen Mei L, Zi Mu L I, Sang L Y, et al.Characterization of a Strain Capable of Degrading a Herbicide Mixture of Quinclorac and Bensulfuronmethyl [J].Pedosphere, 2008, 18(5):554-563.
[15]张倩,郭伟,宋超,等.二氯喹啉酸在不同土壤中的降解规律及其影响因子[J].中国烟草科学,2013,34(6):83-88.
[16]陈泽鹏,王静,万树青,等.烟区土壤残留二氯喹啉酸的消解动态[J].农药,2007,46(7):479-480.
[17]李丽春,陈泽鹏,张万良,等.二氯喹啉酸在土壤、畸形烟叶和烤烟中残留量的比较分析[J].农药,2012,51(2):127-129.
[18]Lamoureux G L, Rusness D G.Quinclorac Absorption, Translocation, Metabolism, and Toxicity in Leafy Spurge ( Euphorbia esula )[J].Pesticide Biochemistry & Physiology, 1995, 53(3):210-226.
[19]王一茹,刘长武,牛成玉,等.二氯喹啉酸在稻田水、土壤和作物中残留动态研究[J].环境科学,1996,17(1):27-30.
[20]贾菲,高贵,郑良玉.除草剂二氯喹啉酸的毛细管电泳分析[J].分析化學,2008,36(10):1440-1442.

