钠-钙交换体单克隆抗体NCX-2D2对异丙肾上腺素诱发成年大鼠心律失常的抑制作用
薛晓艳,王苗苗,王晓露,杨明珠,吴博威,封启龙
(1. 山西医科大学生理学系,细胞生理学省部共建教育部重点实验室,山西 太原 030001;2. 山西医科大学晋祠学院机能教研室,山西 太原 030025;3. 中山大学中山医学院,广东 广州 510080)
近年来,随着社会经济发展和国民生活方式的改变,我国心血管疾病的发病率及病死率逐年上升[1]。心律失常是其中较常见的临床表现,尤其是诸多恶性心律失常如室性心动过速、心室颤动,可对患者造成致命的影响。目前,抗心律失常药物的效果并不理想,有效率约为30%~60%[2],并且往往具有诱发新的心律失常或使原有心律失常加重的风险。因此,探究心律失常发生的机制,研发新的抗心律失常药物仍是目前研究的热点问题之一。
据文献报道,心律失常的发生与细胞内钙稳态关系密切相关[3]。心肌细胞内钙离子稳态的维持有赖于多种钙调控蛋白,其中一种重要的钙调控蛋白为细胞膜上的钠-钙交换体(sodium-calcium exchanger,NCX)[4]。它在多种细胞广泛存在,在心肌细胞表达尤为丰富,对心肌细胞的钙转运起着关键作用。NCX是一种双向离子转运体,有两种工作模式:前向模式(forward mode)将3个钠离子转入细胞内,1个钙离子转出细胞;反向模式(reverse mode)将1个钙离子转入细胞内,3个钠离子转出细胞。因此,NCX具有生电性,其产生的电流称为钠-钙交换电流(INa/Ca)。在病理情况下,NCX是导致细胞内钙超载机制的主要原因。例如,在心肌缺血/再灌注损伤和心力衰竭的情况下,细胞内Na+水平的增加将促使反向模式NCX活动增强,从而促进钙超载引起心脏功能障碍[5-6]。此外,伴随着舒张期NCX钙外排产生的内向跨膜离子流也会增大,形成短暂的基础内向离子流,这种内向电流是心肌病理状态下发生延迟后除极(delayed after depolarization,DADs)及心律失常的重要原因[7-8]。
大量研究表明,α肽段的重复序列α-1和α-2是NCX发挥作用的关键区域[9-10],因此,其所对应的抗体有可能对NCX起调控起作用。本实验室前期研究已经证实,钠-钙交换体α-2(840-877)3F10单克隆抗体对单个大鼠心室肌细胞INa/Ca有一定的抑制作用,对INa、IK1、Ito等均未见明显作用。此外,该抗体还可以抑制缺血/再灌注诱发的心律失常[11]。本实验经异丙肾上腺素(isoproterenol,ISO)建立大鼠在体和离体心律失常模型,研究NCX单克隆抗体α-2(840-877)2D2的抗心律失常作用,并通过全细胞膜片钳技术探究其作用机制。
1 材料与方法
1.1实验动物健康成年SPF级SD大鼠,♂,体质量(235±15)g,购自山西医科大学动物实验中心,许可证号:SCXK-(晋)2015-0001。动物饲养条件为室温(23~25) ℃、自由饮水、进食。
1.2药物与试剂胶原酶P购自瑞士Roche公司;ISO购自英国Tocris公司;牛磺酸、HEPES、L-谷氨酸、氢氧化铯(CsOH)等购自美国Sigma公司;其余试剂均为国产分析纯产品。分泌单克隆NCX-2D2抗体的杂交瘤细胞株是利用NCX α-2第840-877位氨基酸残基肽段免疫小鼠脾细胞和SP2/0骨髓瘤细胞融合制成,并由美国Invitrogen公司制备;NCX-2D2抗体的纯化由北京华大蛋白质研发中心有限公司制备。
1.3仪器Axopatch200B膜片钳放大器(美国Axon Instruments公司);BL-420F生物机能实验系统(成都泰盟科技有限公司);Langendorff心脏灌流系统(澳大利亚AD Instruments公司);Digidate1440A数模转换器(美国Axon Instruments公司);电动式微操纵器(Sutter Instruments公司);倒置显微镜(日本Olympus公司);微电极拉制仪(Narishige公司)。
1.4溶液配制
1.4.1台氏液(mmol·L-1) HEPES 5.0、MgCl21.0、KCl 5.4、葡萄糖10.0、NaH2PO40.33、NaCl 140、CaCl21.8配制,经NaOH调节pH至7.38~7.40。
1.4.2KB 液(mmol·L-1) MgSO43.0、牛磺酸 20.0、EGTA 1.0、KH2PO425.0、L-谷氨酸50.0、HEPES 10.0、KCl 40.0、葡萄糖10.0,使用KOH调节pH至7.38~7.40。
1.4.3酶液 在无钙台氏液中加入胶原酶P 0.07~0.10 g·L-1、牛磺酸 20.0 mmol·L-1,经NaOH调节pH至7.36~7.40。
1.4.4Na+/Ca2+交换电流电极内液与L-型钙电流电极内液(mmol·L-1) 配制见参考文献[11]。
1.4.5动作电位内液与动作电位外液 动作电位内液(mmol·L-1):磷酸肌酸二钠盐 5.0、KCl 140.0、HEPES 10.0、Mg-ATP 5.0、MgCl22.0配制,并经KOH调节pH至7.20。动作电位外液(mmol·L-1): KCl 5.4、葡萄糖 10.0、CaCl22.5、HEPES 10.0、NaCl 134.0、MgCl21.0配制,并经 NaOH调节pH至7.38~7.40。
当运动产生的加速度影响较大时,需要加速度分离算法分离出重力加速度分量与陀螺仪参数进行融合进行校准。由探测器的飞行规律可知,运动加速度主要作用于载体的前进方向X,导致加速度计传感器的z轴方向测量数据出现偏差,而加速度计的x轴和y轴和运动方向垂直,测量值为重力加速度的分量且不受运动影响。如式(8)所示,利用x轴和y轴的加速度计测量数据可以对z轴的重力加速度分量进行估计,获得重力加速度三轴分量,并可进一步获得运动加速度。式中aX的方向可以结合当前姿态角获得。
1.5NCX-2D2抗体的制备运用化学合成的NCX-2D2第(840-877)肽段作为抗原对小鼠进行免疫,经过ProteinA亲和柱可得到纯化的免疫血清,应用SDS-PAGE法和ELISA法,对所得抗体进行纯度和滴度检测,可得到纯度较高的2D2抗体。
1.6离体心律失常模型的建立大鼠经40 mg·kg-1戊巴比妥钠溶液腹腔注射麻醉,开胸心脏离体后,悬挂于Langendorff 装置,用高钙台氏液行主动脉逆行灌流,流速为8 mL·min-1,同步记录心电图,待心脏活动稳定后,药泵给药。实验分组: ① 对照组:含2.5 mmol·L-1CaCl2的台氏液灌流;② 2D2 抗体+CaCl2组:含10 mg·L-1NCX-2D2抗体、2.5 mmol·L-1CaCl2的台氏液灌流;③ ISO+CaCl2组:含1 μmol·L-1ISO、2.5 mmol·L-1CaCl2的台氏液灌流;④ 2D2抗体+ISO+CaCl2组:含10 mg·L-1NCX-2D2抗体、1 μmol·L-1ISO、2.5 mmol·L-1CaCl2的台氏液灌流。观测各组离体大鼠心脏心电图改变,记录给予药物后30 min内室性早搏发生的个数,室性心动过速的发生率和持续时间,心室颤动的发生率和持续时间。
1.7在体心律失常模型的建立成年健康SD大鼠称重,10%水合氯醛(3 mL·kg-1)腹腔注射麻醉,仰卧位固定于手术台,连接BL-420F生物机能实验系统,记录Ⅱ导联心电图,监测稳定后,通过尾静脉给药。实验分组如下:① 对照组:1 mL生理盐水(NS)尾静脉注射;② 2D2抗体组:80 μg·kg-1NCX-2D2抗体溶于1 mL NS中尾静脉注射;③ ISO组:1.28 mg·kg-1ISO溶于1 mL NS中尾静脉注射;④ 2D2抗体+ISO组:80 μg·kg-1NCX-2D2抗体溶于0.5 mL NS中尾静脉注射,5 min后1.28 mg·kg-1ISO溶于0.5 mL NS中尾静脉注射;⑤ 胺碘酮+ISO组:5 mg·kg-1胺碘酮溶于0.5 mL NS中尾静脉注射,5 min后1.28 mg·kg-1ISO溶于0.5 mL NS中尾静脉注射。观测各组大鼠体表心电图,记录经药物干预后1 h内室性早搏发生的个数,室性心动过速的发生率和持续时间,心室颤动的发生率和持续时间。
1.8全细胞膜片钳记录
1.8.1单个大鼠心室肌细胞的分离 健康SD大鼠,用戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉后,开胸取出心脏,置于预先经纯氧充灌的4℃无钙台氏液中,剪去多余组织,主动脉逆行插管悬于Langendorff灌流装置。以无钙台氏液灌流心脏8~10 min后,用酶液循环灌流15~20 min,待心脏酶解后,在KB液中将左心室肌组织剪碎,用吸管吹打3~5 min后,经滤网过滤(150 μm孔径)取得单个心室肌细胞,并于KB液中保存,稳定后进行实验。
1.8.2全细胞膜片钳的记录 吸管吸取细胞悬液1~2滴,滴于倒置显微镜的细胞槽(约1 mL)内,贴壁 8~10 min,再用含钙台氏液复钙灌流(流速2 mL·min-1)。电极拉制仪拉制玻璃电极,充灌电极内液,电阻为3~5 MΩ。镜下挑选纹理清晰、无自主收缩的长杆状细胞为实验对象,用玻璃电极给予负压封接,并迅速回抽给予负压破膜,用膜电容补偿和串联电阻补偿后,进行全细胞记录。数据采集,保存及分析备用。
1.8.3单个心室肌细胞Na+/Ca2+交换电流的记录 在电压钳模式下,钳制电位于-40 mV,通过+60 mV ~ -120 mV的斜坡电压刺激(90 mV·s-1),5.0 mmol·L-1的NiCl2特异性阻断Na+/Ca2+交换电流,阻断前后的电流差为Ni2+敏感的Na+/Ca2+交换电流。
1.8.4单个心室肌细胞L-型钙电流的记录 L-型钙电流(ICa-L)的记录参照参考文献[11]。膜电流的大小用电流密度表示(单细胞电流值/细胞膜电容值,pA/pF)。
1.8.5单个心室肌动作电位(AP)及DADs 在电流钳模式下,用动作电位外液进行灌流,并记录动作电位。给予细胞15 ms、3 Hz连续5次刺激诱发动作电位,之后给予药物诱发DADs。

2 结果
2.1单克隆抗体NCX-2D2对ISO诱发大鼠离体心脏心律失常的作用结果表明,10 mg·L-1NCX-2D2抗体可明显抑制ISO诱发大鼠离体心脏心律失常的出现。给予ISO后,30 min内大鼠室性心动过速的发生率为100%,持续时间为(187.81±23.14)s;心室颤动的发生率为57.14%,持续时间为(9.29±8.94)s;室性早搏个数为(328±22)(P<0.01)。在给予10 mg·L-1NCX-2D2抗体和ISO灌流后30 min内,大鼠室性早搏个数降低至(104±9);室性心动过速持续时间缩短至(11.29±15.84)s,室性心动过速发生率降低至42.8%;心室颤动完全消失(P<0.01)。见Tab 1、Fig 1。
2.2NCX-2D2对ISO诱发麻醉大鼠心律失常的作用结果表明,NCX-2D2抗体可明显抑制ISO诱发麻醉大鼠心律失常的发生。给予ISO后1 h内,大鼠室性心动过速的发生率为100%,持续时间(40.73±3.06)min;心室颤动发生率为57.14%,持续时间(4.57±4.46)min;室性早搏个数为(774±31)。在给予ISO前5 min,预先给予80 μg·kg-1NCX-2D2抗体干预后1 h内,大鼠心室颤动完全消失,室性心动过速发生率降低至42.8%,持续时间缩短至(0.90±1.13)min;室性早搏个数减少至(168±33)。80 μg·kg-1NCX-2D2抗体抑制由ISO诱发麻醉大鼠室性心律失常的作用与胺碘酮相似,甚至在抑制早搏方面略优于胺碘酮(P<0.01)。见Tab 2、Fig 2。

Fig 1 Effect of NCX-2D2 antibody on ISO -induced arrhythmiasin vitro rat hearts by representative electrocardiogramtraces(recorded fromⅡlimb leads)
A: Trace from Tyrode group; B: Trace from NCX-2D2 antibody (10 mg·L-1) treated group; C: Trace from ISO (1 μmol·L-1) treated group; D: Trace from ISO (1 μmol·L-1) and NCX-2D2 antibody (10 mg·L-1) treated group; E: Examples of arrhythmias recorded from rats in the present study. a: Normal ECG; b: Premature ventricular contraction bigeminies; c: Premature ventricular contraction trigeminies; d: Ventricular tachycardia; e: Ventricular fibrillation.

Tab 1 Effects of NCX-2D2 antibody on arrhythmia induced by ISO in vitro adult rat hearts(n=7)
PVB: Premature ventricular beats; VT: Ventricular tachycardia; VF: Ventricular fibrillation; 2D2: NCX-2D2 antibody.**P<0.01vscontrol;##P<0.01vsISO.

Tab 2 Effects of NCX-2D2 antibody on arrhythmia induced by ISO in anesthetized rats in vivo(n=7)
**P<0.01vscontrol;##P<0.01vsISO;△△P<0.01vsamiodarone

Fig 2 Effect of NCX-2D2 antibody on ISO-inducedarrhythmias in vivo rat hearts by representativeelectrocardiogram traces (recorded fromⅡlimb leads)
A:Trace from NS group; B: Trace from NCX-2D2 antibody (80 μg·kg-1) treated group; C: Trace from ISO (1.28 mg·kg-1) treated group; D: Trace from ISO (1.28 mg·kg-1) and NCX-2D2 antibody (80 μg·kg-1) treated group; E: Trace from Amiodaron (5 mg·kg-1) and ISO treated group; F: Examples of arrhythmias recorded from rats in the present study. a: Normal ECG; b: Premature ventricular contraction bigeminies; c: Ventricular tachycardia; d: Ventricular fibrillation.
2.3NCX-2D2可部分逆转ISO对单个大鼠心室肌细胞INa/Ca的增大作用在电压钳模式下,钳制电位-40 mV,给予+60 mV ~ -120 mV的斜坡电压刺激(90 mV·s-1),经5.0 mmol·L-1的NiCl2特异性地阻断INa/Ca,阻断前后的电流差即为Ni2+敏感的Na+-Ca2+交换电流(Fig 3)。
钳制电位于+50 mV和-100 mV时,与对照组相比,ISO组心室肌细胞INa/Ca明显增大(P<0.01)。ISO未洗脱给予5 mg·L-1NCX-2D2抗体后,INa/Ca的外向和内向电流与ISO组相比明显降低,但并没有恢复至正常水平。此抗体对INa/Ca外向(+50 mV)和内向(-100 mV)电流的抑制率分别为28%和20%(P<0.01)。见Tab 3、Fig 4。

Fig 3 Measurement of Ni2+sensitive Na+-Ca2+exchange current (INa/Ca) in rat ventricular myocytes
A:Current-voltage relationship before (a) and after (b) application of 5.0 mmol·L-1NiCl2; B: Ni2+-sensitiveINa/Ca(numerical subtraction of a-b).
2.4NCX-2D2可部分抑制ISO对单个大鼠心室肌细胞ICa-L的增大作用Fig 5结果显示,与对照组相比,ISO组心肌细胞ICa-L明显增大(P<0.01)。应 用5 mg·L-1NCX-2D2抗体后,与ISO组相比,ICa-L明显降低,但并没有恢复至正常水平(P<0.01),此抗体对ICa-L的抑制率为19%。

Tab 3 Effects of NCX- 2D2 antibody and ISO on INa/Cain isolated rat ventricular myocytes(n=7)
**P<0.01vscontrol;##P<0.01vsISO
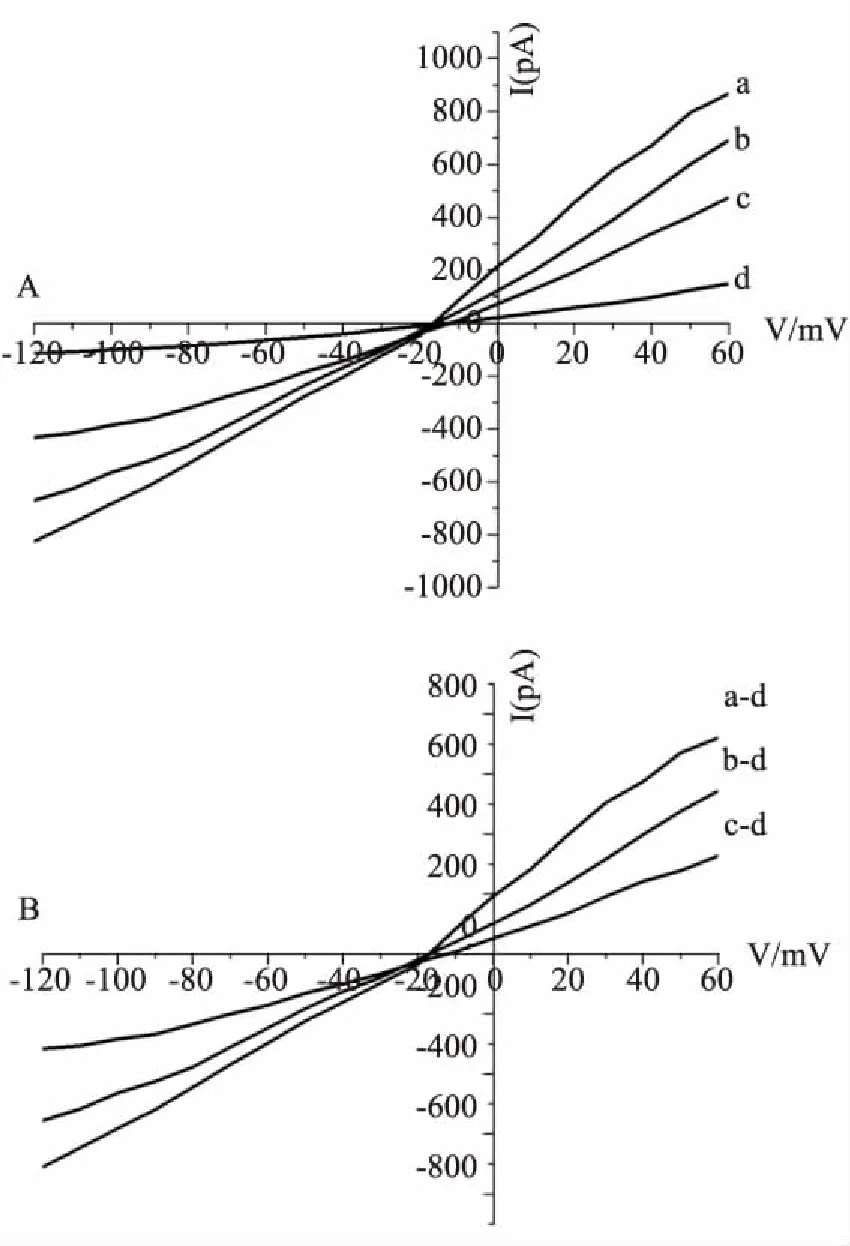
Fig 4 Inhibitory effect of NCX- 2D2 antibody on ISO-induced increase INa/Ca in normal rat ventricular myocytes
A: Current-voltage relationship. a: ISO(1 μmol·L-1); b: ISO(1 μmol·L-1) +2D2(5 mg·L-1); c: Control; d: Application of 5.0 mmol·L-1NiCl2; B: Current-voltage relationship. Ni2+-sensitiveINa/Caof ISO: (a-d); Ni2+-sensitiveINa/Caof ISO+2D2: (b-d); Ni2+-sensitiveINa/Caof control:(c-d).
2.5NCX-2D2对ISO诱发单个大鼠心室肌细胞动作电位DADs的抑制作用在电流钳模式下,记录动作电位DADs。DADs的产生可通过连续刺激(频率15 ms、3 Hz)诱发。Fig 6结果表明,对照组与NCX-2D2抗体组都没有出现DADs;给予ISO(1 μmol·L-1)后,单个大鼠心室肌细胞DADs发生率为85.71%;而给予5 mg·L-1NCX-2D2抗体干预后,可有效抑制ISO诱发的单个大鼠心室肌细胞DADs的发生,其发生率降低至14.29%,与ISO组相比明显降低(P<0.05)。

Fig 5 Inhibitory effect of NCX- 2D2 antibody on ISO-induced increase ICa-L in normal rat ventricular myocytes

Fig6InhibitoryeffectofNCX-2D2antibodyonISO-inducedDADsinnormalratventricularmyocytes
a: Control; b: 5 mg·L-1NCX-2D2; c: 1 μmol·L-1ISO; d: 5 mg·L-1NCX-2D2+1 μmol·L-1ISO.
3 讨论
最新研究提出,NCX新的结构模型为10次跨膜[12],α-2序列可能位于细胞外侧,这解释了2D2抗体从胞外侧发挥作用的机制,这与传统的9次跨膜的二级结构模型不同,不同之处主要在于第7跨膜段之后肽链的空间排列。本研究选取NCX α-2(840~877)肽段作为抗原,制备获得NCX-2D2单克隆抗体,并且观察了该抗体对ISO诱发成年大鼠心律失常的影响。结果表明,钠-钙交换体单克隆抗体NCX-2D2对ISO诱发的大鼠离体和在体心律失常均有明显抑制作用。利用全细胞膜片钳技术研究发现,该抗体可部分逆转ISO对INa/Ca及ICa-L的增大作用,对ISO诱发的DADs也有明显的抑制作用。因此推断,其抗室性心律失常的机制主要与抑制心肌细胞钠-钙交换体和L-型钙通道,减轻胞内钙超载、抑制DADs有关。大量文献报道,DADs在多种心律失常的发生中具有重要作用[13],其发生主要与胞内钙超载和INa/Ca增强有关。本研究中,ISO可激活β受体,使细胞膜腺苷酸环化酶的活性增加,提高细胞内cAMP的浓度,通过cAMP蛋白激酶系统,增大钙内流,从而加重细胞内钙超载,而胞内钙超载又会导致钠-钙交换活动增强,通过产生一过性的内向电流,参与诱发DADs[14]。
本研究选用ISO建立大鼠心律失常模型。 ISO属于儿茶酚胺类药物,主要作用于β受体,使心肌收缩力增强,心率加快,传导加速。但临床使用不当也有致心律失常的副作用,尤以室性心动过速及心室颤动等恶性心律失常较为多见[15]。本实验在制备获得钠-钙交换体2D2抗体的基础上,为了达到抗心律失常的目的,拟通过抑制钠-钙交换体和L-型钙通道的异常活动,使心肌细胞内的钙超载减轻。实验结果显示,钠-钙交换体NCX-2D2抗体可有效抑制ISO对大鼠心室肌细胞INa/Ca及ICa-L的增大作用,同时还可明显抑制ISO诱发心肌细胞DADs的发生,阐明了NCX-2D2抗体抗心律失常的主要电生理机制。
综上,本研究证实钠-钙交换体单克隆抗体NCX-2D2可明显抑制由ISO诱发的大鼠室性心律失常,其抗室性心律失常的机制与抑制钠-钙交换体和L-型钙通道,减轻钙超载、抑制DADs有关。本研究结果为临床预防和治疗儿茶酚胺类药物相关性心律失常的发生提供了一定的理论依据和实验证据。
(致谢:本研究在山西医科大学生理学系细胞生理学省部共建教育部重点实验室完成,感谢吴博威教授和赵录英老师给予的技术指导。)

