缺血后处理对体外循环心脏瓣膜 置换患者心电图的影响
王焰斌,崔 刚,黄志勇,刘志红,郭建洲,张 锐,杨建安
(1. 广东省深圳市孙逸仙心血管医院麻醉科,广东深圳 518057;2. 西安交通大学医学部病理系,陕西西安 710061; 3. 广东省深圳市孙逸仙心血管医院心外科,广东深圳 518057)
体外循环(cardiopulmonary bypass, CPB)心脏直视手术将不可避免发生心肌缺血再灌注损伤(MIRI),其重要表现是再灌注心律失常,如室早(ventricular premature beat, VPB)、室速(ventricular tachycardia, VT)、室颤(ventricular fibrillation, VF)等,影响患者预后,探讨其有效的防治措施具有重要的临床意义。心肌缺血后处理(I-postC)是一种通过在再灌注之前或早期多次短暂阻断再灌注血流而实现的时间敏感性心脏保护措施。I-postC在生物体不同种属间具有广泛性、相似性和非特异性。动物实验表明,I-postC可减轻MIRI,减轻再灌注心律失常的发生和不良影响[1-3],但临床保护效果有待进一步评估,尤其对CPB下心脏瓣膜置换患者是否有减轻再灌注心律失常的作用及机制有待探讨。本研究观察了I-postC对CPB下心脏瓣膜置换术患者心电图的影响。
1 资料与方法
1.1病例选择深圳市孙逸仙心血管医院心血管外科择期CPB下行心脏瓣膜置换术患者40例,性别不限,年龄21~59岁,心功能HYHA分级Ⅱ或Ⅲ级,ASA分级Ⅱ或Ⅲ级,无心脏手术史和糖尿病病史,肝肾功能未见异常,左室射血分数≥40%,术前2周未使用抗凝及抗血小板药物,术前10 d内未使用营养心肌的药物,术前1周内未服用激素、钙离子拮抗剂、ATP敏感性钾通道开放剂、肾上腺能受体激动剂等可产生预处理效应的药物。本研究已获医院伦理委员会批准,并与患者签署知情同意书。
1.2麻醉与体外循环方法术前禁饮、禁食8 h。麻醉前30 min肌肉注射吗啡1.0~1.5 mg/kg和东莨菪碱0.006 mg/kg。入室后连接ntellivue MP60多功能检测仪(Philips公司,荷兰),心电图用Ⅱ导联+改良胸导联(CM)连接监测,开放外周静脉通路,局麻下行桡动脉穿刺置管,用于监测有创动脉压。依次静脉注射依托咪酯0.3 mg/kg、芬太尼4~6 μg/kg和罗库溴铵1 mg/kg进行麻醉诱导,气管内插管后行机械通气,吸入700 mL/L氧气,氧流量2 L/min,通气频率10~12次/min,潮气量8~10 mL/kg,吸呼比1∶2,维持PETCO235~45 mmHg(1 mmHg=0.133 kPa)。于右侧颈内静脉穿刺,置入三腔中心静脉导管,以供静脉输液及监测中心静脉压。麻醉维持:静脉输注芬太尼1~3 μg/(kg·min)(总量30~50 μg/kg)、异丙酚1.5~3.0 mg/(kg·h)、罗库溴铵0.05~0.20 mg/(kg·h)或顺阿曲库铵0.8~2.0 μg/(kg·h)。
CPB前后维持平均动脉压(MAP)70~90 mmHg,CPB期间维持MAP 50~80 mmHg,主动脉阻断前维持心率(HR)60~100次/min,主动脉开放后维持HR 70~100次/min。CPB前后维持中心静脉压(CVP)9~12 cmH2O(1 cmH2O=0.098 kPa),气道压峰≤20 cmH2O。术中静脉输注乳酸钠林格氏液、聚明胶肽、红细胞悬液和新鲜冰冻血浆,并酌情给予阿托品、多巴胺和去氧肾上腺素等血管活性药物,以维持血液动力学稳定。根据动脉血气分析结果及时纠正酸碱平衡和电解质紊乱,以维持内环境稳态平衡。CPB采用Stockert-Ⅲ型体外循环机(Maquet公司,德国),西京膜式氧合器。预充乳酸钠林格氏液、聚明胶肽和50 g/L NaHCO3。CPB前静脉注射肝素400 U/kg,使活化凝血时间(activated coagulation time, ACT)>480 s;采用4∶1高钾含血冷停搏液经主动脉根部顺行间断灌注以保护心肌。CPB期间维持鼻咽温度30~32 ℃。
1.3分组与I-postC方法采用随机数字表法,将所选病例40例分为2组(n=20):对照组(C组)和I-postC组(P组)。C组在升主动脉开放前不施行I-postC。P组参考文献[3-4]中采用的方法行I-postC,于升主动脉完全开放前5 min时,先松开主动脉钳夹30 s,再夹闭30 s,连续3个循环,然后完全松开主动脉钳夹。
1.4心电图观测方法分别于麻醉诱导后术前(T1)、心脏复跳时(T2)与主动脉开放10 min(T3)、30 min(T4)、45 min(T5)以及术终(T6)和术后12 h(T7)、24 h(T8)记录患者心电图的变化,记录心电图Ⅱ导联+改良胸导联(CM)ST-T抬高或下移幅度的总合值∑ST-T。再灌注室性心律失常(ventricular arrhythmias, VA)评分参照Curtis-Walker标准[5]:心律失常以VPB、VT、VF等室性心律失常为主;评分标准如下:无VA或有<5次的VPB,记0分;仅有≥5次的VPB,记1分;仅有一阵<60 s VT,记2分;有一阵≥60 s,或多阵累计<60 s的VT,记3分;多阵VT累计≥60 s记4分;出现VF,记5分;出现持续5 min以上的VF或在观察期间死亡,记6分。
1.5心肌标本采集于T5时取右心耳心肌组织约200 mg,其中100 mg于―80 ℃冷冻保存备用,进行Western blot检测;剩余100 mg以40 g/L多聚甲醛固定,常规石蜡切片,片厚4 μm,采用免疫组化法测定Bcl-2、Bax表达及细胞凋亡情况。
1.6Westernblot检测Akt、p-Akt、Cyto-C、Caspase-9的表达将心肌组织低温研磨后,加入蛋白裂解液及蛋白酶抑制剂,提取上清总蛋白。Bradford法蛋白定量,常规电泳转膜,加入一抗兔抗人Akt、P-Akt、细胞色素C(cytochrome C, Cyto-C)、Caspase-9多克隆抗体(稀释比1∶500,Santa Cruz公司,美国),内参为兔抗人β-actin多克隆抗体(稀释比1∶500,北京博奥森生物技术公司),4 ℃孵育过夜,反复洗膜,然后将膜与辣根过氧化物酶标记的山羊抗兔二抗(稀释比1∶5 000,北京博奥森生物技术公司)孵育,用化学发光检测试剂盒(Millipore公司,美国)将信号曝光于胶片上,采用Quantity-Onesoftware 4.6.2图像分析软件(Bio-Rad公司,美国)进行分析,以目的蛋白条带灰度值与β-actin条带灰度值的比值反映目的蛋白表达水平。
1.7SABC法测定Bcl-2和Bax的表达取石蜡切片,分别加入兔抗人Bcl-2和Bax多克隆抗体(稀释比1∶600,Santa Cruz公司,美国)和即用型山羊抗兔免疫组化SABC试剂盒(北京中杉金桥生物技术有限公司),β-actin作为内参,DAB显色。选择3张切片,每张切片随机选择5个视野,采用Image-Pro Plus 5.1.0.20图像分析软件(Media Cybernetics公司,美国)进行分析,取5个视野的平均值,并计算 Bcl-2和Bax表达的比值(Bcl-2/Bax),以目的蛋白条带平均吸光度值与β-actin平均吸光度值的比值反映Bcl-2和Bax的相对表达水平。
1.8TUNEL法检测心肌细胞凋亡情况取石蜡切片,按细胞凋亡检测试剂盒(Roche公司,瑞士)说明进行操作。采用Image-ProPlus5.1.0.20图像分析软件进行分析,每张切片随机采集10个不重叠的视野,取10个视野的平均值。计算每100个细胞中阳性细胞数百分比即凋亡指数(AI)。
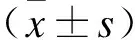
2 结 果
2.1两组患者一般情况的比较两组患者的一般资料各指标、CPB时间、主动脉阻断时间及手术时间比较差异无统计学意义(P>0.05,表1)。
表1两组患者一般资料及术中各指标的比较
Tab.1 Comparison of general data in the two groups

(n=20)
MVR为二尖瓣置换术,AVR为主动脉瓣置换术,MVR+AVR为二尖瓣置换术联合主动脉瓣置换术。
2.2两组患者心电图的变化
2.2.1两组患者再灌注心律失常评分的比较 与C组比较,P组T2~T8等时点再灌注心律失常(VPB、VT、VF)的发生率减少,室性心律失常评分减少,∑ST-T抬高或下移幅度减小(P<0.05,表2)。
表2两组患者心律失常发生率及室性心律失常评分的比较
Tab.2 Comparison of the incidence of arrhythmia and ventricular arrhythmia score in the two groups (n=20)

与C组比较,*P<0.001(P=0.000 399)。
2.2.2两组患者∑ST-T的变化 与T1时比较,两组T2与T3、T4、T5以及T6和T7、T8等时点T2-8∑ST-T抬高或下移幅度增大(P<0.05);与C组比较,P组T2~T8等时点∑ST-T抬高或下移幅度减小(P<0.05,表3)。
2.3两组患者Akt、p-Akt、Cyto-C与Caspase-9表达情况Western blot检测结果显示,两组间Akt表达无明显差异;与C组比较,P组心肌组织Cyto-C、Caspase-9表达下调,p-Akt表达上调(P<0.05,图1)。
2.4两组患者Bcl-2、Bax与Bcl-2/Bax比率表达与C组Bcl-2(3.1±1.2)、Bax(8.6±3.1)及Bcl-2/Bax比率(0.7±0.3)比较,P组心肌组织Bcl-2(6.2±3.4)表达上调,Bax(5.8±2.2)表达下调,Bcl-2/Bax比率(1.2±0.5)升高(P<0.05)。
2.5两组患者心肌细胞凋亡的TUNEL染色结果与C组染色TUNEL阳性心肌细胞比较,P组棕色染色明显减弱,凋亡指数AI(%)降低(P<0.05,图2)。
表3两组患者心电图Ⅱ+CM5导联∑ST-T的变化


与T1时比较,#P<0.05;与C组比较,*P<0.05。

图1Westernblot检测两组患者心肌组织凋亡相关蛋白的表达变化
Fig.1 Western blot results of myocardial tissue in the two groups of patients
A:Cyto-C与Caspase-9的Western blot检测结果;B:Akt与p-Akt 的Western blot检测结果;C:两组(n=20)Akt、p-Akt、Cyto-C及Caspase-9的表达水平比较。与C组比较,*P<0.05。
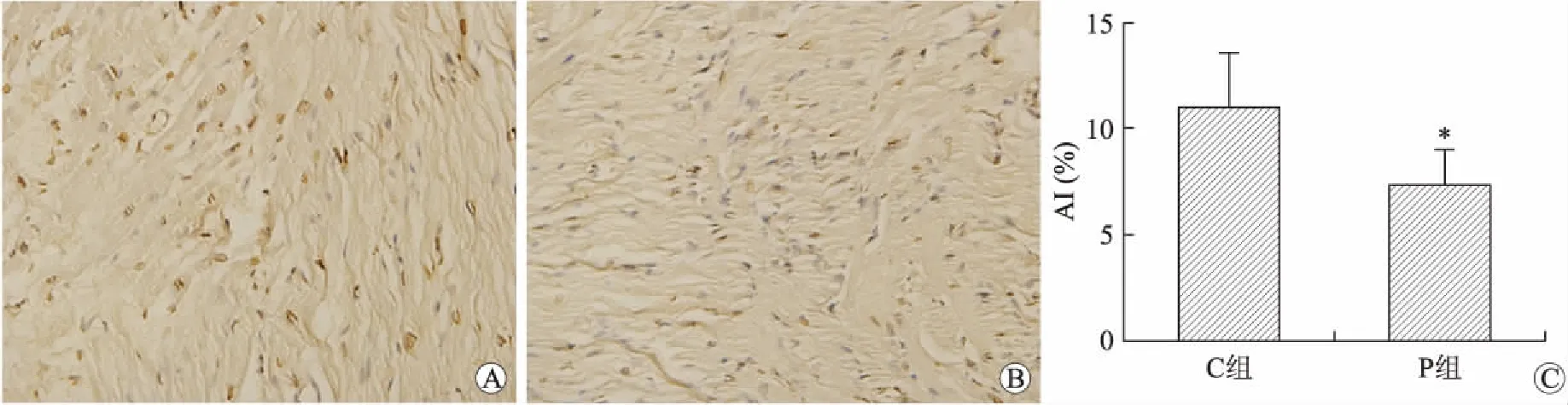
图2TUNEL染色检测两组心肌细胞凋亡情况及比较
Fig.2 TUNEL staining results of cardiomyocyte apoptosis in the two groups
A、B:C组、P组患者心肌细胞凋亡的TUNEL染色结果(×400);C:两组(n=20)凋亡指数(AI)的比较。与C组比较,*P<0.05。
3 讨 论
研究表明,在凋亡形成过程中,心肌细胞兴奋性可能增加,甚至形成自动节律点,凋亡细胞形成散在的细胞群,当正常的激动到达该处时发生异向性传导[6];凋亡可进一步引起膜通道和离子泵的功能改变,出现心肌细胞膜Na+-K+-ATP酶活性降低,心肌细胞内环境紊乱,尤其是细胞内外K+空间分布的不均匀性;这些都增加了心肌电不稳定性,导致心肌细胞应激性及自律性增强,使折返易于形成,诱发心律失常[7]。严重的再灌注心律失常和显著的∑ST-T改变是MIRI的显著表现,∑ST-T移位的电生理基础是正常组织和心肌缺血区之间出现了损伤电位差。这种电位差愈大,TQ-ST段移位越明显,因而ST-T段抬高或者下移越明显。
CPB下心内直视手术中缺血再灌注及中性粒细胞激活可释放活性氧自由基(ROS),能够降低线粒体膜电位(ΔΨm),使线粒体转换孔道(mPTP)开放,使得线粒体凋亡诱导通道(MACs)打开,导致凋亡诱导因子Cyto-C、凋亡蛋白活化因子(APAF1)、凋亡诱导因子(AIF)从线粒体进入细胞质,与procaspase-9形成凋亡复合体,激活Caspase-9,启动线粒体凋亡级联反应,最终导致心肌细胞凋亡[8-10]。当mPTP或MACs打开时,可使ΔΨm降低或消失,呼吸链和氧化磷酸化解耦联,ATP合成停止,细胞膜ATP依赖性钾通道[the plasma membrane Adenosine triphosphate (ATP)-sensitive potassium,sarcKATP]持续激活,钾离子外流,心肌细胞静息膜电位负值变小,心室纤颤阈值降低,动作电位时程(APD)缩短,有效不应期(ERP)缩短,导致折返性心律失常易于形成,增加室早、室速、室颤等快速性再灌注心律失常发生的可能性[8,11-12]。心肌细胞凋亡可形成心肌损伤,在正常心肌组织和损伤区域之间出现电位差,其电位差愈大,TQ-ST段移位越明显,ST-T改变(上抬或下移)幅度愈大。
磷脂酰肌醇3-激酶(PI3K)能够通过激活蛋白激酶B(Akt)抑制促凋亡蛋白Bax构象改变,活化的Akt(p-Akt)可磷酸化糖原合成酶激酶3,通过抑制其激活,抑制线粒体通透性转换孔(mPTP)开放,增加ΔΨm,抑制线粒体凋亡启动[13-14];活化的Akt(p-Akt)可促进Bcl-2表达,而Bcl-2存在于细胞线粒体外膜,可阻断MACs开放,抑制Cyto-C、APAF1、AIF等从线粒体向细胞质释放,还可直接抑制caspase的激活[15-16];Bcl-2与Bax的比值决定细胞凋亡程度[17]。
本研究结果表明,CPB下心内直视手术中缺血再灌注可通过线粒体途径导致心肌细胞凋亡,造成心肌损伤,导致T2~T8时点VPB、VT、VF等快速性再灌注心律失常出现(尤其C组的T2~T5时点最明显);与T1时点比较,由于心肌细胞凋亡导致的MIRI,使得在T2~T8时点的正常心肌与损伤区域之间出现电位差,表现为不同程度的ST-T改变(上抬或下移),以C组最显著。
本研究参考文献[3-4]对P组患者进行I-postC,即于升主动脉完全开放前5 min时,先松开主动脉钳夹30 s,再夹闭30 s,连续3个循环,然后完全松开主动脉钳夹。而本研究结果亦表明,与对照组比较,P组Cyto-C、Caspase-9、Bax明显下调,p-Akt、Bcl-2明显上调,凋亡指数AI降低;T2~T8时点VPB、VT、VF等快速性再灌注心律失常发生率明显降低,T2~T8时点再灌注心律失常评分及∑ST-T 改变幅度明显减小,均说明P组缺血/再灌注损伤的程度(临床表现为再灌注心律失常)明显低于C组,也说明所建立的I-postC临床模型成功建立。
本研究结果提示,I-postC(I-postC)可抑制心肌线粒体凋亡,减轻CPB下心脏瓣膜置换术患者再灌注心律失常。有研究表明,I-postC可通过PI3K/Akt通路抑制心肌细胞凋亡,稳定ΔΨm,抑制细胞膜ATP依赖性钾通道(sarcKATP)激活,使心肌细胞静息膜电位负值增大,使心室纤颤阈值升高,动作电位时程(APD)延长,并降低钙超载,减少形成折返性心律失常的可能性[18-20];保护冠状动脉内皮细胞、改善细胞代谢与能量代谢,使心肌细胞膜Na+-K+-ATP酶活性增高[21-22]。推测,本研究中I-postC也可能通过上述机制产生心肌保护作用,降低再灌注心律失常的严重性,但其具体机制尚需进一步研究。

