金露梅提取物对α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶的抑制作用
李美华,王渭清,曾 阳*,郭凤霞,严培瑛,李锦萍
(1青海师范大学生命科学学院,西宁 810008;2青海省产品质量监督检测所,西宁 810000;3浙江大学城市学院,杭州 310015)
金露梅(PotentillafruticosaL.)属蔷薇科(Rosaceae)委陵菜属(Potentilla)植物,主要分布在青藏高原,是高寒地区一种典型的落叶灌木,嫩叶可代茶饮,花和叶可药用[1]。金露梅属于民族常用药藏药的一种。据藏药典籍《晶珠本草》记载,其具有健脾、消暑、调经的功效,现代研究主要对其化学成分进行测定,发现金露梅中含有黄酮类、鞣质和醌类化合物。
近年来,随着人们生活水平的提高,食用过多碳水化合物和高脂高糖类食物致使餐后血糖升高,不仅会导致肥胖,还会引发2型糖尿病[2]。人们现今已研发出各类抗2型糖尿病的药物,例如,从微生物和植物中获得用于降糖及治疗肥胖的α-淀粉酶抑制剂类药物,合成了α-葡萄糖苷酶抑制剂和醛糖还原酶抑制剂类降糖药物(阿卡波糖、依帕司他)等[3-6]。本课题组前期研究同属植物小叶金露梅时发现,小叶金露梅对α-葡萄糖苷酶和醛糖还原酶有抑制作用,并具有抗2型糖尿病的作用[7]。本文主要研究了金露梅不同提取物对α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶3种酶的体外抑制作用以及金露梅提取物对餐后血糖的影响,为金露梅资源的开发利用提供理论参考。
1 材 料
1.1 药材与试剂
金露梅枝叶,采集于青海省大通达板山(由青海师范大学生命科学学院陈振宁教授鉴定为Potentillafruticosa)。α-淀粉酶、α-葡萄糖苷酶、醛糖还原酶、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG)(美国Sigma公司);3,5-二硝基水杨酸(国药集团化学试剂公司);阿卡波糖(拜耳医药保健有限公司);依帕司他(扬子江药业集团);葡萄糖测定试剂盒(上海荣盛生物药业有限公司),其他试剂均为市售分析纯。
1.2 仪 器
EYELA旋转蒸发仪(日本东京理化器械株式会社);Alpha 1-4 LD plus冷冻干燥机(德国Christ);Thermo-Shaker孵育器(托赫机电科技上海有限公司);XMARK全自动酶标仪(上海伯乐生命医学产品有限公司);紫外可见分光光度计(上海美普达仪器有限公司)。
1.3 动 物
昆明种小鼠60只,雌雄各半,6~8周龄、体重(20±2) g,由西安交通大学医学实验动物中心提供,合格证号:SCXK(陕)2012-003。实验前适应性饲养1周,自由饮食、摄水。
2 方 法
2.1 提 取
粉碎金露梅干燥枝叶1 kg,95%甲醇回流1 h,重复3次,抽滤、合并滤液,真空浓缩[8-9]。浓缩后于等量水中分散,然后以石油醚萃取,真空干燥萃取液得石油醚萃取部位;剩余水层用乙酸乙酯萃取,萃取液真空干燥得乙酸乙酯萃取部位;剩余水层真空干燥得水层部位。另取金露梅粗粉,10倍蒸馏水浸提3次,得水浸膏,冷冻干燥得水提物。其中金露梅95%甲醇提取石油醚萃取部位、乙酸乙酯萃取部位和水层部位以及金露梅水提物的得率分别为2.41%,5.02%,4.13%和16.33%,于4 ℃冰箱保存备用。
2.2 金露梅提取物对α-淀粉酶的抑制活性测定
2.2.1α-淀粉酶标准曲线的测定 在无抑制剂的条件下,观察α-淀粉酶活力其随酶量的变化关系。反应体系设置为400 μL:在0.5 mL EP管中依次加入pH为6.0的0.05 mol/L磷酸缓冲液300 μL,淀粉溶液50 μL,不同浓度α-淀粉酶(0,0.08,0.15,0.25,0.4,0.5 mg/mL)各50 μL,摇匀后37 ℃恒温水浴15 min。依次加入3,5-二硝基水杨酸250 μL,混匀、70 ℃水浴15 min,将反应液置于540 nm处测定吸收度[10]。
2.2.2α-淀粉酶的抑制活性测定 按照“2.2.1”项方法,取pH为6.0的0.05 mol/L磷酸缓冲液250 μL,依次加入不同浓度的各提取物的待测样品(0.039,0.078,0.156,0.313,0.625,1.25,2.5 mg/mL)各50 μL、淀粉溶液50 μL、α-淀粉酶50 μL,摇匀后37 ℃混匀并恒温水浴15 min。依次加入3,5-二硝基水杨酸250 μL ,混匀、70 ℃水浴15 min,将反应液置于540 nm波长处测定吸收度。
抑制剂活力单位定义:pH 6.0、37 ℃条件下每降低1个单位酶活力所需的抑制剂量。抑制率=(抑制剂活力/酶活力)×100%。各提取物对α-淀粉酶活性抑制率按公式(1)进行计算。
(1)
式中,Α1:原有的酶活力;Α2:加入抑制剂后的酶活力;Α3:样品背景;Α4:无3,5-二硝基水杨酸试剂背景;A5:加入3,5-二硝基水杨酸试剂后背景。
所得结果输入SPSS 22.0进行半数抑制浓度(IC50)的计算。
2.3 金露梅提取物对α-葡萄糖苷酶的抑制活性测定
2.3.1α-葡萄糖苷酶标准曲线的测定 在无抑制剂的条件下,用全自动酶标仪和不可拆96孔板测定酶的活性。反应体系为200 μL:在pH 6.8的磷酸缓冲液150 μL和8.92 mmol/L PNPG 25 μL中分别加入不同浓度的α-葡萄糖苷酶(0,0.02,0.04,0.06,0.08,0.1,0.12 U/mL) 25 μL。每个浓度设置3个平行,将反应体系置于37 ℃恒温孵育器内20 min,迅速在400 nm波长处测定吸收度[11],绘制标准曲线。
2.3.2α-葡萄糖苷酶抑制活性的测定 按照“2.3.1”项方法,测定苷酶对酶的抑制活性。反应体系为200 μL:在磷酸缓冲液(pH 6.8) 125 μL和8.92×10-3mol/L PNPG 25 μL中分别加入不同浓度的各提取物(0.039,0.078,0.156,0.313,0.625,1.25,2.5,5 mg/mL)及不同浓度梯度的阳性药物阿卡波糖(0.195,0.391,0.781,1.563,3.13,6.25,12.5,25 mg/mL)各25 μL和0.05 U/mLα-葡萄糖苷酶25 μL。
为了消除测定结果中样品和底物的影响,需测定样品和底物的吸收度,并以磷酸缓冲液代替样品和底物进行校正:如公式(2)所示。
(2)
式中,Α1:原有的酶活力;Α2:加入抑制剂后的酶活力;Α3:PNPG背景;Α4:样品背景。
所得结果输入SPSS 22.0计算IC50。
2.4 金露梅提取物醛糖还原酶的抑制活性测定
用全自动酶标仪和不可拆96孔板测定酶的活性。反应体系设为200 μL:依次加入pH 6.2的0.2 mol/L磷酸缓冲液125 μL,不同浓度各提取物(0.039,0.078,0.156,0.313,0.625,1.25,2.5 mg/mL)及相同浓度梯度的阳性药物依帕司他各25 μL,1.5 mmol/L NADPH 20 μL,5×10-6U/L醛糖还原酶10 μL,加入100 mmol/L DL-甘油醛20 μL启动反应,以磷酸缓冲液作空白对照,25 ℃恒温孵育器温浴3 min后连续测定340 nm处5 min内的吸收度,并间接测定各样品对醛糖还原酶的抑制活性。酶活力等于反应体系每分钟吸收度与用磷酸缓冲液代替底物后每分钟吸收度的差与100的乘积。
所得结果输入SPSS 22.0计算IC50。
2.5 糖耐量测定
取正常血糖小鼠60只,按体重随机分成6组,每组10只,雌雄各半。适应性饲养1周,禁食不禁水12 h后,尾静脉采血测量小鼠空腹血糖并作记录。分别用高、低剂量金露梅水提物(1.0、0.5 g/kg),按照生药量计分别为6.124、3.062 g/kg;高、低剂量金露梅乙酸乙酯部位(1.0、0.5 g/kg),按照生药量计分别为19.92、9.96 g/kg;生理盐水(按体重)、阿卡波糖(0.12 g/kg)给小鼠灌胃,每天1次,连续7 d,第7 d灌胃后禁食12 h,第8 d灌胃空腹测血糖后,用2.0 g/kg的淀粉给小鼠负荷剂量,在灌胃后30、60、90、120 min测量小鼠血糖并记录。所得结果用SPSS 22.0软件进行显著性差异统计。
3 结 果
3.1 α-淀粉酶的测定结果
3.1.1α-淀粉酶标准曲线 求得α-淀粉酶回归方程为Y=3.109X+0.1721,R2=0.993 1,吸收度在α-淀粉酶质量浓度0.08~0.5 mg/mL范围内,线性关系良好。
3.1.2 各提取物不同浓度下对α-淀粉酶的影响 如表1所示,金露梅水提物、石油醚部位和乙酸乙酯部位的IC50分别为0.432、1.193、0.507 mg/mL。在金露梅水提物、石油醚部位和乙酸乙酯部位质量浓度分别为0.039,0.078,0.156,0.313,0.625,1.25,2.5 mg/mL时,各个提取物对α-淀粉酶的抑制率随浓度的升高而升高,在0.039~2.5 mg/mL范围内,对α-淀粉酶的抑制作用具有较好的量效关系,金露梅水层部位无抑制活性。表明,金露梅水提物和乙酸乙酯部位对α-淀粉酶具有较好的抑制作用。


c/(mg/mL)Inhibition/%WEMEPMEE2.591.15±2.2861.46±2.6782.34±2.351.2586.32±2.3252.52±2.5176.15±2.140.62565.41±2.1240.12±1.9658.46±1.770.31334.33±1.9524.39±2.0137.53±1.860.15617.52±1.6713.22±1.3419.06±1.820.0787.63±0.758.76±0.6911.17±0.810.0393.22±0.422.13±0.214.02±0.45
WE:Water extract;MEP:Methanol extraction of petroleum ether;MEE:Methanol extraction of ethyl acetate
3.2 α-葡萄糖苷酶的测定结果
3.2.1α-葡萄糖苷酶的标准曲线 求得α-葡萄糖苷酶曲线方程Y=0.98X+0.016,R2=0.999 4。吸收度随α-葡萄糖苷酶量的变化而变化,α-葡萄糖苷酶质量浓度在0.02~0.12 U/mL时与吸收度呈现良好的线性关系。
3.2.2 各提取物不同浓度下对α-葡萄糖苷酶的影响 如表2、3所示,金露梅水提物、石油醚部位、乙酸乙酯部位、阿卡波糖的IC50分别为0.164、0.768、0.466、2.938 mg/mL。金露梅水提物及石油醚部位、乙酸乙酯部位质量浓度分别为0.039,0.078,0.156,0.313,0.625,1.25,2.5,5 mg/mL时,各个提取物对α-葡萄糖苷酶的抑制率随浓度的升高依次升高,在质量浓度0.039~5 mg/mL范围内,对α-葡萄糖苷酶的抑制作用,具有较好的量效关系,且金露梅水提物和乙酸乙酯部位抑制活性显著高于阿卡波糖,水层部位无抑制活性。表明:金露梅水提物和乙酸乙酯部位对α-葡萄糖苷酶有很好的抑制作用。


c/(mg/mL)Inhibition/%WEMEPMEE599.37±2.2476.89±2.2992.37±2.642.591.75±2.8772.11±2.6889.5±2.781.2588.45±2.5462.14±2.6679.71±2.780.62579.11±2.4651.29±1.9762.52±2.610.31370.08±2.9842.2±2.8539.93±2.450.15649.06±2.3425.37±1.9916.52±2.220.07831.03±1.562.11±1.0110.59±1.980.03917.32±1.200.17±0.051.67±0.69


c/(mg/mL)Inhibition/%2579.45±1.9612.573.34±2.546.2565.22±2.023.12556.31±2.161.562 541.76±1.650.78129.55±1.280.390 617.36±1.540.195 34.55±1.23
3.3 各提取物不同浓度下对醛糖还原酶的影响
如表4所示,金露梅水提物、石油醚部位、乙酸乙酯部位及依帕司他的IC50分别为0.742、2.158、1.098、0.773 mg/mL。金露梅水提物及石油醚部位、乙酸乙酯部位质量浓度分别为0.039,0.078,0.156,0.313,0.625,1.25,2.5 mg/mL时,各提取物对醛糖还原酶的抑制率随质量浓度的升高依次升高,在质量浓度0.039~2.5 mg/mL范围内,对醛糖还原酶的抑制作用呈现较好的量效关系,金露梅水提物抑制率高于依帕司他,水层部位无抑制活性。说明金露梅水提物对醛糖还原酶有很好的抑制作用。

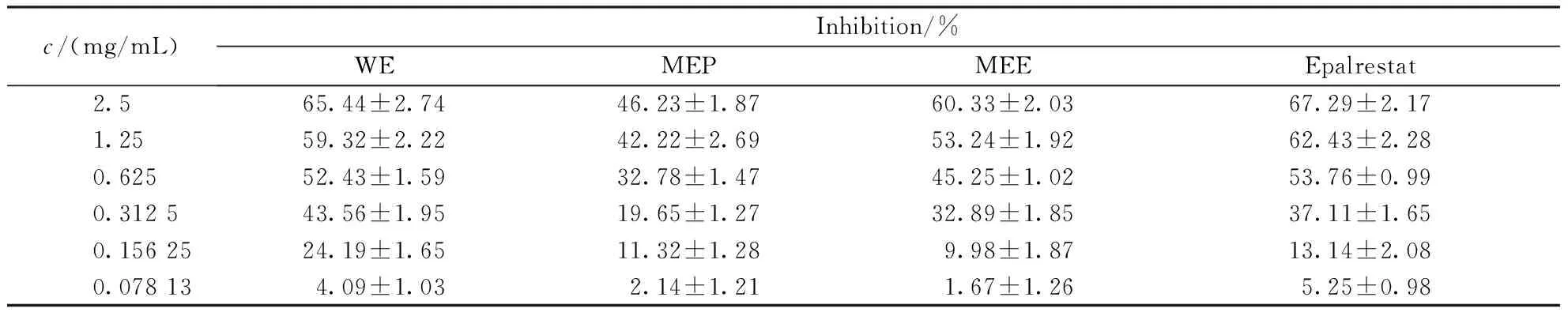
c/(mg/mL)Inhibition/%WEMEPMEEEpalrestat2.565.44±2.7446.23±1.8760.33±2.0367.29±2.171.2559.32±2.2242.22±2.6953.24±1.9262.43±2.280.62552.43±1.5932.78±1.4745.25±1.0253.76±0.990.312 543.56±1.9519.65±1.2732.89±1.8537.11±1.650.156 2524.19±1.6511.32±1.289.98±1.8713.14±2.080.078 134.09±1.032.14±1.211.67±1.265.25±0.98
3.4 金露梅提取物对小鼠餐后血糖的影响
如表5所示,各给药组与空白组对比,金露梅水提物和乙酸乙酯部位的高、低剂量组均能降低小鼠餐后血糖。金露梅水提物和乙酸乙酯部位高剂量组在给药30、90、120 min后,能降低用淀粉负荷后小鼠的血糖水平(P<0.05),差异显著;金露梅水提物和乙酸乙酯部位高剂量组在给药60 min后,能明显降低用淀粉负荷后小鼠的血糖水平(P<0.01),差异极显著;金露梅水提物和乙酸乙酯部位低剂量组在给药30、60 min后,能降低用淀粉负荷后小鼠的血糖水平(P<0.05)。
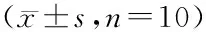
GroupDose/(g/kg)Blood glucose/(mmol/L)Overnight fasting30 min60 min90 min120 minControl-5.77±0.778.17±1.099.13±0.838.18±0.717.72±1.32Acarbose0.125.07±1.286.28±1.21*7.08±1.47*6.58±1.355.95±1.18*WE1.05.35±0.846.25±0.99*6.52±1.01**6.45±1.34*5.58±1.14*0.54.88±1.356.57±0.67*7.15±1.26*7.25±1.456.13±1.05MEE1.05.48±0.696.28±0.93*6.93±0.86**6.48±0.92*5.38±0.71*0.55.18±0.936.65±1.06*7.22±1.23*7.28±0.896.33±0.78
*P<0.05;**P<0.01vscontrol group
4 讨 论
α-淀粉酶和α-葡萄糖苷酶是催化水解碳水化合物过程中重要的酶。醛糖还原酶能将葡萄糖催化还原为山梨醇,还可催化还原脂质过氧化反应产生醛及其衍生物,继而在糖代谢多元醇通路中起限速作用。因此,这几类酶的抑制剂可以有效对抗2型糖尿病及其并发症[11-14]。
本研究通过金露梅不同提取物对α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶的抑制作用进行研究,发现金露梅水提物对α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶的抑制作用大于乙酸乙酯萃取部位,石油醚萃取部位对α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶的抑制作用最弱。
体外筛选结果显示,金露梅水提物、95%甲醇提取乙酸乙酯萃取部位对α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶的活性有较强的抑制作用,水层部位无抑制活性。结果表明,金露梅对α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶均有不同程度的抑制作用。小鼠糖耐量实验结果表明,金露梅提取物具有一定的降低餐后血糖的作用。
目前为止,被发现有降血糖功能的委陵菜属植物包括翻白草(PotentilladiscolorBunge.)、朝天委陵菜(PotentillasupinaLinn.)、蛇含委陵菜(PotentillakleinianaWight et Arn.)[7]等,但对金露梅的降血糖作用研究甚少。本研究通过体外筛选金露梅的α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶的抑制活性作用,体内对其进行降血糖作用的研究,为金露梅植物的降血糖功能提供依据,同时也为金露梅后续开发提供理论基础。

