硝苯地平骨架型缓释微丸在大鼠体内药代动力学及其与CYP3A4代谢酶活性的关系
张瑞卿,杨文倩,余裕炳,涂家生,孙益新*
(1南京医科大学附属儿童医院,南京 210000;2中国药科大学药学院药剂系,南京 210009)
高血压是当今世界最常见的心血管疾病之一,流行病学研究显示,目前全球有高血压患者6亿人,患病率约为10%。硝苯地平为第一代二氢吡啶类钙拮抗剂,临床上多用于高血压和心绞痛等疾病的预防和治疗[1]。高血压患者一般需要长期服药来维持其血压的稳定,因此高血压类药物适合于制备缓控释制剂,延长体内作用的时间,减少每日用药次数,减少峰谷现象,降低不良反应。硝苯地平半衰期t1/2呈双相,t1/2α为2.5~3 h,t1/2β为5 h,且在大鼠各肠段均有良好吸收[2-3],适于设计成缓控释制剂。
硝苯地平口服后在胃肠道内几乎完全吸收,但是有很强的首过作用,Foster等[2]研究表明口服硝苯地平生物利用度只有0.45。硝苯地平在体内被CYP3A4酶氧化成吡啶类似物,进一步形成酸性代谢物从尿液排出[4],而多态性研究表明,CYP3A4活性具有广泛的个体差异,并显示出明显的种族和疾病分布特征。硝苯地平口服后患者间的血药浓度差异比较大,提示可能是由于患者间代谢硝苯地平的肝药酶的水平差异所导致。
细胞色素P450是人体内代谢药物的主要酶系,其中CYP3A4参与人体50%以上的药物代谢[5],其活性改变可引起药物的动力学产生个体差异[6-7]。硝苯地平是CYP3A4的底物,个体间酶活性的差异可能会导致硝苯地平药代动力学的差异,可以通过测定CYP3A4活性寻找硝苯地平个体间药代动力学差异的原因。CYP3A4活性常用的测定方法有红霉素呼吸试验[8]、咪唑安定法[9]和氢化可的松法[10]。本实验采用氢化可的松为探针,HPLC梯度洗脱法测定人24 h尿液中氢化可的松(FC)及其代谢产物6β-羟基氢化可的松(6β-OHF)的含量,计算其比值6β-OHF/FC来衡量CYP3A4的表型活性,为临床用药提供参考依据。
本研究以大鼠为试验对象,以市售硝苯地平片为参比制剂,研究其和自制硝苯地平骨架缓释微丸的体内药代动力学,采用Kinetica程序计算相关参数,建立体内外相关性,为自制硝苯地平缓释微丸的质量评价提供依据。并研究CYP3A4活性与硝苯地平缓释微丸药代动力学性质的关系,为个体化用药研究提供一种新的思路。
1 材 料
1.1 仪 器
Ultimate 3000系列高效液相色谱仪(美国戴安Dionex公司);Agela C18色谱柱(4.6 mm×250 mm,5 μm;4.6 mm×150 mm,5 μm,美国Agela公司);Waters高效液相色谱仪(美国Waters公司);HW-2000色谱数据工作站(上海千普软件有限公司);ZH-B6 大鼠代谢笼(淮北正华仪器设备有限公司);TGL-16B型高速离心机(上海安亭科学仪器厂)。
1.2 试 药
FC对照品、地塞米松对照品、尼群地平对照品(纯度>99%,中国药品生物制品检定所);6β-OHF对照品(纯度≥98%,美国Sigma-aldrich公司);FC注射液(规格5 mL∶25 mg,天津金耀氨基酸有限公司);硝苯地平缓释微丸(自制[11],批号20100201);硝苯地平片(规格10 mg,常州康普药业有限公司);大鼠灌胃小胶囊(规格20 μL,潮州强基制药有限公司);甲醇(色谱纯,山东禹王实业有限公司);乙腈(色谱纯,美国Tedia公司);其他试剂均为分析纯,水为重蒸水。
1.3 动 物
SD大鼠,体重(200±11) g,雄性,南京青龙山养殖场提供,合格证号SCXK(浙)2014-0001
2 方 法
2.1 大鼠体内CYP3A4代谢酶活性的测定
2.1.1 探针给药及尿液收集方法 取SD大鼠10只,给药前禁食12 h,按照9 mg/kg剂量尾静脉注射给予氢化可的松注射液,然后将大鼠置于代谢笼中24 h,收集24 h尿液,于-20 ℃冰箱中冷藏保存待测。
2.1.2 色谱条件 色谱柱:Agela C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈(A相)和7.56 mmol/L硫酸铵水溶液(B相),梯度洗脱[12](0~6.5 min,A:10%,B:90%;6.5~15 min,A:35%,B:65%,线性变化;15~24 min,A:35%,B:65%;24~28 min,A:10%,B:90%,线性变化;28~32 min,A:10%,B:90%);柱温40 ℃;流速1.0 mL/min;UV检测波长:240 nm;内标:地塞米松(DM)。
2.1.3 尿样处理方法 取4 000 r/min离心后的大鼠尿样2 mL加入试管中,随后加入100 μg/mL内标溶液20 μL和1 mol/L NaOH溶液100 μL,振荡混合30 s后加入乙酸乙酯-乙醚(4∶1)混合提取剂5 mL,室温下振荡提取5 min,4 000 r/min离心10 min,去水相,有机相中加入含有饱和Na2SO4的1 mol/L NaOH溶液2 mL洗涤,振荡后4 000 r/min离心10 min,去水相,有机相中加入含有饱和Na2SO4的1%醋酸溶液2 mL洗涤后,取有机相3 mL在50 ℃水浴中氮气吹干,残渣用甲醇200 μL溶解,振荡混匀,10 000 r/min离心3 min后,取上清液20 μL进样。
2.1.4 标准曲线 精密称取FC和6β-OHF对照品,用甲醇溶解并稀释成储备液(100 μg/mL)。配制FC和6β-OHF质量浓度分别为 0.01,0.02,0.05,0.1,0.15,0.3,0.5,1,2 μg/mL的对照品溶液2 mL,按“2.1.3”项尿样处理方法提取并测定。
2.1.5 精密度 分别配制高、中、低质量浓度的FC和6β-OHF对照品水溶液(0.02、0.1、0.5 μg/mL),按“2.1.3”项下提取,进行日内精密度和3 d日间精密度的测定。
2.1.6 回收率 在含有已知浓度的FC和6β-OHF(0.02、0.1、0.5 μg/mL)水溶液2 mL中加入100 μg/mL内标溶液20 μL,每个浓度平行制备3份,按“2.1.3”项下提取测定,方法回收率为所得浓度和投入量之比,提取回收率为待测物提取前后峰面积比。
2.2 大鼠体内药代动力学研究
2.2.1 给药方案 取“2.1.1”中已测得CYP3A4活性4 d后的SD大鼠10只,随机分为2组,分别经口给予受试制剂与参比制剂。给药剂量为2.7 mg/kg,服药前禁食12 h,空腹给药,用特制小胶囊灌胃,同时灌服生理盐水。
2.2.2 样品采集 受试制剂组:给药后于0.5、1、2、3、4、6、8、10、12、16、24和36 h眼静脉取血0.5 mL;参比制剂组:给药后于0.33、0.66、1、1.5、2、2.5、3、4、6、8、12和16 h眼静脉取血0.5 mL;血样置于涂有肝素的塑料离心管中,10 000 r/min离心3 min,分离血浆样品于-20 ℃冰箱中保存待测。
2.2.3 色谱条件 色谱柱:Agela C18柱(4.6 mm×150 mm,5 μm);流动相:甲醇-水(60∶40);检测波长:350 nm(0.3 AUFS);流速:1 mL/min;柱温:35 ℃。内标物:尼群地平(NT)。
2.2.4 血浆样品的处理和测定[13-15]取大鼠空白血浆150 μL于具塞玻璃离心管中,加入5 μg/mL尼群地平(内标)15 μL及氨水20 μL,涡旋混合30 s,加入乙醚3 mL,涡旋混合3 min,4 000 r/min离心5 min,取上层有机相2.6 mL于离心管中,40 ℃水浴下氮气吹干。残渣用流动相150 μL涡旋溶解,高速离心5 min,取上清液50 μL进样。
2.2.5 专属性 分别取大鼠空白血浆、加入一定浓度的硝苯地平和内标溶液的空白血浆以及给药4 h后收集的血浆样品150 μL,按“2.2.4”项下操作,记录色谱图。
2.2.6 检测限和定量限 制备硝苯地平质量浓度分别为2、4、10 ng/mL的溶液,50 μL进样,以峰高接近基线噪音3倍时的浓度为检测限;以峰高接近基线噪音10倍时的浓度为定量限。
2.2.7 标准曲线 精密称取干燥至恒重的硝苯地平对照品10 mg,用甲醇溶解并稀释储备液(100 μg/mL)。取大鼠空白血浆135 μL,精密加入不同浓度的硝苯地平储备液 15 μL,配制硝苯地平质量浓度为0.02,0.05,0.1,0.15,0.3,0.5,0.75,1 μg/mL的样品,按“2.2.4”项下处理并测定。
2.2.8 回收率及精密度 按“2.2.7”项下配制硝苯地平质量浓度为20,100,500 ng/mL的血浆样品。按“2.2.4”项下处理测定,方法回收率为所得浓度和投入量之比,提取回收率为待测物提取前后峰面积比。另取上述溶液,同法操作,进行日内精密度和3 d日间精密度的测定。
3 结 果
3.1 大鼠体内CYP3A4代谢酶活性的测定
3.1.1 色谱行为 在本实验建立的色谱分离条件下,FC、6β-OHF和内标地塞米松的保留时间分别为13.75,20.50和24.65 min(图1),尿样中的杂质不影响FC和6β-OHF的分离。
3.1.2 标准曲线 以峰面积比值对浓度进行线性回归,得到标准曲线方程FC:Y=0.557 1X+0.001 8,r=0.999 4;6β-OHF:Y=1.231 5X+0.012 3,r=0.999 9。结果表明FC在0.01~2 μg/mL,6β-OHF在0.01~1 μg/mL质量浓度范围内峰面积比与质量浓度呈良好的线性关系。
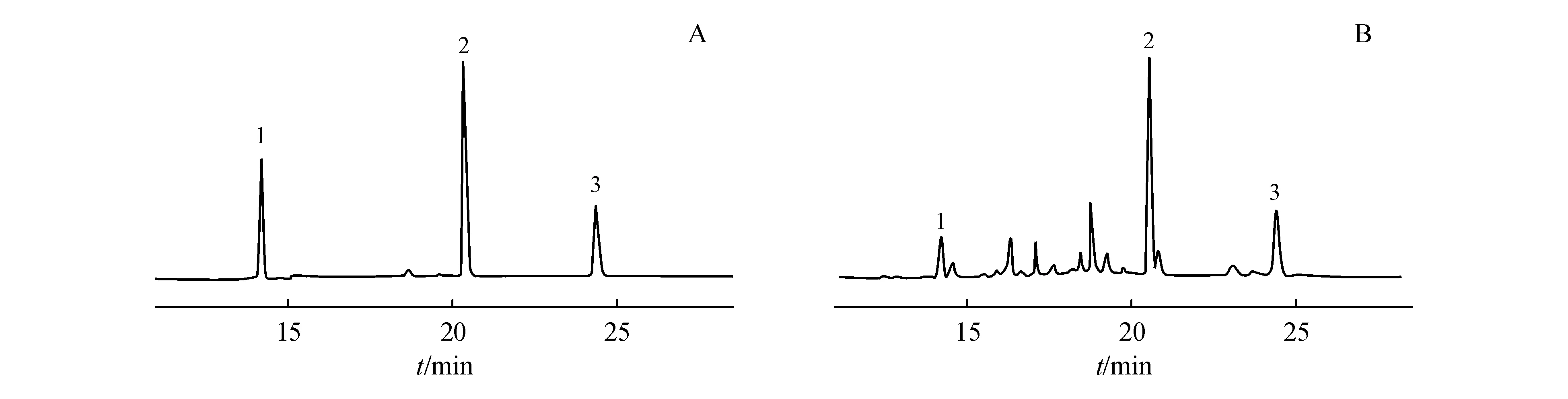
Figure1 HPLC chromatograms of standard solution (A) and urine sample (B)
1:6β-Hydroxycortisol;2:Hydrocortisone;3:Internal standard (dexamethasone)
3.1.3 精密度 6β-OHF低、中、高浓度的日内精密度RSD(%)分别为3.94、2.09、2.06,日间精密度RSD(%)分别为4.88、2.71、1.98。FC低、中、高浓度的日内精密度RSD(%)分别为2.75、3.02、2.23,日间精密度RSD(%)分别为4.29、3.01、1.82。日内日间精密度均小于10%。
3.1.4 方法回收率 6β-OHF低、中、高浓度的方法回收率(%)分别为101.93、97.90、98.53,RSD(%)分别为4.59、4.91、3.78;FC低、中、高浓度的方法回收率(%)分别为103.80、97.82、100.68,RSD(%)分别为3.39、4.50、4.64。
3.1.5 提取回收率 6β-OHF低、中、高浓度的提取回收率(%)分别为84.26、84.43、90.34,RSD(%)分别为4.54、5.38、2.60;FC低、中、高浓度的提取回收率(%)分别为89.98、85.74、86.77,RSD(%)分别为6.23、4.71、2.61。地塞米松的提取回收率为84.26%,RSD为4.54%。6β-OHF、FC和地塞米松的平均提取回收率都在75%以上,提取回收率稳定。
3.1.6 大鼠CYP3A4活性测定结果 测定FC和6β-OHF的含量,CYP3A4活性表示为[6β-OHF]/[FC],在本研究中,CYP3A4活性只是一个比值,并无单位。FC平均浓度为(8.477±3.504) μg/mL,6β-OHF平均浓度为(2.321±1.693) μg/mL,[6β-OHF]/[FC]均值为0.271±0.129。结果表明,FC和6β-OHF的浓度变化范围较大,但其比值变化范围相对较小,可作为CYP3A4活性的参考。
3.2 大鼠体内药代动力学
3.2.1 专属性 在本实验建立的色谱分离条件下,硝苯地平与内标尼群地平均有较大的色谱峰,峰形良好,且理论塔板数都大于2 000,两者的保留时间分别为6.252和12.214 min(图2),血浆中杂质对测定无干扰。
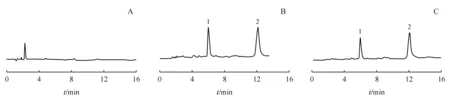
Figure2 Chromatograms of blank plasma(A),plasma sample with nifedipine and internal standard (B),and rat plasma 4 hours after oral administration of nifedipine sustained release pellets (2.7 mg/kg)(C).1:Nifedipine;2:Internal standard (nitrendipine)
3.2.2 标准曲线、检测限与定量限 以血浆中硝苯地平浓度与硝苯地平对尼群地平的峰面积之比NF/NT进行加权回归,得到回归方程NF/NT=0.001 7c+0.003 3,r=0.999 3。在20~1 000 ng/mL质量浓度范围内线性关系良好。LOD以S/N=3计为4 ng/mL,LOQ以S/N=10计为10 ng/mL。
3.2.3 回收率和精密度 低、中、高浓度的方法回收率(%)分别为93.82、94.79、98.08,RSD(%)分别为5.13、3.58、2.33。提取回收率(%)分别为81.79、80.59、84.93,RSD(%)分别为5.00、4.64、2.20。平均提取回收率大于75%,提取回收率稳定。
日内精密度 RSD(%)分别为4.28、3.48、3.05,日间精密度RSD(%)分别为9.18、4.54、4.04。日内日间精密度RSD均小于10%,分析良好。
3.2.4 药物动力学试验结果 经HPLC测定后,绘制出两组数据的血药浓度-时间曲线(图3)。

3.2.5 房室模型拟合 采用Kinetica 4.4.1实用药代动力学程序对市售制剂和缓释微丸药动数据进行隔室模型的拟合,比较赤池信息判据(Akaike′s information criterion,AIC),经最小AIC判别法确定,结果表明两组制剂均符合开放二室模型,其药代动力学参数如表3所示。
3.2.6 非隔室模型统计结果 采用统计矩的原理对体内血浓药时曲线进行非模型化解析。由表4可知自制硝苯地平缓释制剂和市售普通片相比平均MRT增加、平均tmax增加、平均cmax减少,结果表明,自制硝苯地平制剂在大鼠体内有一定的缓释效果。
Table3 Pharmacokinetic parameters of nifedipine sustained-release pellet and immediate-release tablet using model compartments
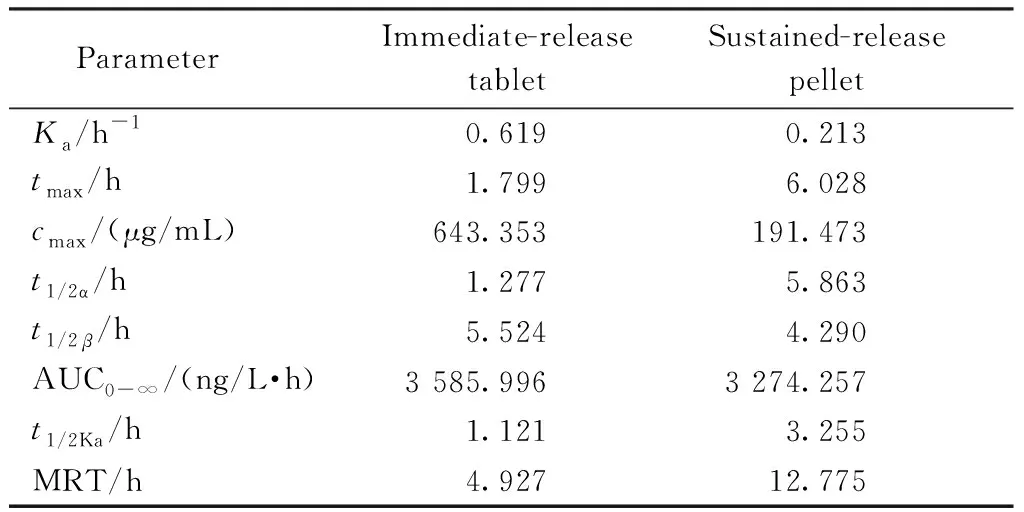
ParameterImmediate-release tabletSustained-release pelletKa /h-10.6190.213tmax /h1.7996.028cmax /(μg/mL)643.353191.473t1/2α /h1.2775.863t1/2β/h5.5244.290AUC0-∞/(ng/L·h)3 585.9963 274.257t1/2Ka/h1.1213.255MRT/h4.92712.775
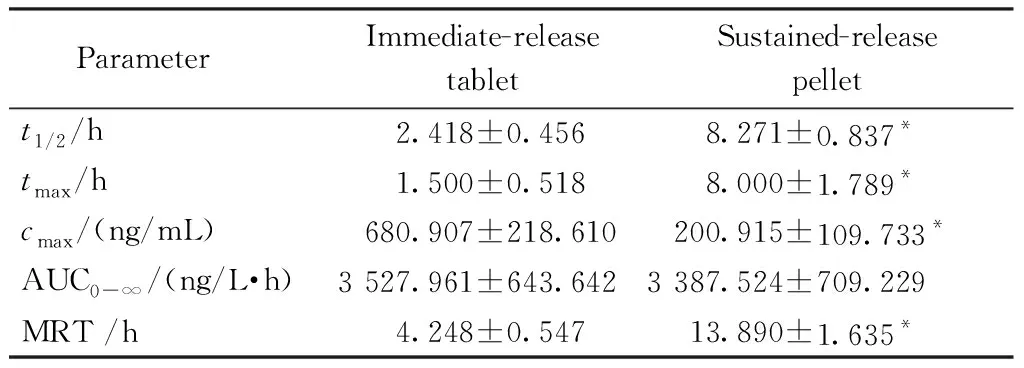
ParameterImmediate-release tabletSustained-release pellett1/2/h2.418±0.4568.271±0.837*tmax /h1.500±0.5188.000±1.789*cmax /(ng/mL)680.907±218.610200.915±109.733*AUC0-∞/(ng/L·h)3 527.961±643.6423 387.524±709.229MRT /h4.248±0.54713.890±1.635*
*P<0.005 vs immediate-release tablet group
3.2.7 6β-OHF/FC与硝苯地平缓释微丸药物动力学的关系 将缓释微丸组(1~5号大鼠)和市售组(6~10号大鼠)的药代动力学相关参数CL、AUC和cmax分别对6β-OHF/FC进行线性回归。由表5可知在自制硝苯地平缓释制剂组中,CL和AUC对6β-OHF/FC显著相关,而cmax对6β-OHF/FC的相关性次之。在市售普通片组中,AUC对6β-OHF/FC显著相关,CL次之,而cmax对6β-OHF/FC 的相关性较弱。
Table5 Correlation coefficient of 6β-OHF/FC and pharmacokinetic parameters of nifedipine matrix sustained-release pellets and immediate-release tablets

GroupParameterCLAUCcmaxNifedipine matrix sustained-release pelletsr0.953 2-0.953 5-0.819 7P0.011(<0.05)0.032(<0.05)0.184Nifedipine immediate-release tabletsr0.832 4-0.843 4-0.721 9P0.0760.034(<0.05)0.150
4 讨 论
本研究以地塞米松为内标,同时测定尿中的6β-OHF和FC含量,流动相B选用硫酸铵,可以减小峰宽,峰形较尖锐对称,当6β-OHF浓度较大时可以减轻前伸峰。本法的建立及尿液中6β-OHF和FC比值的测定,可为进一步研究CYP3A4酶的作用机制和某些药物对该酶活性的影响提供参考。
本研究以市售硝苯地平片为参比制剂,比较了自制硝苯地平缓释微丸和市售制剂的体内药物动力学行为。从平均血药浓度-时间曲线图可以看出,市售片的平均达峰时间tmax为1.50 h,而缓释微丸的平均达峰时间为8.00 h,较市售制剂显著延迟,且缓释微丸的MRT较市售制剂显著增加(P<0.005),cmax和t1/2显著降低(P<0.005),AUC0-∞无差异(P=0.467),说明缓释微丸在体内具有明显的缓释效果。
本研究试图以CYP3A4代谢酶活性差异角度为出发点,解释硝苯地平制剂体内个体差异的原因。随着CYP3A4活性的增强,硝苯地平缓释微丸的一些主要药代动力学参数呈一定趋势的改变,如清除率CL变大,AUC减小,cmax减小。实验发现CYP3A4活性与硝苯地平缓释微丸药代动力学参数的相关性较好,可能由于市售组为速释片,药物在最初阶段大量吸收进入体内后,代谢药物的CYP3A4酶达到饱和状态;而缓释微丸释药缓慢,药物缓慢进入体内后CYP3A4酶并未达到饱和状态,药物能被充分代谢,故CYP3A4活性与缓释微丸的几个药代动力学参数相关性较好。两种制剂的相关药代动力学参数均随CYP3A4活性改变而变化的实验结果表明,CYP3A4活性可以影响硝苯地平在体内代谢的程度,进而改变其全身清除率及生物利用度等。
由于不同个体间CYP3A4代谢酶的活性不同,对于硝苯地平的清除率也不同,若CYP3A4活性过高,则硝苯地平在其体内代谢速率增加,全身清除率随之增加。此外,肝脏是CYP3A4存在和作用的主要场所,若其活性过高,药物口服给药后的首过效应会增加,生物利用度也会明显降低,因此需要根据实际情况调整给药方案以达到理想的治疗效果。通过监测CYP3A4基因的多态性及酶活性,可以针对不同人群不同患者制定相应的给药方案。

