基于双重信号放大的电化学免疫法对前列腺特异性抗原的检测
李 雪,艾永玲,何群叶,杨功俊,王 菁,*
(中国药科大学 1医药生物功能材料重点实验室;2药物质量与安全预警教育部重点实验室,南京 210009)
肿瘤标志物在癌症早期诊断及预后预测具有重要的临床价值。前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤,占全球癌症发病率第5位[1]。其检测手段中,血清前列腺特异抗原(PSA)是最重要的早期检测指标[2]。一般情况下,PSA正常值小于4 ng/mL,当前列腺癌发生时其质量浓度大于10 ng/mL[3]。因此,及时并准确地检测PSA在前列腺癌的预测和诊断中至关重要。
在肿瘤标志物的不同分析方法中,电化学分析法因具有灵敏度高、操作简便等优点而倍受青睐[4]。但由于免疫分析中抗原/抗体都是非电活性的,因此往往需要对其进行标记。量子点(QDs)因其独特的光学性质及良好的生物相容性而被广泛地应用于生物传感、免疫分析和生物成像等多个方面[5-8]。除此之外,QDs还具备良好的电化学特性,利用QDs吸收转化光子和转移电子的能力,通过方波溶出伏安法(SWSV)可直接反映为电流响应信号[9],因而QDs常被用作信号标记物。Liu等[10]基于叶酸修饰的CdSe/ZnS QDs实现了对KB细胞的高灵敏检测。Chen等[11]利用CdS QDs和适配体滚环扩增放大技术进行赭曲霉毒A的检测。利用QDs中金属元素并结合高灵敏的溶出伏安法,可实现对肿瘤标志物的电化学免疫分析。
为了进一步提高免疫传感的灵敏度,已有大量的研究工作致力于利用各种纳米材料来放大检测信号[12-13]。还原氧化石墨烯(rGO)是石墨烯的一种重要衍生物,具有热学和化学稳定性、比表面积大、生物相容性好以及导电性强等优点[14]。AuNPs同样有较大的比表面积,良好的电化学特性,此外其有较强的吸附能力,可用于装载含有-NH2、-SH的物质[15]。因而,两种材料在免疫分析方面得到广泛应用。
基于以上出发点,本研究采用水溶性量子点GSH-CdTe作为信号标记物,利用rGO和AuNPs自身独特的优点,直接和间接地增加信号物的量,以此构建了双重信号放大的电化学免疫传感法。当免疫反应发生后,采用SWSV对酸解的Cd2+进行测定,其峰电流对应这个目标物的浓度,实现了对肿瘤标志物PSA的灵敏检测。
1 材 料
1.1 试 剂
Anti-PSA Ab1(PSA抗体1,1.9 mg/mL)、Anti-PSA Ab2(PSA抗体2,1.7 mg/mL)、PSA抗原(0.5 mg/mL)(上海领潮生物科技有限公司);碲粉(Te,99.99%)、CdCl2·2.5H2O(≥99.0%)、还原型谷胱甘肽(GSH,98%)、N-羟基琥珀酰亚胺(NHS,98%)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC,98%)(上海阿拉丁生化科技股份有限公司);牛血清蛋白(BSA,Solarbio公司);氧化石墨烯分散液(0.5 mg/mL,南京先锋纳米科技有限公司);氯金酸(国药集团化学试剂有限公司)。其他试剂均为分析纯并直接使用。整个实验用水均为超纯水(电阻系数≥18.2 MΩ·cm,Milli-Q,美国Millipore公司),所用PBS缓冲液pH均为7.4,浓度为0.1 mol/L。
1.2 仪 器
电化学工作站(CHI,上海辰华仪器有限公司);UV-3600紫外可见吸收光谱仪,IRAffinity-1S红外光谱仪(日本岛津公司);2000型透射电子显微镜(TEM,日本Jeol公司)。
2 方 法
2.1 不同粒径AuNPs的制备
制备AuNPs之前所有的玻璃器皿在新鲜配制的王水(HNO3-HCl,1∶3)中浸泡12 h,用超纯水洗净,烘干备用。
直径5 nm的AuNPs按照文献[6]方法制备并稍做改进,具体步骤为:将0.1 mol/L冰浴后的NaBH4溶液0.6 mL加入到2.5×10-4mol/L HAuCl4的水溶液20 mL中,随着搅拌,溶液迅速变成橙红色,为了保证AuNPs的生成,在持续冰浴条件下搅拌3 h,直至溶液颜色变为酒红色。制备的AuNPs于4 ℃下储存。
20 nm粒径的AuNPs参照文献[16]方法制备。取1% NaBH4水溶液10 mL快速加入到含HAuCl410 mg的沸水190 mL中,剧烈搅拌并煮沸30 min,然后待反应溶液自然冷却至室温,得到酒红色的20 nm AuNPs溶液,同样保存于4 ℃备用。
2.2 GSH-CdTe QDs的合成
将碲粉125 mg和NaBH4200 mg加入到装有超纯水10 mL的圆底烧瓶中,N2环境下磁力搅拌剧烈反应10 min,然后密封,在冰浴中搅拌30 min得到NaHTe溶液。将CdCl2·2.5H2O 554.3 mg和GSH水溶液350 μL加入到水250 mL中以形成Cd前驱溶液。然后用1 mol/L NaOH调pH至10,并向该溶液中通N230 min除氧。最后将新鲜制备的NaHTe溶液在N2环境下注入到Cd前驱溶液中,搅拌20 min后,在95 ℃通氮气条件下加热回流3 h得到GSH-CdTe QDs。反应结束后用无水乙醇反复离心洗涤3次,最后分散于超纯水中并于4 ℃下保存[17]。
2.3 AuNPs@GSH-CdTe复合物及信号标记物的制备
GSH-CdTe QDs与20 nm的AuNPs按照质量浓度比5∶1的比例混合,室温下搅拌过夜,反应物分别用无水乙醇和超纯水离心洗涤,得到AuNPs@GSH-CdTe复合物并分散在水溶液中[18]。信号标记物的制备过程如图1所示,具体为:AuNPs@GSH-CdTe 500 μL中加入20 mg/mL EDC溶液和10 mg/mL NHS溶液各25 μL,室温下振荡反应1 h。在这里EDC和NHS的作用是活化ODs表面的羧基,用以更好地与抗体连接。接下来,再向混合液中加入100 μg/mL PSA Ab1溶液50 μL,继续室温混合振荡2 h。最后将5%的BSA溶液50 μL加入到上述溶液中继续振荡1 h,用以封闭QDs表面的活性位点。最终反应物用PBS溶液离心洗涤2次,并重新分散在PBS溶液500 μL中,所制信号标记物4 ℃下保存备用。
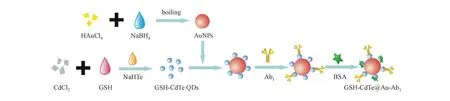
Figure1 Synthesis process of AuNPs@GSH-CdTe-Ab1
QDs:Quantum dots
2.4 rGO/AuNPs及rGO/AuNPs-Ab2制备
首先,取0.5 mg/mL GO分散液5 mL至圆底烧瓶中,并向其中加入适量的NaBH4,在80 ℃条件下持续搅拌并回流5 h,所得产物rGO用超纯水洗涤数次。其次,将所得的rGO再次分散于水4 mL中。接着,在上述rGO的水溶液中加入5 nm的AuNPs溶液5 mL,并室温下搅拌过夜,最终得到rGO/AuNPs复合材料[19]。
取rGO/AuNPs复合材料溶液300 μL转移至0.2 mL离心管中,用PBS缓冲液清洗2次。再向离心管中加入10 μg/mL PSA Ab2溶液500 μL,室温下混合振荡2 h,用PBS缓冲溶液离心洗涤。随后再向离心管中加入5%的BSA 100 μL,继续室温下混合振荡1 h,PBS离心洗涤,此处的BSA是用以封闭rGO/AuNPs复合材料上的活性位点,减少非特异性吸附。所制得的rGO/AuNPs-Ab2于4 ℃下保存备用(图2)。
2.5 基于纳米复合材料的电化学免疫检测
图3为“三明治”电化学免疫测定过程示意图。首先将不同浓度PSA抗原溶液500 μL加入到离心管中,与rGO/AuNPs-Ab2在37 ℃下反应40 min,反应完成后,离心洗涤2次。然后加入AuNPs@GSH-CdTe-Ab1信号标记物,37 ℃水浴振摇1 h,根据形成“三明治”免疫结构形成前后相对分子质量的变化,使用100 kD的超滤膜将未与抗原结合的AuNPs@GSH-CdTe-Ab1标记物离心去除,得到最终检测的“三明治”免疫夹心结构。
本工作采用三电极体系对体系进行检测:玻碳电极(GCE,直径3 mm)作为工作电极,饱和甘汞电极作为参比电极,铂电极作为辅助电极。GCE在使用前用金相砂纸进行打磨,再用粒径为0.05 μm的Al2O3悬浊液在绒布上抛光,得到明亮的镜面。在浓度为0.5 mol/L铁氰化钾溶液中利用循环伏安法(CV)表征电极性能。
为了检测信号标记物中溶解出的Cd2+,采用SWSV对其进行测定。测定时,首先,用0.1 mol/L的硝酸溶液500 μL溶解上述所得的免疫夹心结构中的Cd2+。其次,将得到的硝酸溶液(含有溶解的Cd2+)和900 μL含有10 mg/L Hg2+的醋酸-醋酸钠缓冲溶液(0.2 mol/L,pH 4.6)混合,并转移至电化学池中测定。最后SWSV测定,过程为:先在-1.2 V电位下电沉积120 s,沉积时磁力搅拌。然后电位从-1.0 V扫描至-0.3 V,电位扫描区间为N2保护下进行。方波参数为:静置时间10 s,振幅为25 mV,电位增量为4 mV,频率15 Hz。
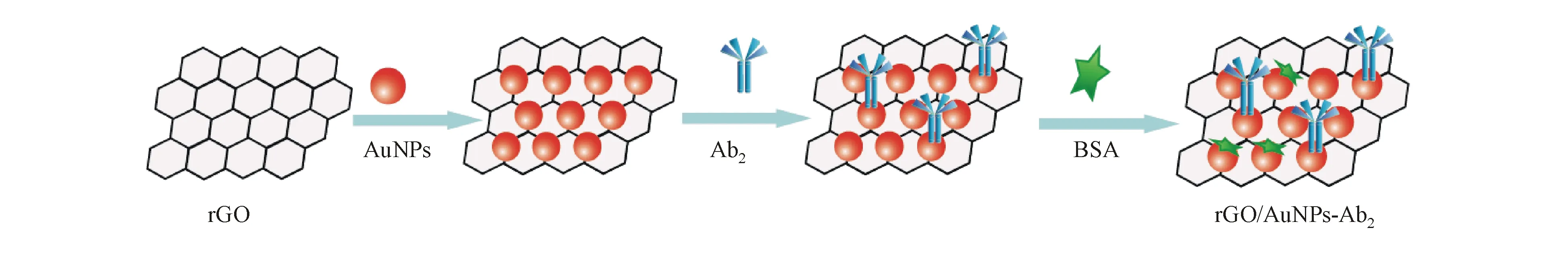
Figure2 Synthesis process of rGO/AuNPs-Ab2

Figure3 Principle of double signal enhancing strategy for PSA detection
PSA:Prostate specific antigen
3 结果与讨论
3.1 GSH-CdTe QDs的表征
由水热法制备所得的GSH-CdTe QDs,利用透射电子显微镜(TEM)、紫外可见吸收光谱仪(UV-vis)以及红外光谱仪(IR)对其进行表征,如图4所示。从图4-A可以看出,GSH-CdTe QDs约在370 nm处出现一个UV-vis吸收峰,根据文献可计算出其粒径约为5.2 nm[20],同时与粒径分布图集中显示的4~6 nm一致。TEM图也显示出,GSH-CdTe QDs具有良好的分散性,颗粒近似呈球状,粒径大小分布比较均匀,约为5 nm,这与UV-vis结果一致。IR谱图可以观察到N-H的伸缩振动峰在3 425 cm-1,而GSH中S-H的伸缩振动峰在2 534 cm-1处基本消失,由此可见,GSH与QDs之间形成了S-Cd键,此外,-COOH不对称伸缩振动峰由GSH中的1 720 cm-1移至1 606 cm-1,同时在1 380 cm-1处出现了-COO-的对称伸缩振动峰,说明保护剂GSH以负离子的形式存在。
3.2 AuNPs及其复合物材料的表征
图5为制备的单纯AuNPs和它的复合材料UV-vis表征图。从图中可以看到5和20 nm的AuNPs均在520 nm左右有吸收峰,此峰为AuNPs的特征吸收峰(图5-A曲线a,图5-B曲线a)。此外,AuNPs@GSH-CdTe的曲线(图5-A曲线b)较20 nm AuNPs而言,在380 nm处有明显地GSH-CdTe QDs吸收,且QDs的量远大于AuNPs。以此可以说明20 nm的AuNPs可作为很好的纳米载体,负载大量的信号物质QDs,达到信号放大的目的。对比5 nm AuNPs的吸收,rGO/AuNPs的UV-vis吸收(图5-B曲线b)除了AuNPs的特征峰外还在280 nm左右处有了rGO的特征吸收峰,同时rGO/AuNPs复合物的形成使得AuNPs的吸收有少许蓝移,证明复合物的成功制备。

Figure4 Characterization of ODs.A:UV-vis absorption spectra of GSH-CdTe QDs solution,inset:Corresponding size distribution of GSH-CdTe QDs;B:TEM image of GSH-CdTe QDs;C:FT-IR spectra of GSH-CdTe QDs
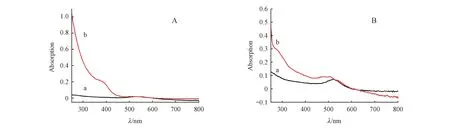
Figure5 UV-vis absorption spectra of (A):20 nm AuNPs (a) and AuNPs@GSH-CdTe (b);and (B):5 nm AuNPs (a) and rGO/AuNPs (b)
3.3 rGO和rGO/AuNPs复合物的TEM表征
为进一步证明rGO/AuNPs复合物的生成,利用TEM直观地对rGO和rGO/AuNPs复合物进行形貌表征,如图6所示。纯rGO呈表面褶皱的单层片状结构,形成rGO/AuNPs复合物后,明显看出,5 nm AuNPs均匀地镶嵌在rGO表面,AuNPs的存在能更加有利于生物分子的结合,同时也增大了rGO的生物结合面积,使得其表面能更加有效地放大交联PSA Ab2的数量。
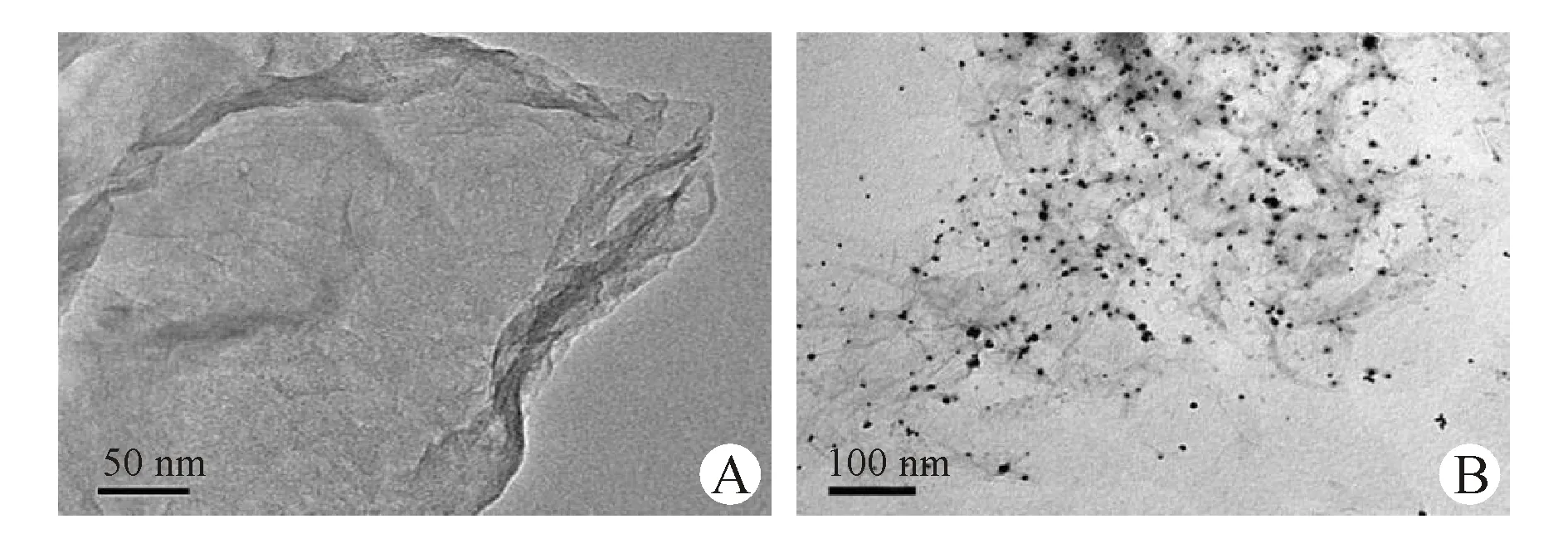
Figure6 TEM image of (A) rGO and (B) rGO/AuNPs
3.4 双重信号放大免疫传感的实现
实验中,利用AuNPs@GSH-CdTe复合材料标记PSA Ab1,“三明治”免疫反应后,将rGO/AuNPs表面所反应结合到的GSH-CdTe QDs用HNO3溶解,采用SWSV来检测酸解的Cd2+峰电流,从而达到定量检测抗原PSA的目的。因为CdTe的量正比于相应的抗原,故产生的电化学信号可以指示PSA的量。体系中使用的20 nm的AuNPs具有较大的比表面积,能够负载更多的CdTe信号分子,可以直接地增加Cd2+量,达到一重信号放大的作用。而rGO/AuNPs复合物不仅更适合抗体的组装,也能增加抗体的数量,从而间接地增加Cd2+量,达到二重信号放大的效果。当体系中存在50 ng/mL的目标抗原PSA时,利用这些复合纳米材料,可以得到一个很显著的Cd2+电化学信号(图7曲线a)。然而,当体系中没有PSA存在时,AuNPs@GSH-CdTe-Ab1信号标记物无法结合到rGO/AuNPs表面上,因此经过洗涤后酸解无Cd2+的信号峰(曲线b),这得以证明免疫传感的特异性,并为后续的定量分析提供了良好的背景信号。为了更明确AuNPs和rGO在信号放大方面所起作用,在相同的实验条件下(PSA 50 ng/mL)做了两个对照实验,当以单独的QDs作为信号标记物时,仅有较弱的信号产生(曲线c),证明GSH-CdTe QDs的含量直接影响信号大小。同样,若rGO未参与反应体系时,AuNPs所装载的抗体较少,导致后续免疫反应的量也减少,电化学信号减弱(曲线d)。为了进一步确定采用三明治夹心结构的优势,仅用AuNPs@GSH-CdTe标记Ab1。检测过程中,使得目标抗原与AuNPs@GSH-CdTe-Ab1直接反应,即体系中不存在二抗。反应结束后使用50 kD的超滤膜离心去除未结合抗原的信号标记物,最终产生的信号如图7曲线e所示。可以看出,相较于使用二抗载体来说,该结构的信号更弱,这可能是由于缺少二抗载体,抗原和信号分子直接结合,空间位阻减小,会发生一个信号分子与多个抗原结合的情况,从而使得检测到的Cd2+电流较弱。因此,所构建的三明治免疫传感方法可以通过纳米复合材料得到有效的双重信号放大,实现对PSA的灵敏检测。
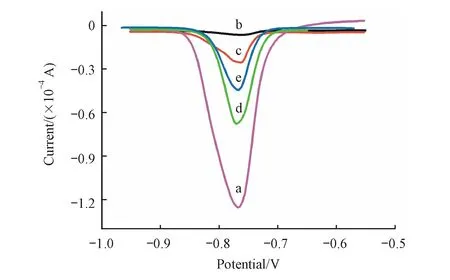
Figure7 SWSVs of Cd2+responding to different assembled mode
a:AuNPs@GSH-CdTe-Ab1-PSA-Ab2-AuNPs/rGO;b:without PSA;c:GSH-CdTe-Ab1-PSA-Ab2-AuNPs/rGO;d:AuNPs@GSH-CdTe-Ab1-PSA-Ab2-AuNPs;e:GSH-CdTe-Ab1-PSA.The concentration of PSA is all 50 ng/mL
3.5 实验条件的优化
为了高灵敏地检测肿瘤标志物PSA,对实验条件进行了系统的优化,包括AuNPs@GSH-CdTe-Ab1的用量、BSA的浓度和PSA的孵育时间。本实验用Cd2+的溶出峰电流作为代表来考察各个因素的影响。
信号标记物的多少将决定最终的信号强弱,因而,首先考察了AuNPs@GSH-CdTe-Ab1的用量对其电化学信号的影响。图8-A为不同体积的AuNPs@GSH-CdTe标记抗体与Cd2+溶出峰电流之间的关系图。结果表明,随着AuNPs@GSH-CdTe-Ab1加入量的增加,溶出峰电流也随之增大,当加入体积超过30 μL后,Cd2+的溶出峰电流基本平稳。为了反应更加充分,最终选择以40 μL为信号标记物的反应体积。
在免疫测定中,减小标记抗体的非特异性吸附是至关重要的,它往往制约了测定的检测限。所以在本实验中,利用BSA封闭活性位点,从而防止假阳性实验结果的产生。对BSA浓度的优化如图8-B所示。选取1%~10%的BSA并没有目标抗体PSA参与的情况下进行考察。理论上,当不存在抗原时,免疫反应不能发生,无法形成“三明治”免疫夹心结构,从而没有信号产生。但从图7-B中观察到仅随着BSA浓度的增加,信号逐渐减弱,直至BSA浓度为5%时,信号基本消失。因而,5%的BSA可以完全的封闭活性位点,达到最优实验效果。
在“三明治”免疫反应中,PSA抗原的孵化时间也极大的影响了免疫测定的性能。从图8-C可以看出随着孵育时间的增加,响应信号也增加,40 min后趋于平稳。考虑到更长时间的孵育并不能显著提高电流响应,反而会增加非特异性吸附,所以实验中选用的孵育时间为40 min。
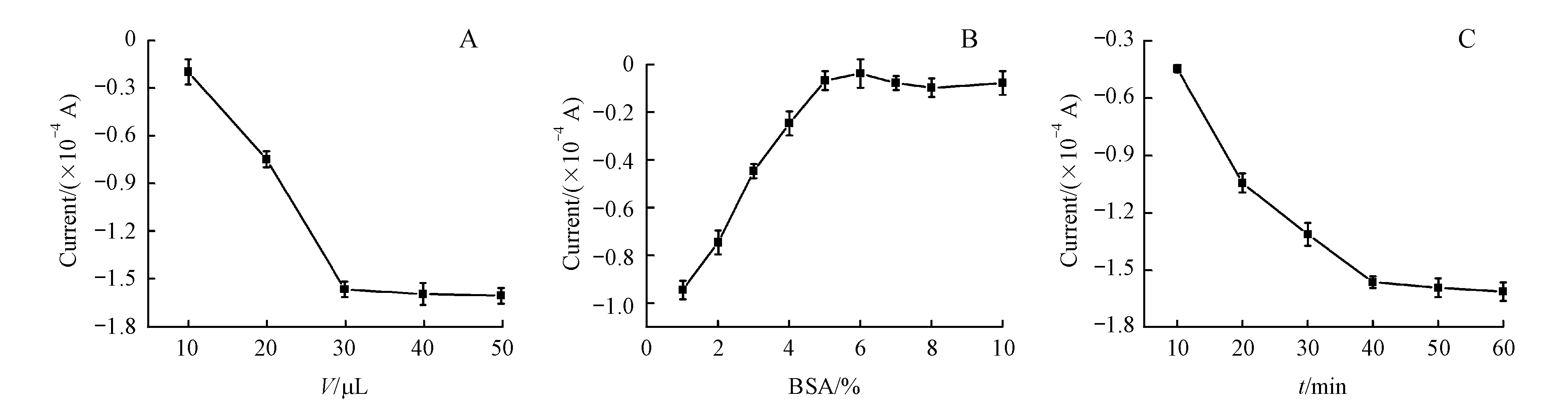

A:Volume of AuNPs@GSH-CdTe-Ab1;B:Concentration of BSA;C:Incubation time of PSA
3.6 双重信号放大的免疫传感分析性能
在上述最佳实验条件下,目标抗原PSA的浓度与Cd2+溶出峰电流大小直接相关。如图9-A,Cd2+溶出峰具有很好的峰型,并且随着PSA浓度的增加而增大。从图9-B可以看出,PSA质量浓度在0.5~200 ng/mL PSA范围内,lgc(PSA)与溶出峰电流(I)呈良好的线性关系,线性回归方程为I=-0.524 6 lgc-0.393 9,线性相关系数(r)为0.997,检测限为5.0 pg/mL。在相同条件下对10 ng/mL 的PSA进行5次平行测定,得到相对标准偏差(RSD)为1.92%。以上可以证明该免疫传感方法能对PSA实现灵敏准确的测定。此外,与其他现有检测PSA的方法比较,可以看出该方法具备更宽的线性范围或更低的检测限(表1)。

Figure9 Determination of PSA concentration by constructed immunoassay

Table1 Comparison of the present study and other reports for PSA detection

MethodLinear range/(ng/mL)LOD/(ng/mL)Ref.Chemiluminescence0.1-300.1[21]Electrochemiluminescence0.01-80.008[22]Colorimetric Immunoas-say0.05-200.03[23]Electrochemistry1-180.001[24]Fluorescence1.56-250.001 56[25]Electrochemistry0.5-2000.005This work
3.7 重复性、专属性和稳定性考察
考虑到该检测方法的实用性,对所构建的免疫传感方法进行了重复性、专属性和稳定性3个方面的考察。首先,重复性通过对3种检测浓度5个不同批次的“三明治”免疫结构进行组间实验。实验结果如表2所示,组间实验的RSD在9%以内,表明该免疫测定方法具有较好的重复性。
Table2 Reproducibility of this immunoassay were evaluated by inter-assay relative standard deviation (RSD)

c(PSA)/ (ng/mL)Current (×10-4 A)12345RSD/%1-0.402-0.426-0.386-0.388-0.4144.210-0.983-0.998-1.151-0.982-1.1558.6100-1.396-1.275-1.249-1.462-1.2138.0
其次,是专属性的考察,实际样品检测中往往成分比较复杂,为了排除其他物质对该方法的干扰,本实验选取甲胎蛋白(AFP)、组织多肽抗原(TPA)、癌胚抗原125(CA125)、人血清蛋白(HAS)作为干扰物,以50 ng/mL为基准反应浓度。最终结果可由图10观察得到,单一的干扰物的电流响应值很小,并且各物质与PSA的混合物对检测的影响也可忽略,说明该方法专属性良好。
最后,将“三明治”免疫结构在4 ℃下存放1个月,其电流响应值为原始数值的89%,虽有少许降低,但也能看出该方法有较好的稳定性。
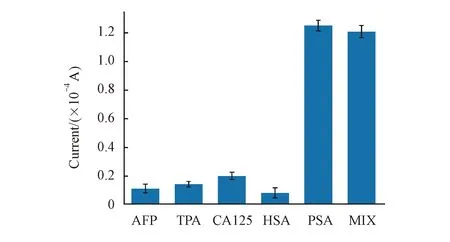
Figure10 Selectivity of the PSA detection.The SWSVs of Cd2+responding to the different proteins (the concentration of AFP,TPA,CA125,HAS and PSA were 50 ng/mL) and the mixture of AFP,TPA,CA125,HAS and PSA is also 50 ng/mL.Error bars show the standard deviations of measurements taken from at least three independent experiments
3.8 实际样品分析
为了进一步验证本方法的实用性,采用加样回收的方法对实际样品进行考察。将不同浓度的PSA加入到来自南京市鼓楼医院的一系列血清样品中,结果如表3所示,回收率在98.20%~106.2%之间,RSD均小于5%,表明该方法可用于实际样品的测定。
Table3 Determination of PSA added in human blood serum (n=5) with the developed method

Serum sampleAdded PSA/(ng/mL)Found PSA/(ng/mL)RSD/%Recovery/%11.0000.9823.298.20210.009.9703.999.70350.0051.532.5103.14100.0106.24.1106.2
4 结 论
采用水热法合成了GSH-CdTe QDs、AuNPs和rGO,并制备了相应的复合物,利用AuNPs比表面积大以及较好的生物相容性,达到了成功装载抗体以及放大信号的效果,同时具有较大表面积的rGO起到了协同放大的作用。因而在双重信号放大的作用下,本实验所构建的电化学免疫分析方法实现了对肿瘤标志物PSA的检测,具有较宽的线性范围,并且该方法专属性、重复性以及稳定性好,可作为准确检测肿瘤标志物PSA可行方法。

