高镁钙磷尾矿酸解液净化除杂工艺条件研究
张萍花,李梦婷,李晓玲,燕云洁,李沙沙
宿州学院化学化工学院,宿州,234000
磷矿选矿剩下的尾渣即磷尾矿,属于固体废弃物[1]。目前,磷尾矿的利用率仅为7%左右[2-4],其长期堆放于农田、林用土地,造成环境污染[5-6],同时浪费了大量资源,因此开发利用磷尾矿具有重要的现实意义[7-9]。
目前,国内外学者在利用磷尾矿制备建筑材料和功能陶瓷材料等方面已经取得相当多的实用性成果,也获得了较为明显的经济和社会效益[10]。一些学者[11-12]对磷尾矿进行物相及化学组成分析,发现磷尾矿含有大量有用矿物,属于高镁钙磷尾矿,但从磷尾矿中回收有价值金属成分的研究尚处于初级阶段,相关文献报道也较少。
本文拟综合利用高镁钙磷尾矿中的镁钙,以磷尾矿为原料,用酸性溶液浸取[13-15],使金属成分从固体中解离出来。根据各种金属离子在碱性溶液中开始沉淀和完全沉淀的pH值不同,将金属杂质离子除去,得到含高纯镁离子和钙离子的溶液,用于制备最终产品,一方面解决了磷尾矿堆积带来的环境及土地污染问题;另一方面实现了资源的充分利用,提高了磷尾矿的磷品位[16]。
1 实验部分
1.1 原料、试剂与仪器
1.1.1 实验原料
酸解所用磷尾矿成分如表1所示。

表1 实验原料磷尾矿化学成分
净化除杂原料:磷尾矿经硝酸复合溶液酸解得到的酸解液。
1.1.2 实验试剂
所用主要试剂:氢氟酸、硝酸、盐酸、浓硫酸(98%)、氢氧化钠、氨水(28%),均为分析纯,国药集团化学试剂有限公司提供。
1.1.3 实验仪器
电动搅拌器(DW-1-30W)、恒温干燥箱DHG9245A、恒温加热套(SZCL-2),均来自巩义市瑞力仪器设备有限公司。电感耦合等离子体发射光谱仪(ICP-AES,2060T,江苏天瑞仪器有限公司),蠕动泵(BT-200,上海沪西),全自动大量程干法激光粒度仪(Winner3008,济南微纳颗粒仪器有限公司),X射线粉末衍射仪(XRD,D/MAX-2500型,日本Rigaku公司),扫描电子显微镜(SEM,Quanta 50,美国FEI公司)。
1.2 实验方法
1.2.1 预处理磷尾矿
将经120目筛子筛选后的磷尾矿粉末置于120 ℃恒温干燥箱中连续干燥3 h,待冷却到室温,采用激光粒度仪进行粒径分析。称取一定量烘干的磷尾矿,在特定的条件下与硝酸复合溶液进行酸解反应。
1.2.2 净化处理酸解液
磷尾矿中含有少量的黄铁矿、石英和菱铁矿,在酸性条件下,会发生反应进入溶液体系。酸解后的滤液经检测含有Al3+、Fe2+和Fe3+等杂质,严重影响产品纯度,因此在制备产品前,须除去酸解液中所含的杂质离子。
1.2.2.1 酸解液除杂原理
采用蠕动泵以合适的速度向含有Al3+、Ca2+、Fe3+、Fe2+与Mg2+的酸解液中输送碱性溶液,随着混合溶液pH值的变化,发生以下离子反应:
Fe3++3OH-=Fe(OH)3↓
(1)
KspFe(OH)3=[Fe3+]×[OH-]3
(2)
KspFe(OH)3=4.0×10-38
(3)
KW=C(H+)×C(OH-)=10-14
等式两边取负对数,整理得:
pMFe3+=pKspFe(OH)3-3pKW+3pH=3pH-4.6
(4)
同理得到:
Fe2++2OH-=Fe(OH)2↓
(5)
KspFe(OH)2=[Fe2+]×[OH-]2
(6)
KspFe(OH)2=8.0×10-16
pMFe2+=pKspFe(OH)2-2pKW+2pH=2pH-12.9
(7)
Mg2++2OH-=Mg(OH)2↓
(8)
KspMg(OH)2=1.8×10-11
pMMg2+=pKspMg(OH)2-2pKW+2pH
=2pH-17.26
(9)
Ca2++2OH-=Ca(OH)2↓
(10)
KspCa(OH)2=5.50×10-6
pMCa2+=pKspCa(OH)2-2pKW+2pH
=2pH-22.74
(11)
Al3++3OH-=Al(OH)3↓
(12)
KspAl(OH)3=4.57×10-33
pMAl3+=pKspAl(OH)3-3pKW+3pH=3pH-9.66
(13)
上述公式中的M代表溶液中金属离子的摩尔浓度(mol/L),其中pM=-lgM。
1.2.2.2 各种金属离子pM-pH值
将(4)、(7)、(9)和(11)方程式绘于图1中,即得到在不同 pH 条件下溶液中各金属离子的pM-pH图。
图1中区域(1)为Fe3+、Al3+、Fe2+、Mg2+和 Ca2+的共存区;区域(2)为Al3+、Fe2+、Mg2+和Ca2+的共存区;区域(3)为Fe2+、Mg2+和 Ca2+的共存区;区域(4)为Mg2+和Ca2+共存区;区域(5)仅Ca2+存在。由此分析可知,当溶液的pH值较低时,Fe3+开始和OH反应生成Fe(OH)3沉淀,溶液pH值大于3.5时Fe3+完全沉淀,脱离溶液体系。当溶液的pH较高时Fe2+形成Fe(OH)2沉淀,但此时部分Mg2+和Ca2+参与反应,生成沉淀,造成有价金属的损失,因此须先将Fe2+转化为Fe3+。
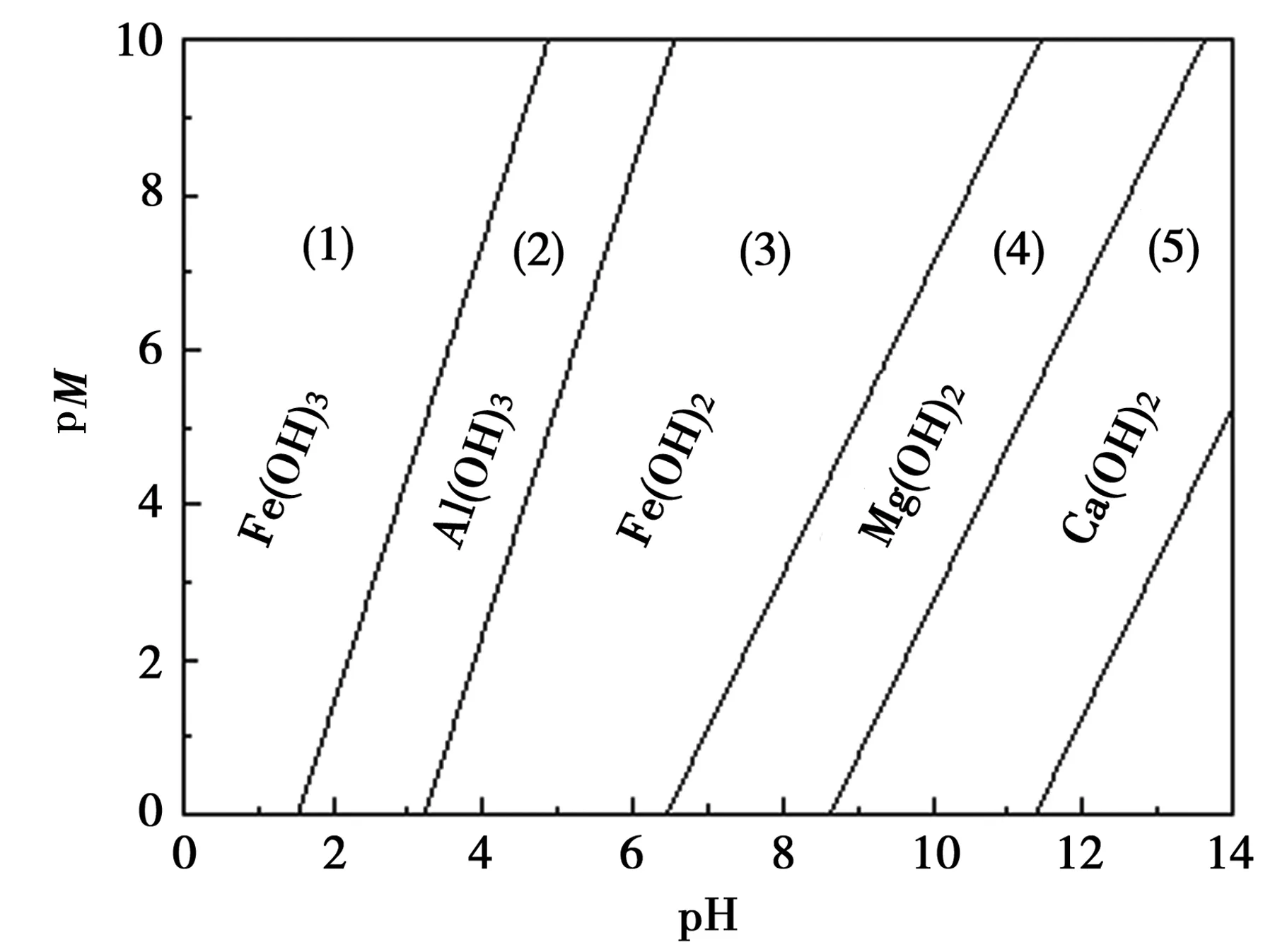
图1 金属氢氧化物的浓度对数图
1.2.2.3 各种金属离子开始沉淀和完全沉淀时溶液的pH值
由方程式(4)、(7)、(9)和(11)可计算得出金属离子与氢氧根刚开始结合形成氢氧化物以及完全沉淀时溶液的pH值,具体pH值数据见表2。
由表2可知,通过加入碱性缓冲溶液,使溶液中pH值高于3.5时,Fe3+将脱离溶液体系,完全沉淀。此外,通过分析表2可得,Fe(OH)2完全沉淀和Mg(OH)2开始沉淀的pH值接近,通入碱性缓冲溶液至某一个pH值,两者同时沉淀,不易分离,产物纯度较低,再加上Fe(OH)2对产品的致色效应,降低了Mg(OH)2的白度,限制了其应用领域,于是须将Fe2+转化成Fe3+,确保即使加入少量的氨水,在较低pH值内也能将铁离子杂质除去。因TOEN(HCl、HNO3、H3P04按照一定比例配置而成的混合酸)具有较强的氧化能力,且受热易分解,不会引入杂质离子,故选TOEN为调整剂,并研究了TOEN最佳用量。

表2 相关物质的溶度积常数Ksp以及开始和完全沉淀时溶液的pH值
注:残留离子浓度<10-5mol·L-1,t=25 ℃
1.3 分析测试
用X射线衍射仪对磷尾矿进行物相分析,用激光粒度仪测定磷尾矿的粒径和分布。
2 结果与讨论
2.1 磷尾矿粒度分析
将磷尾矿用小型矿物粉碎机粉碎,并用120目筛子筛选,筛选后的磷尾矿置于120 ℃ 恒温烘箱3 h,采用全自动大量程干法激光粒度仪对处理后的磷尾矿粉末进行粒度分析,实验结果见图2。

图2 磷尾矿的激光粒度分布图
从图2看出,经120 ℃恒温烘箱干燥的磷尾矿颗粒较细,其中95.66%的矿粉粒径在100 μm以下,粒径小,比表面积大。随烘箱温度升高,粒径持续减小,但趋势平缓且能耗增大,故选用120 ℃作为烘箱干燥温度。此时磷尾矿酸浸过程为粒径逐渐缩小的缩芯模型,有利于酸解过程中金属组分参加反应,进入溶液体系。
2.2 磷尾矿物相组成分析
利用X射线粉末衍射仪对磷尾矿进行物相组成分析,如图3所示。A:原料磷尾矿的X射线衍射图谱;B: CaMg(CO3)2的PDF标准卡片衍射峰图谱;C:Ca5(PO4)3F的PDF标准卡片衍射峰图谱。
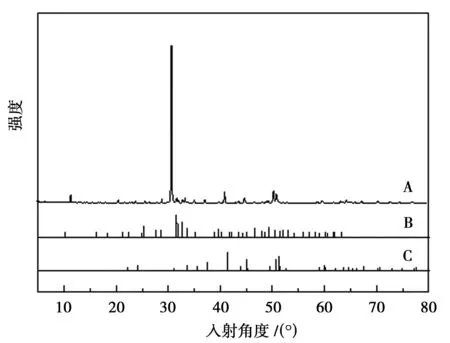
图3 原料磷尾矿的X射线粉末衍射图
从图3可以确定,磷尾矿主要由2种物质组成,经Jade软件分析,主要是由白云石CaMg(CO3)2以及少量的磷灰石Ca10F2(PO4)6组成,并存有少量的黄铁矿、石英和菱铁矿。
2.3 净化除杂过程结果与讨论
2.3.1 调整剂加入量对滤液中Fe2+浓度影响
每次量取50 mL酸解滤液,向搅拌的滤液中加入一定量的TOEN,持续搅拌45 min,过滤,测滤液中剩余Fe2+的浓度,具体结果如图4所示。
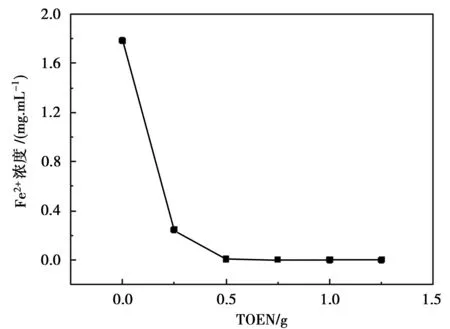
图4 TOEN加入量对滤液剩余Fe2+浓度的影响
从图4中的数据可知,在50 mL 的酸解滤液中加入0.75 g的TOEN时,滤液中二价铁离子溶度由1.785 mg·mL-1下降为0.002 4 mg·mL-1,效果较好,若继续加大调整剂的用量,滤液中二价铁离子的含量变化不大,故选择调整剂TOEN量为0.75 g。
2.3.2 不同pH值滤液中Fe2+、Fe3+和Al3+浓度
加0.75 g TOEN于50 mL酸解滤液内,向连续搅拌45 min的混合溶液中加入碱性缓冲溶液,使混合溶液的pH值分别达到3.0、4.0、5.0、6.0、7.0和8.0,持续搅拌15 min后,静止陈化30 min,抽滤,对滤液所含的Fe2+、Fe3+和Al3+进行浓度分析,具体结果如表3所示。

表3 不同pH值下滤液Fe2+、Fe3+和Al3+浓度 单位:10-4 mg·mL-1
注:Fe2+、Fe3+和Al3+的剩余浓度测定采用ICP-AES仪器。
由表3中可知,当氨水加至使混合溶液的pH值提高至7.0时,混合溶液中Fe3+浓度为0.000 0 mg·mL-1,Fe2+浓度为0.000 8 mg·mL-1,Al3+浓度为0.001 0 mg·mL-1。如向酸解液中继续加入氨水,促使Mg2+生成Mg(OH)2沉淀,造成镁的回收率下降,故碱性缓冲溶液的添加量为至体系pH值为7.0较适宜。
3 结 语
为综合利用高镁钙磷尾矿中的镁钙有价金属,以硝酸复合溶剂酸解磷尾矿,经除杂净化工序得到高纯镁钙源。实验主要探讨了除杂净化的调整剂用量及酸解溶液pH值变化对除杂效果的影响,得到以下结论:
(1)为完全将酸解液中各种金属离子分离,且尽量避免有价金属镁钙的损失,须将Fe2+氧化为Fe3+。因TOEN具有较强的氧化能力,且受热易分解,不会引入杂质离子,故选TOEN为调整剂;
(2)当调整剂加入量为0.75 g,此时溶液中Fe2+的浓度由1.785 mg·mL-1降为0.002 4 mg·mL-1,表明Fe2+基本转化为Fe3+;
(3)向加入调整剂后的溶液滴加碱性缓冲溶液至混合溶液pH值为7.0时,此时滤液中Fe3+的浓度为0.000 0 mg·mL-1,Fe2+的浓度为0.000 8 mg·mL-1,Al3+的浓度为0.001 0 mg·mL-1,达到理想的除杂效果,有利于后续产品的制备。

