双酶偶联催化马来酸生成L-天冬氨酸
余龙,陈寅,周丽,周哲敏
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
L-天冬氨酸(L-aspartic acid)是构成蛋白质的20种基础氨基酸之一,其在食品、医药、化工等领域都有着广泛的应用。在食品领域,L-天冬氨酸是多种食品和饮料的营养增补剂和酸味调节剂,还用于合成新型甜味剂阿斯巴甜[1]。在医药领域,L-天冬氨酸可用作氨解毒剂、肝功能促进剂和疲劳恢复剂等[2],且其还是L-丙氨酸的主要合成原料[3]和多种医药中间体。化工领域,L-天冬氨酸是合成高分子材料聚天冬氨酸的前体[4]。
L-天冬氨酸的生产始于20世纪60年代的日本田边制药公司[5],我国于80年代开始研制和生产。目前,工业生产L-天冬氨酸的工艺是以马来酸酐为原料,在无机催化剂、强酸性(pH=1左右)条件下转化成富马酸[6];分离纯化获得的富马酸与过量的氨在L-天冬氨酸裂解酶(L-aspartic acid amino lyase, AspA)催化下转化生成L-天冬氨酸铵[7],反应液用硫酸中和过量的氨后,分离纯化得到产品L-天冬氨酸[8]。此工艺虽然流程简单,但是其缺点明显:需要在高温、高压、过渡金属催化剂及强酸性条件下进行,对设备的要求严格,造成的环境污染严重,同时需要分离纯化中间产物富马酸,会造成产率的下降等。相比较而言,生物酶催化转化法具有专一性强,转化率高、工艺简洁、设备投资少及环境污染小等优点,因此生物酶催化转化法具有更好的应用前景。
近年来,有关生物酶催化转化的研究也越来越多,但大多都是以富马酸为底物酶法催化合成L-天冬氨酸[9-11],以马来酸为底物的研究较少。而马来酸相对于富马酸,价格更便宜,资源更丰富,也更容易获得,因此,以马来酸为底物生产L-天冬氨酸的研究势在必行。ABDULLAH等在2004年提出了两步生物法催化马来酸生产L-天冬氨酸[12],首先用马来酸顺反异构酶(maleatecis-transisomerase, MaiA)催化马来酸生成富马酸,然后用天冬氨酸裂解酶催化富马酸加氨生成L-天冬氨酸铵,再用浓硫酸中和过量的氨,获得L-天冬氨酸,该方法在一定程度上实现了节能减排,但是,需要对两种菌同时进行发酵培养,然后混合催化,操作较繁琐,生产成本较高;刘祥涛等在2017年提出了“一锅双酶”法制备L-天冬氨酸[13],首先在1株菌里共表达马来酸顺反异构酶和L-天冬氨酸裂解酶,然后全细胞催化马来酸加氨合成L-天冬氨酸铵,再用浓硫酸中和过量的氨,获得L-天冬氨酸,该方法极大简化了L-天冬氨酸生产工艺,但是,双酶共表达的极不平衡和目前报道的马来酸顺反异构酶[14-17]要么稳定性差,要么酶活低,要么表达量低等缺点,极大地限制了该方法在工业生产中的应用。
本研究建立1株马来酸顺反异构酶(maleatecis-transisomerase, MaiA)和L-天冬氨酸裂解酶(L-aspartic acid amino lyase, AspA)双酶偶联表达的重组大肠杆菌。此大肠杆菌已敲除染色体上的fumA和fumC两个基因[18],以减少副产物苹果酸的生成,提高L-天冬氨酸的得率。然后以全细胞去催化马来酸加氨生成L-天冬氨酸,此方法不用酶的分离纯化和中间产物富马酸的分离提纯,极大简化了L-天冬氨酸的生产工艺,而且酶在细胞内更加稳定。最后利用固定化细胞催化马来酸合成L-天冬氨酸,实现了细胞的回收重复利用,极大地降低了成本。
1 材料与方法
1.1 菌株、质粒与引物
菌株E.coliBL21 (DE3) ΔfumAC[18]、E.coliJM109、重组质粒pET-24a (+) -maiA[19]和pET-28a (+)-aspA[20]由本实验室构建和保藏。质粒pRSFDuet-1、pETDuet-1、pET-28a(+)由本实验室保藏。本研究用到的引物见表1,引物都由上海睿迪生物合成。

表1 本研究所用引物Table 1 Primers used in this study
注:表中带下划线的为酶切位点。
1.2 主要试剂与培养基
Prime Star DNA聚合酶、T4 DNA连接酶、QuickCutBamHI、QuickCutHindIII、QuickCutNdeI、QuickCutXhoI、DNA Marker、Protein Marker (Broad):宝生物工程(大连)公司;质粒提取试剂盒、纯化试剂盒、抗生素、IPTG、马来酸、富马酸、L-天冬氨酸:生工生物工程(上海)股份有限公司;衍生试剂苯异硫氰酸酯(PITC):西格玛公司。其他的分析试剂为国药试剂。
LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10。
2YT培养基(g/L):胰蛋白胨16,酵母粉10,NaCl 5。
1.3 主要仪器
PCR仪、凝胶成像仪、蛋白电泳仪,BIO-RAD公司;UV-1800PC型紫外可见分光光度计,上海美谱达有限公司;pH计,梅特勒-托利多仪器(上海)有限公司;高效液相色谱仪,日立(HITACHI)公司;Prevail Organic Acid 色谱柱 (250×4.6 mm, 5 μm)、C18色谱柱La Chrom C18(250×4.6 mm, 5 μm)。
1.4 MaiA与AspA双酶偶联表达体系构建
采用单质粒单启动子、单质粒双启动子和双质粒3种方式实现MaiA与AspA的共表达,每种方法又分为MaiA-AspA和AspA-MaiA两种串联顺序,如图1所示。共产生pET-28a (+)-maiA-aspA、pET-28a (+)-aspA-maiA、pRSFDuet-1-maiA-aspA、pRSFDuet-1-aspA-maiA、pRSFDuet-1-maiA-pETDuet-1-aspA、pRSFDuet-1-aspA-pETDuet-1-maiA六种形式,依次记为pMA 1、pAM 1、pMA 2、pAM 2、pMA 3、pAM 3。
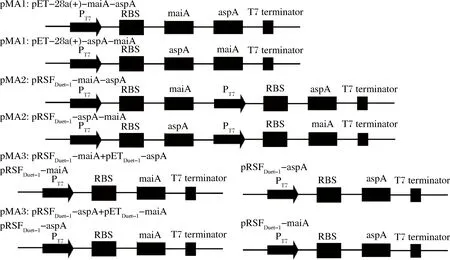
图1 MaiA与AspA共表达策略Fig.1 The strategy of co-expression of MaiA and AspA
1.5 重组质粒的构建
以pET-24a (+)-maiA为模板,分别以表1中的引物P1+P2、P3+P4和P5+P4为引物PCR,以pET-28a (+)-aspA为模板,分别以表1中的引物P6+P7、P8+P9和P10+P9为引物PCR,PCR产物经对应的酶双酶切并切胶回收,获得带不同黏性末端的maiA和aspA基因片段,分别记为M1、M2、M3和A1、A2、A3。
将质粒pRSFDuet-1、pETDuet-1、pET-28a(+)经BamHI-HindIII双酶切并切胶回收,获得带BamHI-HindIII黏性末端的不同质粒载体片段,分别记为p1、p2、p3。用核酸定量仪测定回收的片段的浓度,然后以基因片段(M1、A1)比载体片段(p1、p2、p3)为3∶1的浓度比例混合,T4连接酶16℃过夜连接,连接产物转化到E.coliJM109感受态细胞里,挑选阳性转化子进行菌落PCR验证、酶切验证和DNA测序验证,获得正确的重组质粒pRSFDuet-1-maiA、pRSFDuet-1-aspA、pETDuet-1-maiA、pETDuet-1-aspA、pET-28a(+)-maiA和pET-28a(+)-aspA。
然后再将重组质粒pRSFDuet-1-maiA和pRSFDuet-1-aspA经NdeI-XhoI双酶切并切胶回收,分别获得带NdeI-XhoI黏性末端的不同质粒载体片段,记为pM1和pA1;pET-28a(+)-maiA和pET-28a(+)-aspA经HindIII-XhoI双酶切并切胶回收,分别获得带HindIII-XhoI粘性末端的不同质粒载体片段,记为pM2和pA2;然后按上面的连接、转化和验证方法,获得正确的重组质粒pRSFDuet-1-aspA-maiA、pRSFDuet-1-maiA-aspA、pET-28a (+) -aspA-maiA和pET-28a (+)-maiA-aspA。
然后将正确的重组质粒转化到E.coliBL21 (DE3) ΔfumAC感受态细胞中,得到重组工程菌pMA 1、pAM 1、pMA 2、pAM 2、pMA 3、pAM 3。
1.6 重组菌的诱导表达及最优菌株筛选
-80 ℃冰箱保存的重组菌株在LB固体平板上划线活化,挑取单菌落接种至5 mL的LB 培养基中,pMA 1、pAM 1、pMA 2、pAM 2的LB培养基中含50 μg/mL卡那霉素,pMA 3、pAM 3的LB培养基中含50 μg/mL卡那霉素和50 μg/mL氨苄霉素,37 ℃、200 r/min振荡培养8 h,然后以1%的接种量转接入50 mL的2YT摇瓶发酵培养基中,抗性同上,于37 ℃、200 r/min培养至OD600约为0.8时,加入终浓度为0.2 mmol/L的IPTG诱导,同时温度调到20 ℃诱导培养20 h。
各取相同量的诱导表达细胞,离心收集菌体,再用pH 8.0的50 mmol/L的Na2HPO4-KH2PO4缓冲液重悬细胞,超声破碎得到粗酶液。SDS-PAGE电泳分析目的蛋白的表达情况;然后各取100 μL粗酶液,加入到50 μL 2 mol/L的pH 8.0的马来酸铵溶液中,用缓冲液补充体系到500 μL,在40 ℃反应10 min,然后再于100 ℃煮沸10 min,离心取上清,检测上清中马来酸、富马酸和L-天冬氨酸的含量。
1.7 马来酸、富马酸和L-天冬氨酸的检测
马来酸、富马酸和L-天冬氨酸的浓度都用高效液相色谱(HPLC)法检测。
马来酸、富马酸的HPLC 检测条件[19]:色谱柱 Prevail Organic Acid(250 mm×4.6 mm, 5 μm),流动相为pH 2.5、浓度25 mmol/L的KH2PO4溶液,流速1 mL/min,柱温40 ℃,紫外检测器波长210 nm,进样量10 μL。
L-天冬氨酸的检测要先经过苯基异硫酸酯(PITC)进行衍生,在其氨基端连接1个苯环,便于分离。衍生方法为[21]:取500 μL反应液,加入250 μL 1 mol/L的三乙胺-乙腈溶液和250 μL 0.1 mol/L的PITC-乙腈溶液,振荡混匀,避光反应1 h。待衍生结束后,700 μL正己烷,振荡30 s萃取出残余的衍生试剂,静置,待反应液有明显分层后吸取下层溶液,用0.22 μm针头式有机滤膜过滤。HPLC 检测条件[21]:色谱柱La Chrom C18(4.6mm×250 mm, 5 μm),用梯度洗脱的方法进行检测。A流动相为80%的乙腈溶液,B流动相为97:3的0.1 mol/L乙酸钠-乙腈溶液;梯度洗脱条件为:0~35 min,B流动相由95%降至65%;35~40 min,B流动相由65%升至95%;40~45 min,B流动相浓度不变。检测温度为40 ℃,检测波长为254 nm。
1.8 全细胞催化及细胞的重复利用
收集诱导表达的细胞,用pH 8.0的50 mmol/L的Na2HPO4-KH2PO4缓冲液重悬细胞,稀释到OD600值到40,然后按20%的静息细胞悬浮液和80%的底物马来酸溶液混合,反应体系为30 mL,在200 r/min、37 ℃的摇床中催化反应,每隔20 min取样检测反应液中马来酸、富马酸和天冬氨酸的量。待底物完全转化为产物后,离心收集细胞,然后加6 mL的缓冲液重悬,再加入24 mL底物继续按之前的条件全细胞催化。
1.9 细胞固定化
细胞固定化方法[22]:离心收集菌体,将1 g的湿细胞重悬于5 mL的生理盐水,然后加入0.1 g的活性炭粉末[m(活性炭)∶m(湿细胞)=1∶10]于4 ℃吸附4 h;将上面的菌体悬浮液加入到15 mL的海藻酸钠和聚乙烯醇的混合溶液中充分混匀,使得海藻酸钠的终浓度是2%,聚乙烯醇的终浓度为6%;将上面的混合溶液滴到固定化剂(饱和硼酸与3%的氯化钙混合溶液)中,室温放置6 h使其硬化;用生理盐水清洗3次固定好的细胞颗粒,然后用固定好的细胞颗粒催化4 mol/L的底物马来酸并回收重复利用,催化等量底物相同时间,检测反应液中马来酸、富马酸和L-天冬氨酸铵的量,计算酶活(酶活定义:在37 ℃、pH 8.0条件下,单位时间催化转化生成1μmol的L-天冬氨酸所需的酶量定义为1个酶活单位U)和酶活回收率(酶活回收率=固定化细胞酶活/游离细胞第1次反应酶活)。
2 结果与分析
2.1 MaiA与AspA双酶偶联表达体系构建
将重组质粒pRSFDuet-1-maiA、pRSFDuet-1-aspA、pETDuet-1-maiA、pETDuet-1-aspA、pET-28a(+)-maiA和pET-28a(+)-aspA经BamHI-HindIII双酶切,然后经0.8%的琼脂糖凝胶电泳验证,目的条带的大小都与理论值大小相符,电泳结果如图2-a。

M-DNA marker; 1-double digestion of pRSFDuet-1-maiA; 2-double digestion of pRSFDuet-1-aspA; 3-double digestion of pETDuet-1-maiA; 4-double digestion of pETDuet-1-aspA; 5-double digestion of pET-28a(+)-maiA; 6-double digestion of pET-28a(+)-aspA; 7-double digestion of pRSFDuet-1-aspA-maiA; 8-double digestion of pRSFDuet-1-maiA-aspA; 9-double digestion of pET-28a(+)-maiA-aspA; 10-double di-gestion of pET-28a(+)-aspA-maiA图2 PCR扩增maiA和aspA基因及重组质粒的酶切验证Fig.2 PCR amplification of maiA and aspA gene and restriction of recombinant plasmid
将重组质粒pRSFDuet-1-aspA-maiA、pRSFDuet-1-maiA-aspA经NdeI-XhoI双酶切;pET-28a (+)-aspA-maiA和pET-28a (+) -maiA-aspA经HindIII-XhoI双酶切,然后经0.8%的琼脂糖凝胶电泳验证,目的条带的大小都与理论值大小相符,电泳结果如图2-b。
2.2 MaiA与AspA双酶共表达效果及酶活比较
用SDS-PAGE电泳比较6种重组菌双酶共表达的效果,其表达上清结果如图 3。当MaiA和AspA分别单独表达时,其表达量都比较高,而当其串联表达时,其表达量都有相应的降低,而且不同的串联方式,2个酶的表达水平相差也较大。期中pMA1和pAM1的串联体系的2个酶的表达量都较低;pMA2的串联体系的MaiA表达较高,而AspA的表达较低;pAM 2的串联体系的2个酶几乎都没有表达;pMA3和pAM3的串联体系的AspA的表达较好,而MaiA的表达较低。这些不同的串联体系的表达差异,可能与2个基因转录的mRNA的稳定性有关[23-24]。
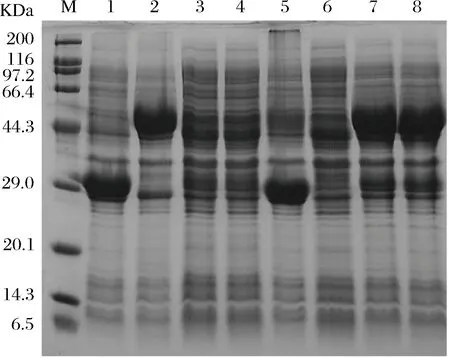
M-protein marker; 1-MaiA expression; 2-AspA expression; 3-pMA 1; 4-pAM 1; 5-pMA 2; 6-pAM 2; 7-pMA 3; 8-pAM 3图3 MaiA与AspA双酶共表达Fig.3 SDS-PAGE of MaiA and AspA co-expression
粗酶液催化反应比较6种重组菌的催化效率,结果如表2。pMA2的串联体系的催化生成L-天冬氨酸的效果最佳,这是因为AspA的酶活[25]显著高于MaiA的酶活[19],故此催化体系的限速因素是MaiA的总酶活,因此当MaiA的表达量越高时,MaiA的总酶活就越高,催化效果就越好。
综合6种重组菌的双酶共表达效果及其粗酶液的催化效率,重组工程菌pMA2催化生产L-天冬氨酸的效果最好,更适合以后以马来酸为底物工业化生产L-天冬氨酸。因此下面就以重组工程菌pMA2为基础进行全细胞催化工艺的研究。
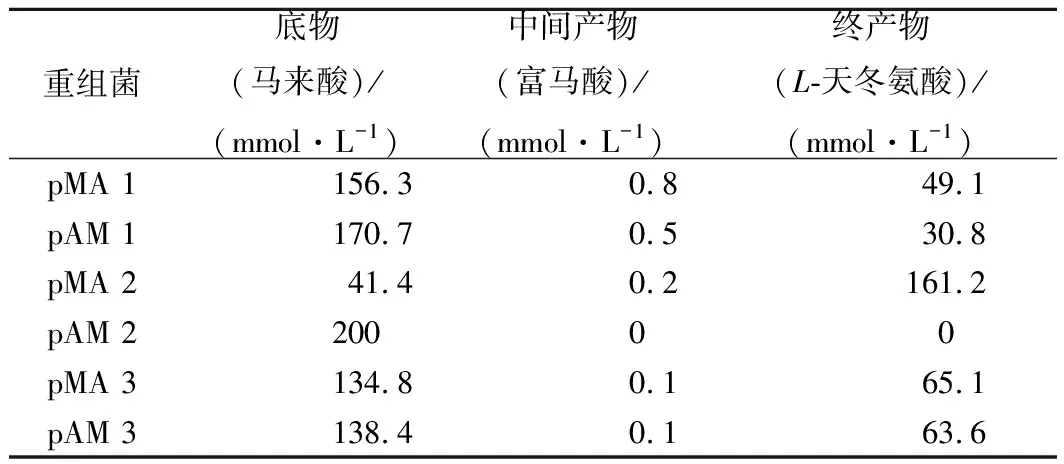
表2 重组菌粗酶催化200 mmol/L的马来酸比较Table 2 Comparison of crude enzyme catalysis of 200 mmol/L maleic acid
2.3 全细胞催化及细胞的回收利用
以pMA2全细胞催化1.6 mol/L的马来酸,结果如图4-a。1.6 mol/L的马来酸在120 min就完全转化为L-天冬氨酸铵,浓度达到1.57 mol/L,中间产物富马酸几乎没有积累,转化率达到98%以上。而在实际的工业生产中,如果产物浓度越高,下游的分离纯化就越容易,因此又对底物的浓度进行了优化。分别用2.4 mol/L和3.2 mol/L的底物马来酸进行全细胞催化,催化结果如图4-b和图4-c,底物分别在250 min和390 min转化完全,且中间产物几乎都没有积累,转化率都在98%以上。随着底物浓度的增加,反应速率有一定的下降,说明高浓度的底物或产物对反应有一定的抑制作用,但是抑制作用并不明显,转化率也没有下降,因此并不影响工业的应用。

a-1.6 mol/L马来酸; b-2.4 mol/L马来酸; c-3.2 mol/L马来酸图4 不同马来酸浓度下全细胞催化转化生产L-天冬氨酸Fig.4 The production of L-aspartic acid whole-cell biocatalysis in different concentration of maleic acid
当底物浓度达到3.2 mol/L时,反应液黏度大大增加,在离心回收细胞时,有些细胞沉淀不下来,给细胞的回收利用带来一定的困难。回收利用1次,催化相同底物反应相同时间,L-天冬氨酸生成量降低为2.1 mol/L,酶活回收率仅为65.6%,如表3。这在实际应用中造成较大的浪费,接下来对细胞进行固定化研究,以解决细胞回收利用问题。
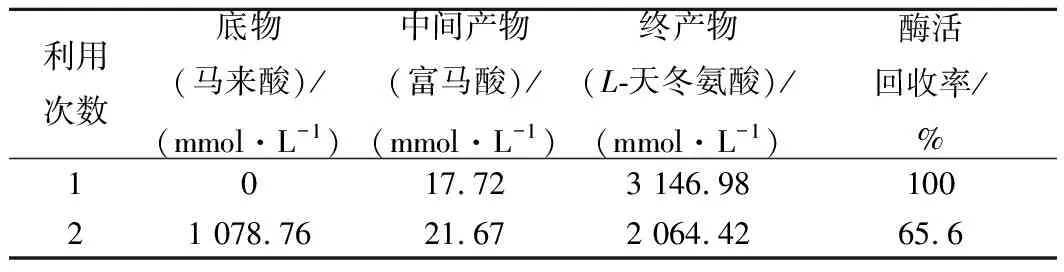
表3 游离细胞回收利用Table 3 Recycling of the free cells
2.4 细胞固定化
对重组工程菌pMA2进行细胞固定化,固定化细胞第1次催化反应的酶活回收率为90.4%,然后回收重复利用固定化细胞,以固定化细胞第1次催化反应的酶活记为100%,计算每次回收重复利用的相对酶活,结果如图5。前4次回收利用,其酶活回收率逐渐增加,可能的原因是随着回收利用次数的增加,固定化细胞颗粒的通透性增大,细胞与底物的接触更充分,故其酶活回收率逐渐增加;回收利用4次之后,其酶活回收率又逐渐下降,可能原因是随着回收利用次数的进一步增加,固定化细胞颗粒逐渐相互黏成一团,降低了固定化细胞颗粒与底物的接触面积,而且也可能有部分细胞从固定化载体上脱落,或者是酶有部分失活,故其酶活回收率又逐渐下降。最终重复利用8次之后,其相对酶活还剩下81%,显著提高了细胞的利用率,降低了生产成本,为今后工业化生产奠定了基础。
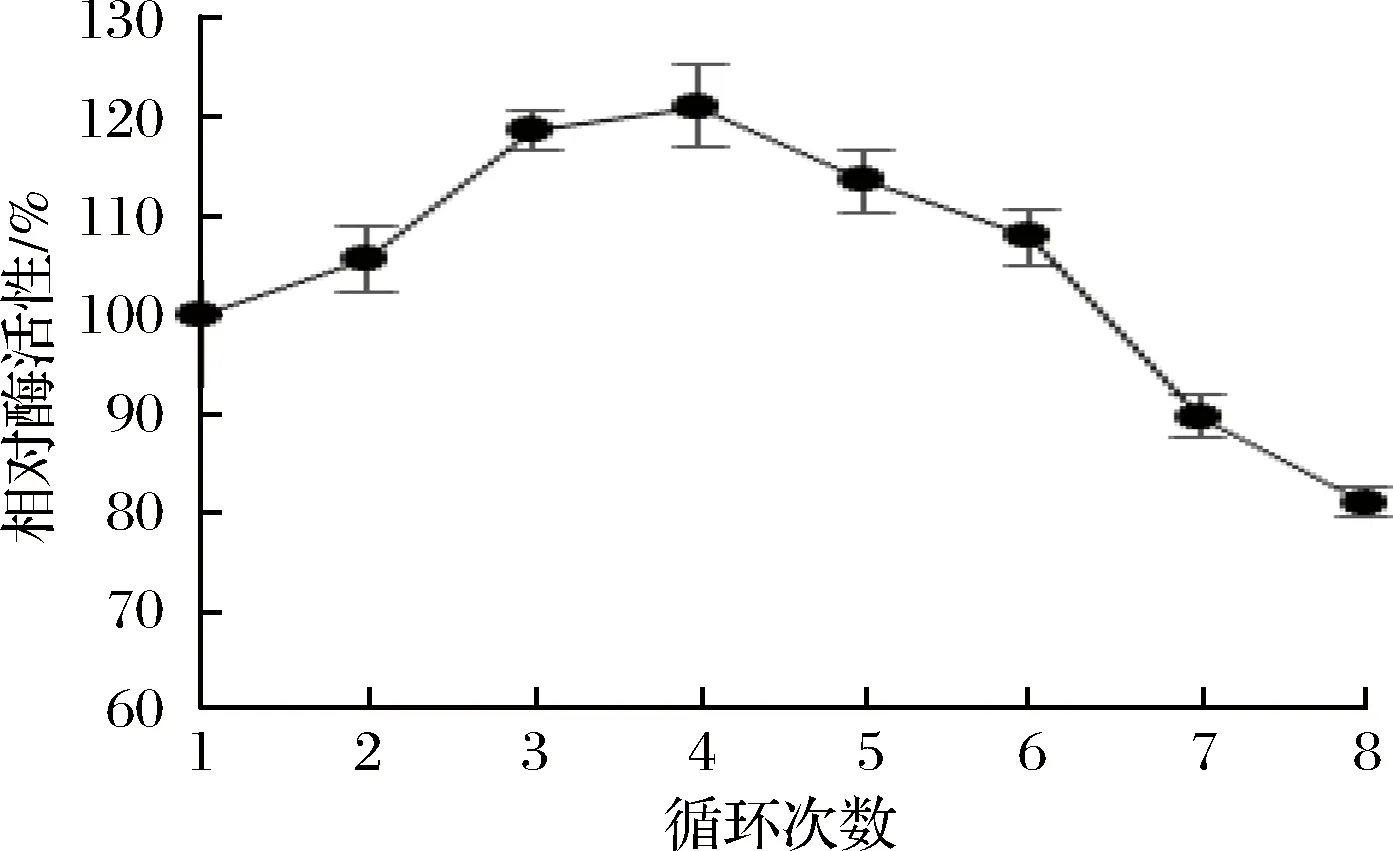
图5 固定化细胞回收利用Fig.5 Recycling of the immobilized cells
3 结论
本研究构建了6种不同的MaiA与AspA双酶偶联表达体系,通过比较6株重组菌的共表达效果和催化效率,获得最佳的偶联体系pRSFDuet-1-maiA-aspA。然后以最佳的重组工程菌pMA2全细胞催化马来酸铵,并做底物的优化,最终L-天冬氨酸的浓度达到3.14 mol/L,中间产物富马酸几乎没有积累,转化率达到98%以上。与化学合成法相比,不仅极大简化了生产工艺,而且转化率也有一定提高(化学合成法转化率最高的是FUJII等的86%);与刘祥涛等的“一锅双酶”法[13]相比(其1 L的高密度发酵液所含重组菌按投料比1∶4,即1 L发酵液与4 L马来酸混合,催化转化1.5 mol/L的底物马来酸需要24 h,转化率为98.8%),本研究的最佳重组菌pMA 2的酶活更高,催化更高效,生成的产物浓度更高,更有利于下游产物的分离纯化。最后对重组工程菌pMA 2进行细胞固定化,回收利用8次之后,其相对酶活还剩下81%,显著提高了细胞的利用率,降低了生产成本,为今后的生物酶催化转化法工业化生产L-天冬氨酸奠定了基础。

