基于气相色谱-质谱联用技术结合电子鼻评价浸米时间对黄酒风味品质的影响
杨成聪,刘丹丹,葛东颖,石星星,王强,郭壮
(湖北文理学院 食品科学技术学院,鄂西北传统发酵食品研究所,湖北 襄阳,441053)
作为黄酒生产的前端工艺,浸米对黄酒品质具有直接的影响[1]。浸泡可使糯米中的淀粉充分吸水,进而有利于糯米后续的蒸煮[2]。此外,产乳酸细菌可利用糯米的水溶性营养物质大量繁殖,在降低前酵醪pH值的同时抑制了杂菌的生长,进而保障了黄酒发酵的顺利进行[3]。黄酒浸米水中的细菌主要为植物乳杆菌和短乳杆菌[4]。有研究表明,采用米浆水替代部分投料用水可明显抑制其他产酸细菌的代谢活动[5],进而赋予酒体更协调的风味[6]。浸米时间通常为5~20 d,时间过短,糯米不能充分吸水且不能使浆水达到一定酸度,从而不利于黄酒挥发性风味物质的形成;若时间过长,总糖、还原糖、粗脂肪和粗蛋白等主要组分流失严重,亦不利于黄酒挥发性风味物质的形成[7],因而研究浸米时间对黄酒风味品质的影响就显得尤为重要。
研究人员常使用气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS)和电子鼻对食品的风味进行评价。GC-MS可同时获得食品中挥发性风味物质保留时间与分子结构两方面信息,在白酒[8]、红酒[9]和酸奶[10]等发酵食品中已有广泛应用。通过模拟人体嗅觉系统,电子鼻传感器阵列实现了不同种类化学物质的快速无损检测,在酒龄辨别[11]、品牌区分[12]和风味分析[13]中亦有着广泛的应用,具有检测结果客观性强且受主观因素影响小的优点。
本研究采用GC-MS和电子鼻联用技术对不同浸泡时间糯米酿造黄酒中挥发性风味物质的种类及含量进行了分析,同时结合多元统计学方法探讨了浸米时间对黄酒风味品质的影响,以期为后续黄酒品质的提升和工艺的改良提供参考。
1 材料与方法
1.1 材料与仪器
糯米:市售;生麦曲:购于浙江省丽水市;黄酒专用酿酒高活性干酵母:安琪酵母股份有限公司;NaCl:西陇科学股份有限公司。
PEN3电子鼻,配备10 个金属氧化传感器,德国Airsense公司;GCMS-QP2020气相色谱质谱联用仪,配有电子轰击电离源EI,日本岛津公司;SH-Rtx-Wax(30 m×2.25 mm×0.25 μm)色谱柱,日本岛津公司;HMT-100蒸饭柜,广东乐创电器有限公司;LRH-250F生化培养箱,上海一恒科技有限公司。
1.2 试验方法
1.2.1 样品制作
分别称取700 g糯米洗净后于20~22 ℃浸泡1、3、5、7、9、11、13、15和17 d,蒸煮30 min,采用摊饭法冷却至37 ℃,加入0.7 g酒曲、110 g生麦曲、410 mL糯米浸泡液和550 mL清水搅拌均匀后置于28 ℃生化培养箱培养14 d,后置于18 ℃培养7 d,取上清液制成供试样液[14]。
1.2.2 基于GC-MS技术黄酒中挥发性风味物质的测定
(1)样品处理。取黄酒样品9 mL于20 mL样品瓶,加入3 g NaCl,采用带有聚四氟乙烯的铝帽夹紧封口60 ℃搅拌预热15 min,平衡15 min,进样量1 μL,进样口解析5 min后进入GC-MS 分析[19]。
(2)GC条件。色谱柱:SH-Rtx-Wax,30 m×2.25 mm×0.25 μm;进样口温度200 ℃;进样方式:分流进样;分流比为10:1;载气为高纯氦气(>99.999 9%)和高纯氮气(>99.999 9%);流速:1 mL/min;升温程序:起始温度30 ℃,保持3 min,以3 ℃/min升到45 ℃,保持10 min,然后以8 ℃/min升到130 ℃,不保持,然后以10 ℃/min升到200 ℃保持7 min。
(3)MS 条件。离子源:EI源;离子源温度:230 ℃;连接口温度:280 ℃;电子轰击能量70 eV;m/z范围:33.00~450 amu;采集方式:Q3 Scan。
(4)定性分析。NIST14标准质谱库定性;保留指数定性。
(5)定量分析。利用峰面积对样品中主要组分进行相对含量分析。
1.2.3 基于电子鼻技术测定黄酒中挥发性风味物质
取黄酒样品10 mL,稀释2倍后置于120 mL样品瓶中使用电子鼻进行气味检测。检测器由10 个金属氧化传感器组成,分别对不同类型挥发性风味物质进行测定。测定前传感器进行95 s自动清洁,样品测试时间为60 s,每间隔1 s测定一个响应值。响应值为传感器测试样品时的电阻G和测试空气的电阻GO的比值,比值与1的偏离度越大,说明与之相对应的挥发性风味物质的浓度越大。电子鼻化学传感器及其对应的敏感物质类型如表1所示[15]。
1.2.4 统计学分析
使用聚类分析(cluster analysis,CA)和主成分分析(principal component analysis,PCA)对不同浸米时间黄酒风味整体结构的差异性进行分析;使用曼-惠特尼检验(mann-whiney test)和冗余分析(redundancy analysis,RDA)对与浸米时间显著相关挥发性风味物质进行甄别。使用Canoco 4.5软件做RDA,其他分析使用Matlab 2010软件;使用Matlab 2010软件绘制热图,其他图使用origin 8.5绘制。
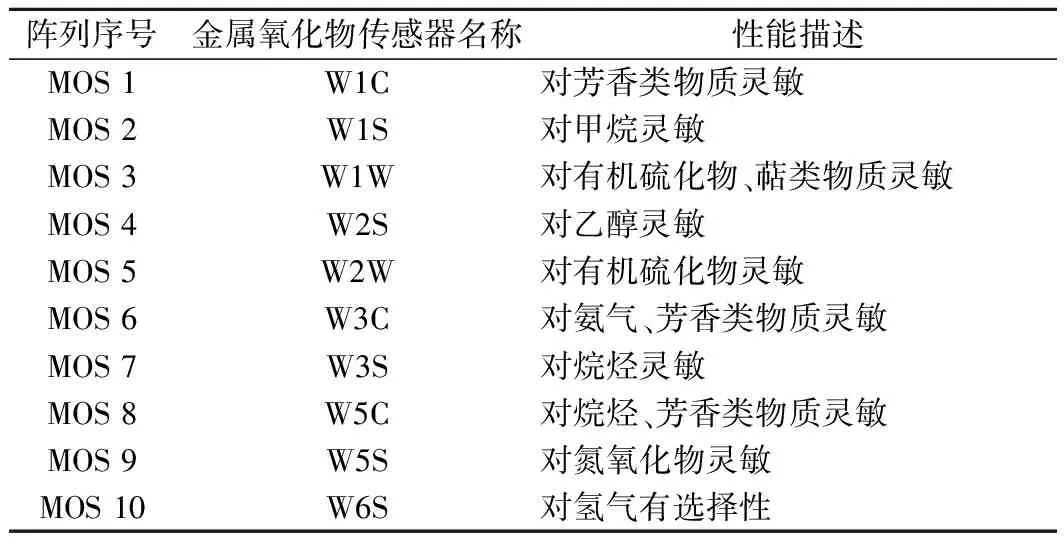
表1 化学传感器及其对应的敏感物质类型Table 1 Chemical sensors and their corresponding sensitive material types
2 结果与分析
2.1 基于GC-MS技术浸米时间对黄酒挥发性风味物质的影响
该文首先利用GC-MS技术对黄酒样品中挥发性风味物质进行了定性和相对定量分析,结果见表2。
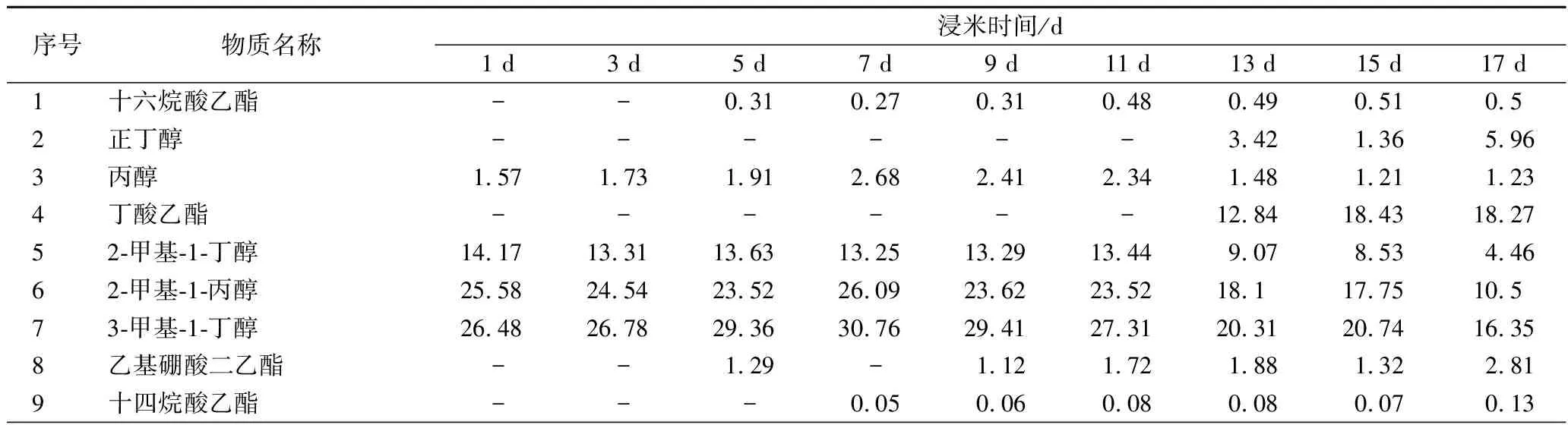
表2 不同浸米时间黄酒挥发性组分及相对含量分析 单位:%Table 2 The relative abundance of volatile components of Chinese rice wine fermented by glutinous rice soaked at different times
续表2
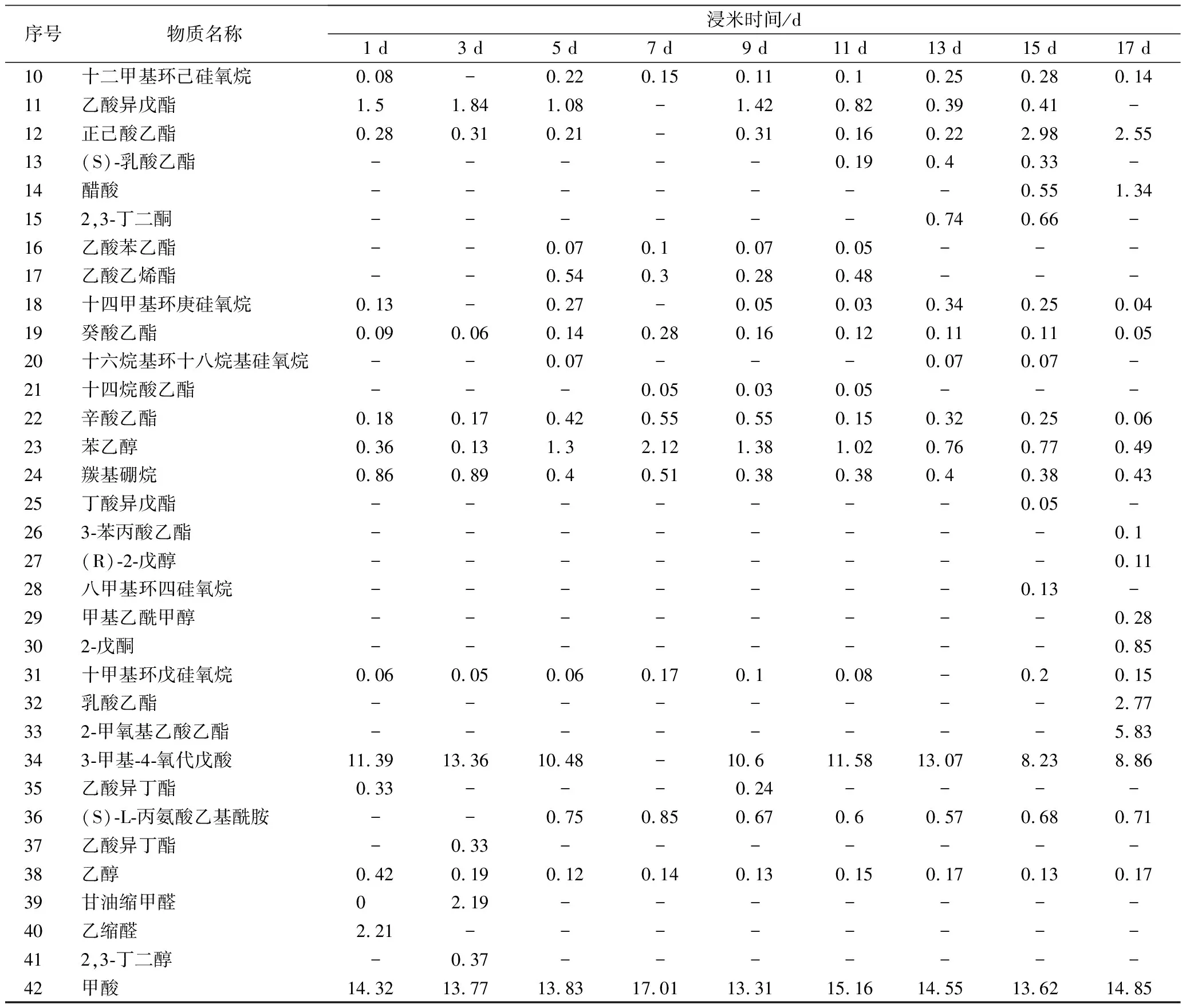
序号物质名称浸米时间/d1 d3 d5 d7 d9 d11 d13 d15 d17 d10十二甲基环己硅氧烷0.08-0.220.150.110.10.250.280.1411乙酸异戊酯1.51.841.08-1.420.820.390.41-12正己酸乙酯0.280.310.21-0.310.160.222.982.5513(S)-乳酸乙酯-----0.190.40.33-14醋酸-------0.551.34152,3-丁二酮------0.740.66-16乙酸苯乙酯--0.070.10.070.05---17乙酸乙烯酯--0.540.30.280.48---18十四甲基环庚硅氧烷0.13-0.27-0.050.030.340.250.0419癸酸乙酯0.090.060.140.280.160.120.110.110.0520十六烷基环十八烷基硅氧烷--0.07---0.070.07-21十四烷酸乙酯---0.050.030.05---22辛酸乙酯0.180.170.420.550.550.150.320.250.0623苯乙醇0.360.131.32.121.381.020.760.770.4924羰基硼烷0.860.890.40.510.380.380.40.380.4325丁酸异戊酯-------0.05-263-苯丙酸乙酯--------0.127(R)-2-戊醇--------0.1128八甲基环四硅氧烷-------0.13-29甲基乙酰甲醇--------0.28302-戊酮--------0.8531十甲基环戊硅氧烷0.060.050.060.170.10.08-0.20.1532乳酸乙酯--------2.77332-甲氧基乙酸乙酯--------5.83343-甲基-4-氧代戊酸11.3913.3610.48-10.611.5813.078.238.8635乙酸异丁酯0.33---0.24----36(S)-L-丙氨酸乙基酰胺--0.750.850.670.60.570.680.7137乙酸异丁酯-0.33-------38乙醇0.420.190.120.140.130.150.170.130.1739甘油缩甲醛02.19-------40乙缩醛2.21--------412,3-丁二醇-0.37-------42甲酸14.3213.7713.8317.0113.3115.1614.5513.6214.85
注:“-”表示未检出。
由表2可知,9个黄酒样品中共检测到42 种挥发性风味物质,其中酯类化合物18 种、醇类化合物10 种、烷烃类化合物6 种、酸类化合物3 种、酮类化合物2 种、醛类化合物2 种和胺类化合物1 种。其中,醇类和酯类化合物为黄酒中主要挥发性风味物质,其平均相对含量分别为62.67%和10.00%。王旭等人研究结果与本研究相同[16],其采用GC-MS技术对不同酒龄黄酒中关键挥发性风味物质进行了研究,结果发现酯类和醇类为金色年华黄酒中主要风味物质。通过对不同品牌黄酒挥发性风味物质进行分析,LUO[17]和CAO[18]亦证实醇类和酯类在黄酒挥发性风味物质的种类和含量上均占优势。值得一提的是,在浸米时间超过11 d糯米酿造的黄酒中均检测到了正丁醇和丁酸乙酯,而乙酸苯乙酯、乙酸乙烯酯和十四烷酸乙酯只能在浸米时间≤11 d糯米酿造的黄酒中检测到。
2.2 与浸米时间显著相关黄酒挥发性风味物质的甄别
在对黄酒挥发性风味物质相对含量解析的基础上,本研究进一步对不同浸米时间糯米酿造黄酒进行了非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类分析,结果如图1所示。
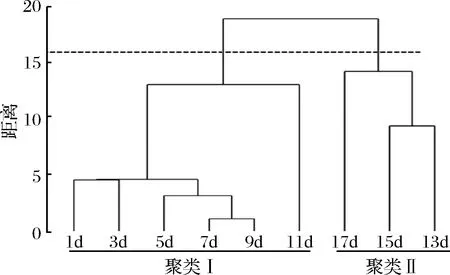
图1 基于聚类分析的浸米时间对黄酒风味品质的影响Fig.1 Effect of soak time of glutinous rice on the flavor quality of Chinese rice wine based on cluster analysis
由图1可知,黄酒样品整体上可划分为两个聚类,其中聚类I由浸泡1、3、5、7、9和11 d糯米酿造的黄酒构成,而聚类Ⅱ由13、15和17 d样品构成。由此可见,当浸米时间达到11 d以上时黄酒的风味可能会发生明显的变化。本研究进一步采用Mann-Whiney分析,对隶属于两个聚类黄酒的醇类、酸类、酮类、烷烃类和酯类化合物相对含量进行了分析,其结果如图2所示。
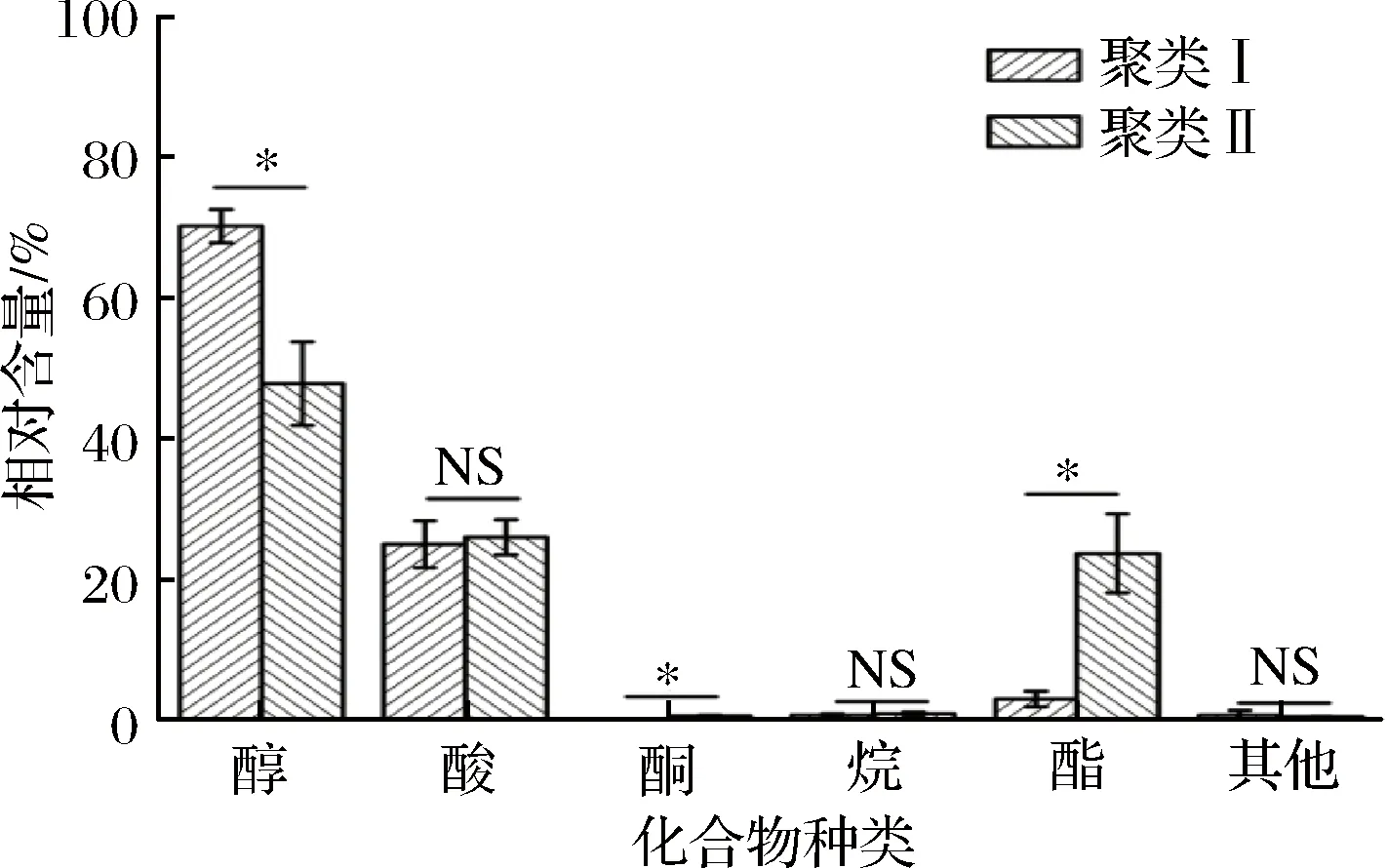
图2 隶属于聚类I和聚类II黄酒样品挥发性成分的比较分析Fig.2 Comparative analysis of volatile components of Chinese rice wine samples belong to cluster I and II(注:NS,差异不显著;*,p<0.05。)
由图2可知,隶属于聚类I的黄酒样品其醇、酸和酯类化合物的相对含量分别为69.79%、24.14%和3.27%,而在聚类II中分别为47.78%、25.02%和24.75%。由图2亦可知,浸米时间达到13 d时黄酒挥发性风味物质中醇类的相对含量显著下降(p<0.05),而酯类含量显著升高(p<0.05)。究其原因可能在于,随着浸米时间的延长,黄酒中的醇类物质被氧化为酸,而醇与酸又进一步发生了酯化反应[19]。本研究进一步以聚类I/聚类II为分组依据,采用RDA对与浸米时间显著相关的黄酒挥发性风味物质进行了甄别,结果如图3所示。
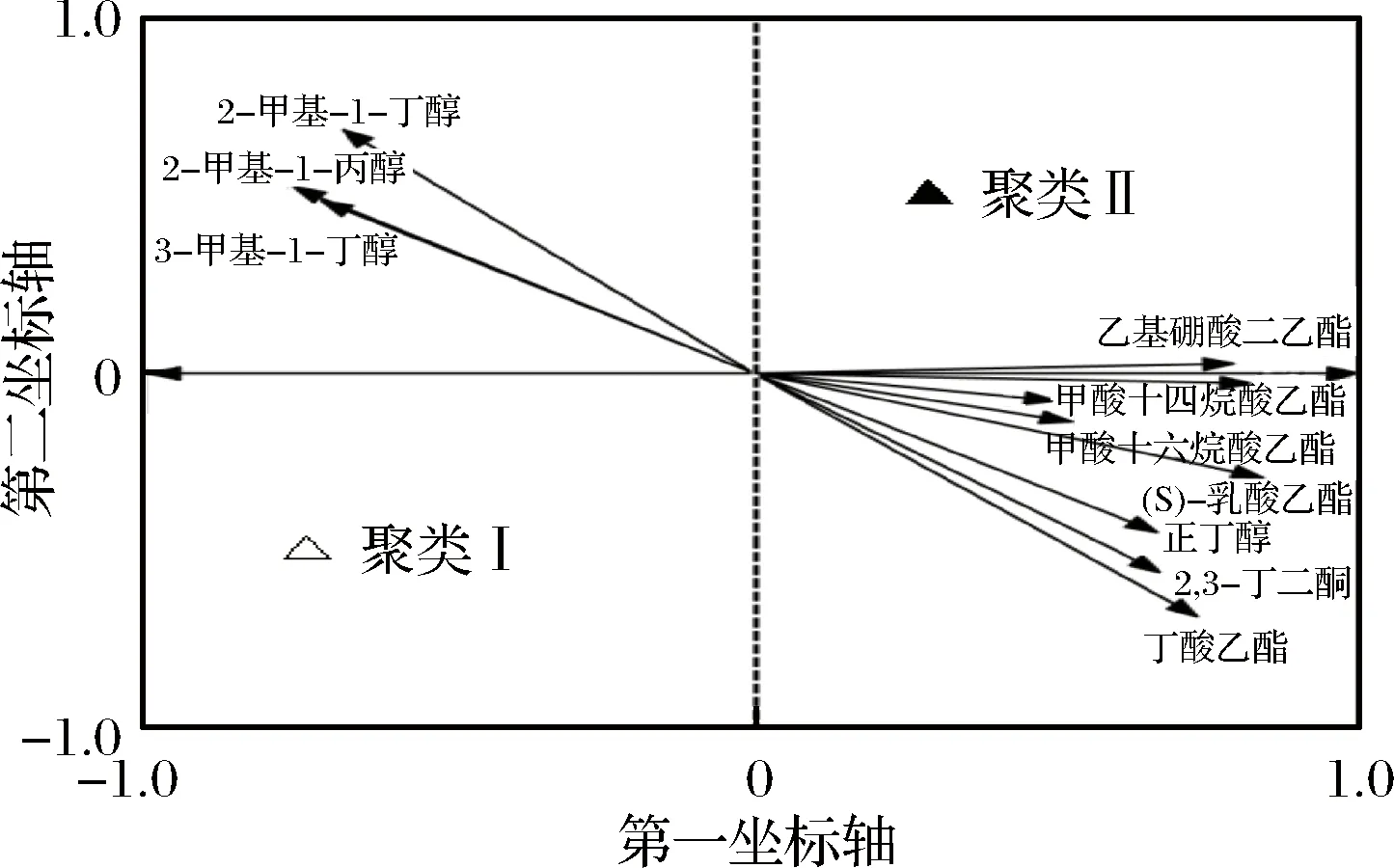
图3 RDA双序图Fig.3 biplot of the RDA
由图3可知,2-甲基-1-丁醇、2-甲基-1-丙醇、3-甲基-1-丁醇、乙基硼酸二乙酯、十四烷酸乙酯、十六烷酸乙酯、甲酸、(S)-乳酸乙酯、正丁醇、2,3-丁二酮和丁酸乙酯等11 种物质与RDA排序图约束轴上的样品赋值良好相关,因而代表了与浸米时间显著相关的挥发性风味物质。其中2-甲基-1-丁醇、2-甲基-1-丙醇和3-甲基-1-丁醇在聚类I一侧,说明这3 种物质在浸泡1~11 d糯米酿造的黄酒中相对含量较高,而其他8 种挥发性风味物质呈现出相反的趋势。经Mann-Whiney发现,十六烷酸乙酯、乙基硼酸二乙酯和丁酸乙酯3 种酯及2-甲基-1-丁醇、2-甲基-1-丙醇、3-甲基-1-丁醇和正丁醇4 种醇在两类黄酒中差异显著(p<0.05)。浸米时间对上述7 种挥发性风味物质相对含量的影响如图4所示。

图4 浸米时间对挥发性风味物质相对含量的影响Fig.4 Effect of soak time of glutinous rice on the relative abundance of volatile flavor in Chinese rice wine
由图4可知,随着浸米时间的增加黄酒中2-甲基-1-丙醇、3-甲基-1-丁醇和2-甲基-1-丁醇在13 d时呈现明显的下降趋势,乙基硼酸二乙酯、丁酸乙酯和正丁醇在浸米时间达到13 d时呈现明显的上升趋势。
2.3 基于电子鼻技术浸米时间对黄酒风味品质影响的评价
通过CC-MS法研究发现,当浸米时间达到11 d以上时黄酒的风味可能会发生明显的变化,本研究进一步采用电子鼻技术对该结论进行了验证。基于电子鼻技术不同浸米时间黄酒风味品质的PC1与PC2因子载荷图如图5所示。

图5 不同浸米时间黄酒风味品质的PC1与PC2因子载荷图Fig.5 Graphical representation of the PCA of Chinese rice wine samples fermented by glutinous rice soaked at different times showing PC1 vs.PC2: Factor loading
由图5可知,第一主成分(PC1)由W5C、W5S和W2W等3 个传感器检测的指标构成并占全部变量权重的88.73%,而第二主成分(PC2)主要是由W1C、W3C、W6S、W1W、W2S、W1S和W3S等7 个传感器检测的指标组成,占全部变量权重的9.17%。基于电子鼻技术不同浸米时间黄酒风味品质PC1和PC2的因子得分图见图6。
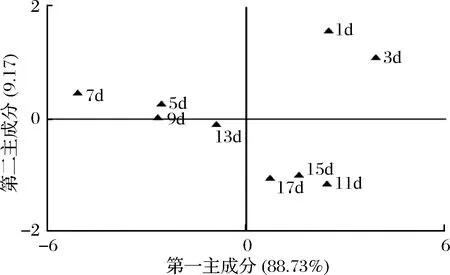
图6 不同浸米时间黄酒风味品质的PC1与PC2因子得分图Fig.6 Graphical representation of the PCA of Chinese rice wine samples fermented by glutinous rice soaked at different times showing PC1 vs.PC2 Factor scores
由图6可知,浸泡1、3、5、7、9 d糯米酿造的黄酒样品主要集中在X轴上方,而浸泡11、13、15和17 d糯米酿造的黄酒样品主要集中在X轴下方。由此可见,使用电子鼻检测的结果与GC-MS基本一致,即糯米浸泡时间达到11 d以上时会对黄酒的风味产生明显的影响。结合图5可知,随着浸米时间的延长,传感器W5C(对烷烃、芳香类物质灵敏)和W5S(对氮氧化物灵敏)的响应值呈下降趋势,而传感器W2W(对有机硫化物灵敏)响应值呈上升趋势。由此可见,当浸米时间达到11 d以上时,酿造黄酒中芳香类物质明显下降。综合GC-MS和电子鼻分析发现,浸米时间不应超过11 d,否则会对黄酒风味品质产生负面影响。通过以浸米浆水中总酸含量、乳酸含量及乳酸菌数为指标,姬中伟等认为浸米时间控制在8~12 d时所得浆水对黄酒发酵比较合适[20],其结论与本研究相符。
3 结论
本研究发现醇类和酯类化合物为黄酒中主要挥发性风味物质,且随着浸米时间的延长黄酒挥发性风味物质中醇类的相对含量显著下降,而酯类含量显著升高。当浸米时间达到11 d以上时,黄酒的风味会发生明显的变化,且芳香类物质明显下降。由此可见,以黄酒挥发性风味物质作为考察指标来反应浸米时间对黄酒品质的影响时,浸泡时间控制在11 d内,所得浆水对黄酒发酵比较有利。

