薏苡仁提取物对BALB/c小鼠特应性皮炎模型的疗效观察及机制探讨
王俊霞 杨子微 车雅敏 单士军 陈洪铎
300052天津医科大学总医院皮肤性病科(王俊霞、杨子微、车雅敏、单士军);中国医科大学附属第一医院皮肤性病科(陈洪铎)
特应性皮炎(AD)的发生与遗传、环境、免疫等因素密切相关[1]。薏苡仁是禾本科植物薏苡的种子[2],其活性成分主要为薏苡仁油、薏苡仁多糖、薏苡仁油多肽等,具有增强免疫力、抗炎、抗肿瘤等多种作用[3]。我们探讨薏苡仁提取物(theextraction of Semen Coicis,ESC)对AD模型小鼠的治疗效果,初步探讨其作用机制。
一、材料
1.动物:SPF级纯系健康BALB/c雌性小鼠40只,6~8周龄,体重20~ 22 g,动物合格证号SCXK(京)2014⁃0004,由天津医科大学动物中心提供。
2.试剂与仪器:2,4-二硝基氯苯(DNCB)来自美国Sigma公司,ESC及其基质由铂唯爱天津生物科技有限公司提供,ESC为10%(v/v)薏米油提取物,基质包括卵磷脂和一些赋形剂。白细胞介素4(IL⁃4)、IgE、干扰素γ(IFN⁃γ)ELISA检测试剂盒来自天津赛东南生物技术有限公司。
二、分组及处理
1.分组及处理:40只小鼠采用随机数字表法随机分为空白组8只、模型组32只。造模完成后,空白组8只、模型组8只立即处死,另24只小鼠随机分为模型对照组、ESC组、基质组,每组8只。各组小鼠分笼饲养,保持自由饮水和标准饮食,定期清洁消毒。
2.造模:小鼠在室温(25±1)℃和60%湿度条件下适应性喂养1周。实验前1天用10%硫化钠溶液背部脱毛(面积2 cm×2 cm);实验第1~3天每天将100μl 1%DNCB溶液(以丙酮和橄榄油1∶4作为基质配制而成)外涂于小鼠背部脱毛区及双耳部;第4天开始改用0.1%DNCB 100μl,每2天外涂1次,直到第28天[4]。造模第28天,模型组小鼠背部出现红斑、丘疹、渗出、结痂,耳部出现肿胀、红斑,在该组8只小鼠背部取材行病理检查,摘眼球取血,3 000 r/min(离心半径10 cm)离心20min,分离上清液,-80℃冰箱保存备用。
3.治疗方案:模型对照组不予任何处理,ESC组和基质组小鼠每天背部皮损分别涂抹ESC或基质,每次200μl,涂抹后按摩小鼠皮损处,使其充分吸收,连续4周。根据小鼠与人体的体表面积比例换算给药剂量,即200μl/cm2,薏苡仁提取物的浓度为10%(参考既往研究薏苡仁提取物对细胞生长影响实验所得出的最适浓度[5])。末次给药12 h后,3组小鼠均摘除眼球取血,静置后离心,留取血清备用。在所有小鼠背部皮损处取5mm2组织标本,4%甲醛固定备用。
三、观察指标及方法
1.小鼠皮损表现:造模完成及末次给药12 h后观察各组小鼠背部皮损大体表现,将红斑、渗出、结痂、搔抓、干燥分别按正常(0分)、轻度(1分)、中度(2分)、重度(3分)评分。
2.小鼠耳部皮损厚度:用测厚仪于造模前、造模完成及末次给药12 h后测量各组小鼠左耳厚度。
3.组织病理学观察:对组织标本行石蜡包埋切片、HE染色,观察每组小鼠表皮、真皮改变。甲苯胺蓝染色,观察肥大细胞浸润情况,计算每组10个高倍(×400倍)视野下肥大细胞数,取平均值。
4.水通道蛋白3(AQP3)、Toll样受体2(TLR2)和TLR4表达检测:石蜡切片脱蜡水化,抗原修复,加兔抗鼠一抗(TLR2多克隆抗体,1∶100稀释;AQP3多克隆抗体,1∶200稀释;TLR4多克隆抗体,1∶400稀释),加辣根过氧化物酶标记的山羊抗兔二抗(美国Sigma公司),双花扁豆凝集素(DBA)显色,封片观察。
5.血清细胞因子检测:按试剂盒说明书操作,ELISA法检测血清IgE、IL⁃4和IFN⁃γ水平。
6.统计学分析:采用SPSS19.0统计软件,实验数据以x±s表示,方差齐性检验后,两样本均数间比较采用t检验;多组间比较采用方差分析及SNK法。P<0.05表示差异有统计学意义。
四、结果
1.小鼠皮损表现:造模第28天,空白组小鼠皮肤没有任何变化,模型组小鼠皮肤出现不同程度的红斑、干燥、抓痕、结痂,烦躁。给药第28天,ESC组小鼠皮损缓解,其临床症状评分与模型对照组比较,差异有统计学意义(P<0.05),基质组与模型对照组比较,差异无统计学意义(P>0.05)。见图1、表1。
2.小鼠耳部皮损厚度:治疗28天后,基质组、模型对照组、ESC组左耳厚度两两比较,差异有统计学意义(均P<0.01)。见表1。
3.小鼠背部皮损组织病理表现:造模完成后,空白组小鼠表皮薄,真皮胶原规则,附属器正常,无炎症细胞浸润;模型组表皮角化过度、角化不全、浆液渗出,表皮棘层增厚,细胞间水肿,真皮显著炎症细胞浸润,见图2A、2B。治疗28 d时模型对照组和基质组表皮轻度增生,细胞间水肿,真皮中性粒细胞、淋巴细胞浸润;ESC组表皮稍增厚,伴真皮内稀疏炎症细胞浸润。见图2。ESC组与模型对照组及基质组比较真皮浸润的肥大细胞数差异有统计学意义(P<0.01),见表1。
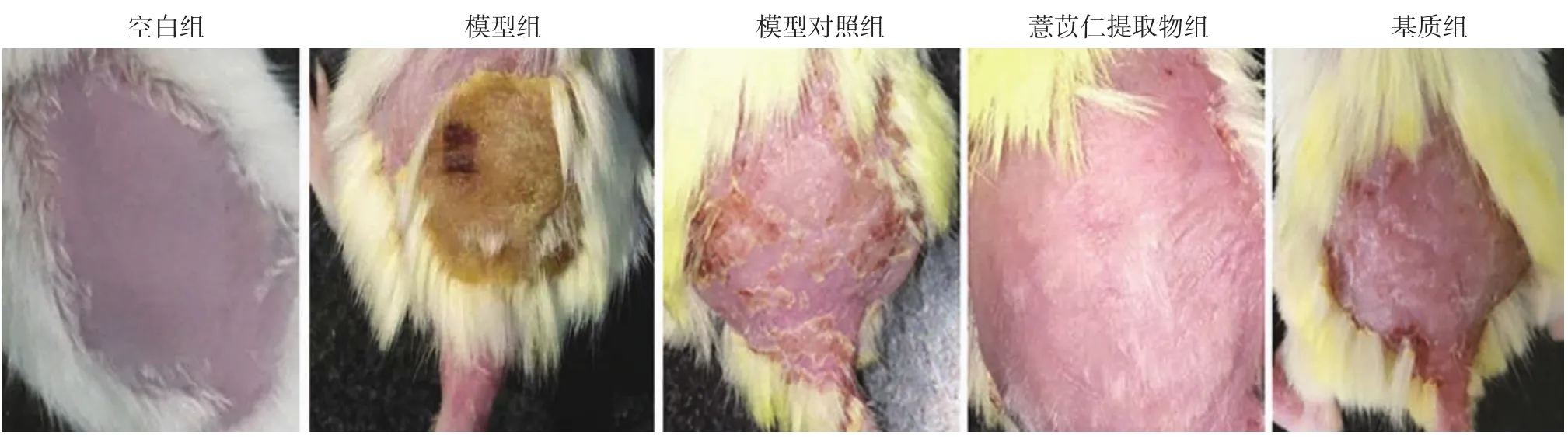
图1 各组小鼠皮损表现 造模完成后空白组小鼠几乎没有变化,模型组小鼠背部出现不同程度的红斑、抓痕、结痂。治疗28 d后,薏苡仁提取物组小鼠皮损消退,表皮光滑;模型对照组和基质组仍可见脱屑、增厚
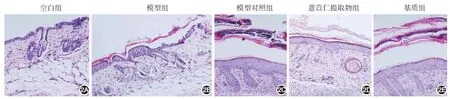
图2 特应性皮炎造模完成后及治疗28 d时各组小鼠皮损病理表现(2A、2B:HE×200;2C~2E:HE×100)
表1 特应性皮炎小鼠临床症状评分、皮损厚度、真皮肥大细胞浸润程度比较(±s)

表1 特应性皮炎小鼠临床症状评分、皮损厚度、真皮肥大细胞浸润程度比较(±s)
注:a与模型对照组比较,P<0.05;b与基质组比较,P<0.05
组别模型对照组薏苡仁提取物组基质组F值P值n值8 8 8临床症状评分2.50±0.58 1.50±0.58a 2.25±0.50 7.20<0.001鼠耳厚度(mm)0.33±0.01b 0.31±0.01ab 0.28±0.01 16.10<0.001浸润肥大细胞数(个/400倍视野)28.94±1.28 15.18±1.64a 28.08±2.15 8.40<0.01
4.免疫组化检测结果:见图3。治疗28 d时,模型对照组AQP3表达高于基质组但低于ESC组;模型对照组TLR2和TLR4表达高于基质组,ESC组TLR2和TLR4较模型对照组表达下降。基质组与模型对照组AQP3及TLR2和TLR4表达差异无统计学意义(均P>0.05)。
5.血清IgE、IL⁃4和IFN⁃γ水平:见表2。造模完成后,模型组外周血IgE、IL⁃4水平显著高于空白组(q值分别为-6.88、-5.07,均P < 0.05),IFN⁃γ水平显著低于空白组(q=8.50,P < 0.05)。治疗28 d时,ESC组外周血IgE、IL⁃4水平显著低于模型对照组(q值分别为6.63、8.95,均P < 0.05),IFN⁃γ水平高于模型对照组(q=-4.78,P<0.05),基质组与模型对照组相比,上述指标差异无统计学意义(均P>0.05)。
五、讨论
半抗原法是目前比较常用的AD造模方法,此方法也在文献[6]中提及,即采取小剂量DNCB多次刺激小鼠,产生的皮肤炎症反应类似于人类的AD。这种方法已经大量应用于基础实验及临床。本研究用DNCB作为致敏剂刺激小鼠进行造模,刺激完成后小鼠背部皮肤出现红斑、渗出、结痂等典型皮损,说明成功建立AD小鼠模型。
Outside⁃inside是近年来比较认可的关于AD发病机制的一种假说,Outside指基因、环境等因素造成皮肤屏障功能的破坏;inside指皮肤屏障功能受损,引起Th2细胞活化、细胞因子分泌增多等一系列超敏反应[7]。各种因素导致皮肤屏障功能受损,致敏原通过受损皮肤屏障进入机体,Th2细胞活化导致IL⁃4生成增多,诱导IgE产生;IL⁃4还可以抑制IFN⁃γ诱导皮肤转录,使IFN⁃γ对IgE合成的抑制作用减弱[8⁃9]。因此IgE、IL⁃4、IFN⁃γ是AD治疗的重要靶点。我们用DNCB致敏BALB/C小鼠,构建AD小鼠模型,并外用ESC治疗,结果显示,模型对照组小鼠血清IgE、IL⁃4水平升高,IFN⁃γ下降;模型小鼠经ESC治疗后,血清IgE、IL⁃4水平下降,IFN⁃γ水平升高,说明ESC可降低AD模型组小鼠IgE、IL⁃4水平,升高IFN⁃γ水平。
AQP在维持皮肤的水合平衡中有重要意义[10],AQP3表达异常是AD的病理机制[11]之一。健康小鼠皮肤AQP3主要定位于基底层及皮肤附属器。AD患者AQP3棘层表达增加[12]。本研究中,AQP3在空白组小鼠仅表达在基底层;治疗28 d后,模型对照组基底层及棘层AQP3表达增加,ESC组AQP3表达恢复到基底层,棘层极少,说明ESC可调控AQP3表达。

图3 治疗28 d时小鼠皮肤水通道蛋白3和Toll样受体2、4表达变化(双花扁豆凝集素×200)
表2 各组小鼠血清中白细胞介素4(IL⁃4)、IgE、干扰素γ(IFN⁃γ)水平比较(± s,ng/L)

表2 各组小鼠血清中白细胞介素4(IL⁃4)、IgE、干扰素γ(IFN⁃γ)水平比较(± s,ng/L)
注:n=8。a与空白组比较,P<0.05;b与模型对照组比较,P<0.05
组别空白组模型组模型对照组薏苡仁提取物组基质组IgE 5.81±1.30 9.06±0.99a 11.30±0.51 6.800±1.25b 10.64±0.12 IL⁃4 62.12±13.02 96.86±1.82a 98.34±9.03 53.81±4.17b 91.95±5.68 IFN⁃γ 64.11±6.15 42.20±6.45a 43.65±1.87 70.18±10.94b 44.93±1.20
TLR是近年来发现的一类重要的模式识别受体[13]。TLR可识别微生物高度保守成分即病原体相关分子模式(pathogen⁃associated molecular pattern,PAMP),通过激活NF⁃kB信号通路介导天然免疫及炎症反应[14]。TLR2和TLR4受体几乎存在于所有的病原微生物中,两者细胞定位不同,其中TLR2识别革兰阳性细菌的肽聚糖及真菌的甘露聚糖,TLR4识别革兰阴性细菌的脂多糖(LPS),刺激肥大细胞通过产生细胞因子参与炎症反应,都与AD的发生密切相关。研究发现,角质形成细胞不但是构成皮肤屏障的结构细胞,还是参与皮肤天然免疫的重要细胞[4],角质形成细胞诱导性过度表达TLR2和TLR4形成的天然免疫与AD的炎症反应有关。本研究中治疗28 d时,模型对照组小鼠TLR2和TLR4在表皮全层角质形成细胞膜及胞质过度表达,以细胞膜为主,而ESC组TLR2和TLR4表达下降,说明薏苡仁提取物可降低TLR2和TLR4表达,抑制AD的免疫反应。
综上,本研究中ESC明显减轻AD模型小鼠耳部肿胀、改善皮肤炎症反应程度,同时降低血清IgE、IL⁃4水平,升高IFN⁃γ水平,调节皮肤AQP3、TLR2和TLR4的表达。提示ESC对AD模型小鼠有良好治疗效果,可能是通过调节血清IgE、IL⁃4及IFN⁃γ等炎症因子水平和影响AQP3、TLR2和TLR4的表达、抑制免疫反应来实现。本研究为AD治疗提供了新策略。

