急性心肌梗死病人体内HDL阻断ERK1/2活化抑制的血管新生分子生物学机制
,, ,
正常高密度脂蛋白(high density lipoproteins, HDL)因其可逆向转运血液中胆固醇至肝脏而具有抗动脉粥样硬化和降低不良心血管事件发生率的作用[1-2]。既往的研究发现,正常HDL除了逆向转运胆固醇外,还具有抗炎、抗氧化、抗凝、促进血管新生和保护内皮舒张功能等作用[3-4]。然而,越来越多的研究显示,疾病状态下由于机体内环境的改变,病人体内的HDL失去了原有的保护作用:如糖尿病、慢性肾功能不全及冠状动脉粥样硬化性心脏病病人体内HDL的促炎作用增强、失去了抗低密度脂蛋白(low density lipoproteins, LDL)衍生氧化脂质的能力等[5-6]。近期有研究发现冠心病病人体内HDL抗氧化能力及促进内皮细胞管状形成能力较正常HDL减弱[7]。然而冠心病病人体内HDL抑制血管新生的机制尚不明确,细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)活化与细胞的增殖、分化及血管新生密切相关,而且有研究提示ERK可以作为治疗血管新生的靶标[8-9]。
急性心肌梗死(acute myocardial infarction, AMI)时冠状动脉血管缺血导致心急组织坏死,病人体内各种炎性因子激活,此时的HDL是否通过ERK通路参与抑制血管新生是本课题研究的关键所在,这也将为寻求新的促进AMI病人血管新生提供科学依据。
1 资料与方法
1.1 研究对象 AMI组为2016年3月—2016年9月就诊于延安大学附属医院心内科AMI病人50例,心电图ST段抬高或不抬高,排除罹患糖尿病、严重感染性疾病、肾衰竭等可能影响HDL功能的疾病病人,年龄40岁~63岁(43.57岁±8.84岁)。健康对照组(C组,38例)为2016年3月—2016年9月于延安大学附属医院进行健康体检者, 年龄35岁~ 60岁(40.58岁±9.66岁)。所有研究对象均签署知情同意书。本研究已通过延安大学附属医院伦理委员会批准。
1.2 HDL提取 按文献记录方法提取HDL[7]。首先抽取两组参与者的空腹静脉血液,低温运送至实验室并离心(4 000 r/min,4 ℃,10 min)提取上层血浆,按1∶500 加入乙二胺四乙酸(ethylenedinitrilo tetraacetic acid, EDTA, 134 mmol/L)和1∶10 000加入2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene, BHT, 200 mmol/L),之后置入超高速离心机离心(50 000 r/min,4 ℃,21 h)。离心结束后血浆脂蛋白因其密度差异而分层:乳糜颗粒(最上层,乳白色)、水(第二层)、LDL(第三层,橘黄色)、HDL(第四层、亮绿色)、杂质(底层、橘红色)。用无菌注射器吸取HDL层面(不可避免吸取LDL及杂质),然后再次按第1次离心条件离心后再次吸取HDL层面,最后再按上述条件离心后第3次后HDL基本提纯。用BCA蛋白浓度测定试剂盒(Thermo公司)测定HDL浓度,置4℃冰箱备用(可储存约3周)。
1.3 HUVEC中ERK1/2蛋白的检测 取4代~6代HUVEC(ScienCell公司)种植于6孔板内,待细胞铺满瓶底后加入各组HDL进行孵育。实验分组:空白组(blank组,不做处理)、C组(加C组HDL, 终浓度100 μg/mL)、AMI组(加AMI组HDL, 终浓度100 μg/mL)。孵育30 min后用预冷的RIPA细胞裂解液(CST公司)裂解细胞,然后经超声充分破碎后细胞蛋白后离心(4 ℃,12 000 r/min 10 min)并取上层蛋白液,经BCA蛋白浓度测定试剂盒测定蛋白浓度后用Western blot检测ERK1/2蛋白及其磷酸化位点的变化。
1.4 血管新生的检测[7]首先铺胶:取等量的预冷DMEM(GIBCO公司)与Matrix gel(R&D公司)混匀后置冰上,然后将配好的Matrix gel加入预冷的48孔板内,每孔加入150 μL的Matrix gel,轻轻震荡孔板以使Matrix gel均匀铺满板底,将孔板置入细胞培养箱20 min使其凝固(期间可准备细胞)。取4~6代HUVEC细胞,将细胞浓度调至(2~3)×105个/mL后向孔板内每孔加入300 μL。然后加入HDL进行孵育,实验分组:空白组(blank组,不做处理),C组(加C组HDL, 终浓度100 μg/mL、C+PD组(提前用PD98059孵育30 min后再加C组100 μg/mL 的HDL),AMI组(加AMI组HDL, 终浓度100 μg/mL),AMI+PD组(提前用PD98059孵育30 min后再加AMI组100 μg/mL 的HDL)。HDL孵育12 h后用显微镜下对孔板进行拍照和记录数据。

2 结 果
2.1 健康对照组与AMI组临床资料比较 AMI组血脂水平偏高,C组、AMI组在年龄、性别、体重指数等方面比较差异无统计学意义(P>0.05)。详见表1。
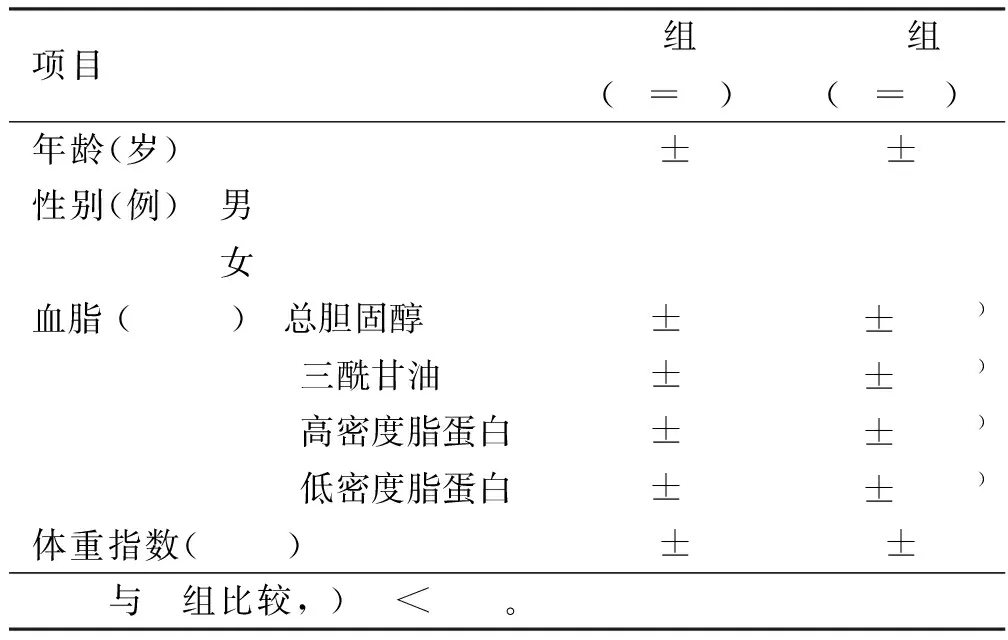
表1 两组临床资料比较
2.2 各组HDL对HUVEC中ERK1/2及其磷酸化位点表达变化的影响 与空白组比较,C组HDL轻微升高ERK1/2蛋白磷酸化,但二者间差异无统计学意义(P>0.05,见图1A),AMI组HDL明显抑制了ERK1/2蛋白的磷酸化(P<0.05),见图1A);ERK1/2总的蛋白表达不受HDL的影响(见图1B)。
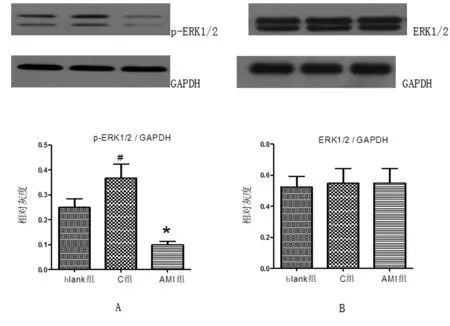
图1 各组HDL对HUVEC中ERK1/2及其磷酸化位点表达变化的影响
2.3 HDL对HUVEC血管新生的影响 与blank组比较,C组和AMI组HDL均可促进HUVEC管状形成(P<0.05),但AMI组HDL促进管状形成的能力明显较C组HDL减弱(P<0.05);PD98059的预处理阻断了HDL对HUVEC管状形成的影响(P<0.05)。详见图2。
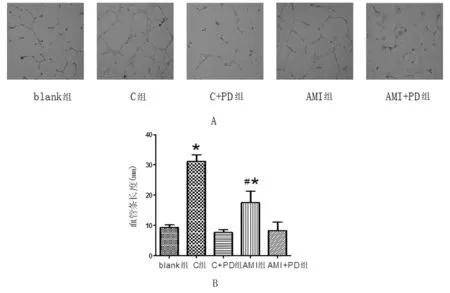
图A:与blank组比较,C组HDL促进HUVEC管状形成,AMI组HDL促进管状形成的能力较C组明显减弱;ERK1/2信号通路抑制剂PD98059的应用抑制了HDL对管状形成的影响。图B: 将图A转换为数值后的柱状图。
3 讨 论
在动物模型上发挥优异疗效的血管内皮生长因子(vascular endothelial growth factor,VEGF)应用到临床实践中时却无法达到预期的疗效[10-11]。仔细研读以往研究报道后发现,过去成功案例的报道均是用正常的动物建立心肌缺血模型后应用生长因子[12-13],然而临床实际中的冠状动脉粥样硬化性心脏病病人大多数是高脂血症导致动脉粥样硬化引起的,高脂血症时的某些成分或高脂血症使体内某些改变的物质也许影响了VEGF对心肌缺血或心肌梗死心肌血管新生的治疗效果。
机体内的HDL并不是一成不变的,在疾病状态下HDL原有的保护心血管疾病的功能较正常HDL减弱了很多,甚至在疾病状态下的HDL还出现了损害心血管的表现[14-15],如糖尿病病人HDL损害了内皮依赖的血管舒张功能,冠心病病人HDL活化内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)及产生一氧化氮(nitric oxide,NO)的能力受损。 李芸等[7]研究显示:冠心病病人体内HDL的抗氧化能力和对内皮细胞管状形成的促进作用减弱。但是冠心病病人HDL影响血管新生的具体机制尚不明了,血管新生的过程包含了内皮细胞的增殖、迁移和最终分化为血管,并且这一过程还包含了各种信号通路和生长因子的参与[16]。ERK信号通路的活化参与了血管新生的整个过程(包含内皮细胞的增殖、迁移分化以及血管新生),而且有研究显示ERK可以作为治疗血管新生的靶标[8-9]。ERK也被证明是VEGF刺激血管新生的信号通路之一[17-18]。本研究以正常人群的HDL和AMI病人体内的HDL为研究对象,通过比较两者对HUVEC管状形成和ERK1/2蛋白磷酸化表达的影响发现:正常HDL通过刺激ERK1/2蛋白的磷酸化促进HUVEC管状形成,而AMI病人体内的HDL通过阻断ERK1/2蛋白的磷酸化抑制HUVEC管状形成。
本研究:与空白组比较,对照组(C组)HDL轻微刺激HUVEC中ERK1/2蛋白的磷酸化,但与空白组比较无统计学意义(P>0.05),AMI组HDL明显抑制HUVEC中ERK1/2蛋白磷酸化(P<0.05),且其刺激HUVEC管状形成的能力较C组HDL明显减弱(P<0.05)。提示AMI病人体内的HDL失去原有促进血管新生的机制之一是抑制了ERK1/2的磷酸化。
AMI病人体内的HDL通过阻断HUVEC中ERK1/2蛋白的磷酸化抑制HUVEC管状形成。这一结果进一步阐明了相较于浓度升高,HDL功能的正常对其发挥心血管保护作用有着更重要意义。

