3D全腹腔镜根治性全胃切除术45例疗效分析
冯 震,董 洋,张新生,张乾世,张卫彬,张振兴,刘敦波,任双义
(1.大连医科大学附属第二医院 胃肠外科,辽宁 大连 116027;2.锦州市中心医院 普外科,辽宁 锦州 121000)
胃癌是我国消化系统常见的恶性肿瘤,在我国恶性肿瘤中,胃癌发病率、死亡率均居第2位[1]。根治性手术是治疗胃癌的主要方式。随着外科技术和器械的日新月异,腹腔镜下胃癌根治术已经越发普及,技术上由2D发展到3D,手术方式由腹腔镜辅助远端胃切除推广到完全腹腔镜下根治性全胃切除[2-4]。腹腔镜下胃癌根治术后消化道重建是手术的难点之一,而全胃切除术后全腔镜下消化道重建技术更为复杂。2016年1月至2017年10月大连医科大学附属第二医院胃肠外科对45例胃癌患者进行3D全腔镜下根治性全胃切除,取得了满意效果。现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年1月至2017年10月在大连医科大学附属第二医院胃肠外科诊断为胃癌并行3D全腔镜下根治性全胃切除术患者的临床资料。纳入标准:(1)术前胃镜证实为胃癌;(2)术前胸腹部CT检查未见肿瘤远处转移;(3)手术操作规范依据2014年第4版《胃癌治疗指南》规定实施腹腔镜胃癌根治术,行D2淋巴结清扫;(4)无严重心、脑、肝、肾等基础疾病;(5)术前未行新辅助治疗。排除标准:(1)腹部手术史;(2)术前行放化疗或靶向治疗等非手术治疗;(3)合并其他系统或器官良、恶性肿瘤;(4)联合脏器切除;(5)严重心、脑、肝、肾等疾病而无法耐受腹腔镜手术。入组病例共45例,其中男32例,女13例;年龄36~79岁,平均(63.07±10.46)岁;行uncut Roux-en-Y吻合39例、食管空肠π形吻合6例。手术均由同一手术团队完成。
1.2 手术方法
手术设备:手术均使用蛇盘3D全高清腹腔镜系统,术者佩戴3D眼镜进行手术。麻醉:所有患者均采用气管插管全身麻醉。体位及戳卡位置:患者采用仰卧分腿位,头高脚低约15°,主刀位于患者左侧(清扫No.4s、No.10淋巴结时,位于患者两腿之间),助手位于患者右侧,扶镜手位于患者两腿之间。采用5孔法,脐下留置10 mm戳卡作为观察孔,左腋前线肋下2 cm处留置10 mm戳卡作为主操作孔,左锁骨中线平脐孔水平留置5 mm戳卡为副操作孔,右腋前线肋下与右锁骨中线平脐水平分别留置5 mm戳卡作为助手操作孔。手术过程:遵循肿瘤根治手术无瘤原则。淋巴结清扫:自横结肠中部向右侧切除大网膜,暴露胃网膜右动静脉,清扫No.4d和No.6淋巴结;裸化十二指肠球部并离断十二指肠,循胃十二指肠动脉向上显露胃右动静脉,清扫No.5组淋巴结;沿肝固有动脉清扫No.12a组淋巴结;向上掀起胃体,于血管根部分离胃左动静脉,并显露肝总动脉、腹腔干及脾动脉干近段,清扫No.7、No.8a、No.9和No.11p组淋巴结;将胃翻至左上腹,切除肝胃韧带,清扫No.1和 No.3组淋巴结,充分游离食管下段,注意保护胸膜;术者移位至患者两腿之间,自横结肠中部向左侧切除大网膜,至胰体尾部结扎切断胃网膜左血管,游离切除脾门周围淋巴结缔组织,再依次结扎切断胃短血管,直至食管左侧,清扫No.4s、No.10和No.2组淋巴结。全腔镜下消化道重建:(1)Uncut Roux-en-Y吻合:用束带牵拉食管胃结合部,于食管右侧壁打开一小口,将距Treitz韧带约25 cm处空肠经结肠前上提至食管下端开口处,检查空肠系膜张力,在系膜无张力情况下于空肠对系膜缘开一小口,用60 mm直线切割闭合器将食管与空肠行侧侧吻合,用60 mm直线切割闭合器关闭食管空肠共同开口,用60 mm直线切割闭合器将距食管空肠吻合口约45 cm处输出攀与输入攀行侧侧吻合,于距食管空肠吻合口约5 cm处闭合输入攀肠管。V-loc线加固缝合食管空肠吻合口及十二指肠断端。(2)食管空肠π形吻合:用束带牵拉食管胃结合部,于食管右侧壁打开一小口,将距Treitz韧带约25 cm处空肠经结肠前上提至食管下端开口处,检查空肠系膜张力,在系膜无张力情况下于空肠对系膜缘开一小口,用60 mm直线切割闭合器将食管与空肠行侧侧吻合,再用60 mm直线切割闭合器离断食管和空肠并关闭食管空肠共同开口。游离空肠系膜,切除部分空肠,距食管空肠吻合口以远45 cm处用60 mm直线切割闭合器行输入攀输出攀侧侧吻合。V-loc线加固缝合食管空肠吻合口及十二指肠断端。
1.3 观察指标
(1)手术情况:手术时间、术中出血量、淋巴结清扫数目。(2)术后情况:术后首次进流食时间、术后腹腔引流管拔出时间、术后并发症、术后住院时间。(3)术后病理:肿瘤分化程度、TNM分期。(4)住院费用。
2 结 果
本研究45例3D全腔镜下根治性全胃切除术均获得成功,无中转开腹,无围手术期死亡。(1)手术情况:平均手术时间为(218.22±33.30)min,平均出血量为(117.06±71.33)mL,平均清扫淋巴结数目(36.48±17.49)个。(2)术后情况:术后首次进流食时间为(3.33±1.47)d,平均拔出腹腔引流管时间(10.26±6.72)d,术后平均住院时间(11.80±8.29)d;45例患者中共8例患者出现并发症,分别为食管空肠吻合口漏4例、肺炎2例、重症胰腺炎1例、切口感染1例。(3)术后病理检查情况:低分化腺癌30例,中分化腺癌11例,高分化腺癌4例;T4 32例、T3 2例、T2 3例、T1 8例,N3 14例、N2 8例、N1 8例、N0 15例。(4)平均住院费用(83370.35±15490.54)元。详见表1。
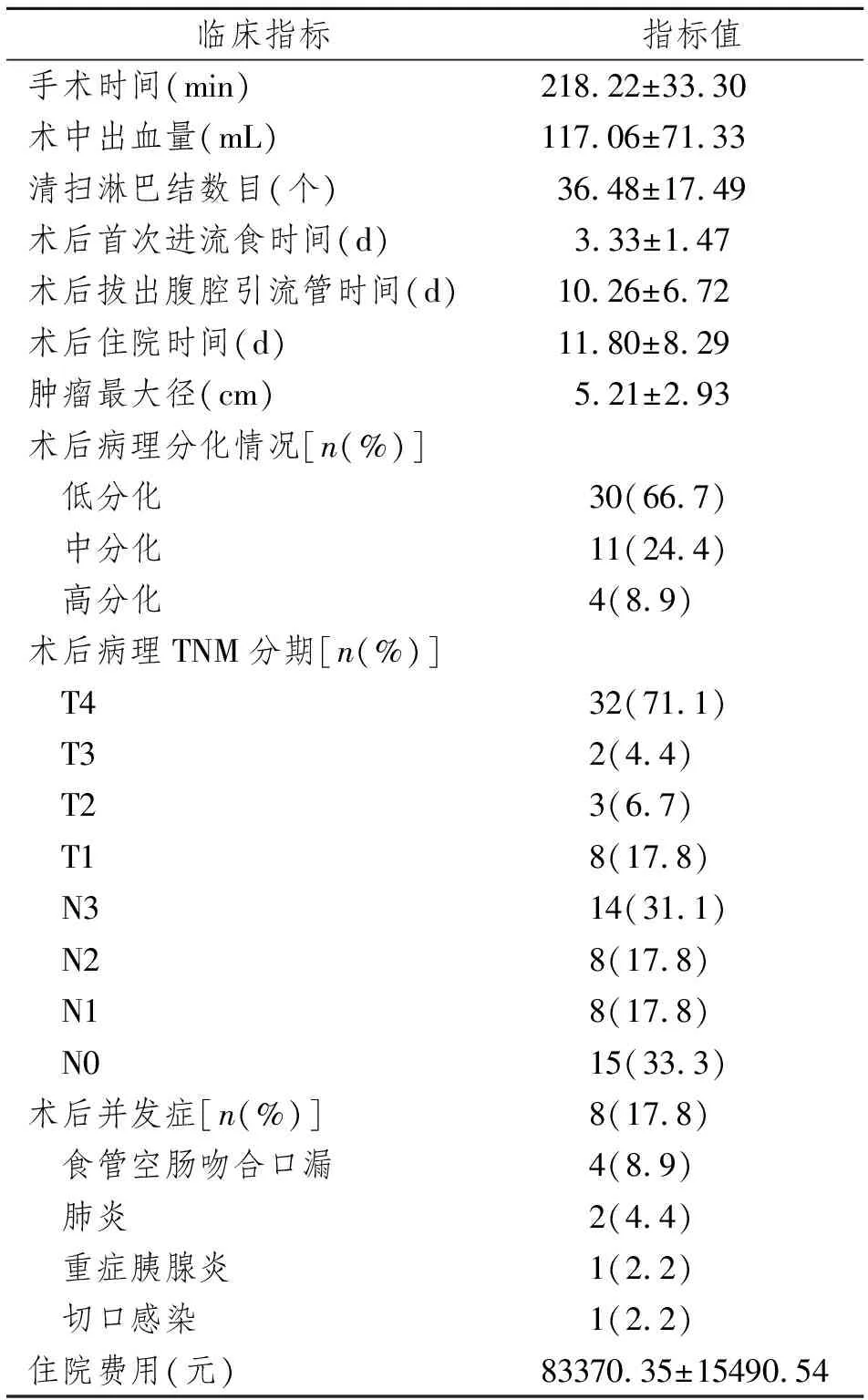
表1 45例患者围手术期情况Tab 1 Perioperative status of 45 patients
3 讨 论
1992年,Goh等[5]首次报道了全腹腔镜远端胃癌根治术,使用直线切割吻合器行腹腔镜下体内BillrothII式吻合。至今,腹腔镜手术应用于胃癌手术已有20余年,腹腔镜下胃癌根治术的可行性及安全性已得到了大家的认可,表现出明显的微创优势,越来越受到外科医生的青睐。近年来,由于胃上部癌越来越多,相对复杂的腹腔镜根治性全胃切除在国内外得到逐步开展[6]。全腔镜下根治性全胃切除的重点和难点为淋巴结清扫和腔镜下消化道重建,对术者的要求极高,以致全腔镜下根治性全胃切除在临床上开展相对较少。目前,腹腔镜辅助全胃切除,小切口辅助消化道重建仍是许多医院的首选。而全腔镜下全胃切除及体内吻合学习曲线较长,外科医生经验欠缺,全腔镜下根治性全胃切除只被少数大型医院接受。
2D腹腔镜是二维平面成像技术,术者在显示器中难以辨别腹腔内组织的前后、远近关系,对于手术器械的进入深度及方向很难掌握[7-8]。3D高清腹腔镜系统能提供与开腹手术相似的立体视觉,使空间定位更加准确,对胃周血管及层次的显露更加清晰;弥补了2D腹腔镜的上述缺点。2012年谢先木等[9]报道腹腔镜辅助根治性全胃切除术手术时间(348.30±37.80)min、术中出血量(158.30±127.40)mL、术后首次进流食时间(3.60±2.10)d。2014年陈为明[10]报道腹腔镜辅助根治性全胃切除术手术时间(343.25±36.62)min、术中出血量(157.83±52.21)mL。2018年辛乐等[11]报道腹腔镜根治性全胃切除术术中出血量(189.96±70.95)mL、淋巴结清扫个数(20.27±4.02)个、术后首次进流食时间(4.35±1.93)d、术后住院时间(12.31±2.69)d。本组45例患者,均成功行3D全腹腔镜根治性全胃切除术,并取得了较好的近期临床疗效,手术时间、术中出血量、清扫淋巴结数目、术后进流食时间、住院时间等效果均较好,尤其在淋巴结清扫上取得了满意的数目。可以得出3D全腹腔镜根治性全胃切除术具有以下优点:(1)3D高清腹腔镜系统能使术野放大,在裸化血管根部及清扫淋巴结方面更加准确,减少了术中出血,进而减少因止血而增加整体手术时间的机会;(2)微创优势更突出,全腔镜手术避免了腔镜辅助时剑突下6~8 cm的切口,达到了更好的微创及美观效果,全腔镜手术避免了小切口辅助时盲目牵拉导致的组织撕扯及血管出血,减少辅助切口所带来的应激反应,利于患者术后恢复;(3)全腔镜下行消化道重建,简化了操作流程,视野比小切口辅助下更加广阔,不容易出现肠管远近端方向误判或者肠管打折等失误[12]。
本研究中,4例患者术后出现食管空肠吻合口漏,考虑为吻合口位置过高,吻合口张力过大可能,术后置入空肠营养管,经过保守治疗后好转;2例患者术后出现肺炎,患者均高龄,离床活动较少所致,经过抗生素抗感染治疗后逐渐好转;1例患者出现重症胰腺炎,考虑为患者术后未控制饮食所致,予以患者禁食水、抑酸、补液、抑酶等对症处置后患者症状逐渐好转;1例患者出现切口感染,考虑为患者肥胖所致,予以患者彻底清创,定期换药后切口逐渐愈合。关于3D全腔镜根治性全胃切除术术后相关并发症还有待于今后大、中样本的进一步统计学分析。
在总结本组45例3D全腔镜根治性全胃切除术患者的临床资料时,也发现3D全腹腔镜根治性全胃切除术存在不足:(1)全腔镜下全胃切除及体内吻合学习曲线较长,对术者要求极高,想要完成高质量的全腔镜根治性全胃切除有一定困难,需要术者完成相当大数量的手术病例,越过学习曲线后才能达到;(2)手术费用稍高,全腔镜下体内完成消化道重建,较小切口辅助下完成重建需要更多的直线切割闭合器钉仓,会导致直接费用上升。
综上所述,3D全腹腔镜根治性全胃切除术安全、可行,对患者创伤小,患者术后恢复快。值得临床进一步推广。

