过表达SIRT1对高糖诱导RVECs细胞的影响及对VEGF和PEDF表达的影响
周垂仁,黄卫,江玲,龙碧
(1.重庆市璧山区人民医院眼科;2.重庆市璧山区人民医院内分泌科,重庆 402760)
糖尿病视网膜病变(diabetic retinopathy,DR)是十分常见的糖尿病并发症,也是导致成人失明的主要原因之一[1]。病程5年以上2型糖尿病(type 2 diabetes,T2DM)患者合并DR的发生率为24%~40%,病程10年以上T2DM患者合并DR的发生率高达 53%~84%[2-3]。所以,对于DR的防治及其发病机制的研究具有十分重要的意义。有关DR的具体发病机制尚不十分明确,一般认为是多种因素共同作用的结果。近年来,有关沉默信息调节因子-1(silent information regulator-1,SIRT1)与糖尿病及其并发症的相关研究,越来越受到众多学者的重视[4-6]。本实验通过观察过表达SIRT1对高糖诱导的人视网膜血管内皮细胞(retinal vascular endothelial cells,RVECs)增殖、凋亡,及其对血管内皮生长因子(vascular endothelial growth factor,VEGF)和色素上皮衍生因子(pigment epithelium derived factor,PEDF)表达的影响,从而为DR的临床防治提供一定的实验依据,现报告如下。
1 材料与方法
1.1 实验材料
RVECs细胞(中国科学院上海细胞库);培养液,胎牛血清,胰蛋白酶(美国Gibco公司);慢病毒载体包装系统包含pCDH-CMV-MCS-EF1-coHGFP、pRsv-REV、pMDlg-pRRE、pMD2G质粒(美国System Biosciences公司);人SIRT1基因片段(美国Santa Cruz Biotech公司);逆转录和实时荧光定量PCR试剂盒(美国ABI Applied Biosystems公司);兔抗人SIRT1、兔抗人VEGF、兔抗人PEDF,羊抗兔二抗,BAD显色试剂盒(美国Santa Cruz公司);原位末端标记法(TdT-mediated dUTP nick-end labeling,TUNEL)细胞凋亡检测试剂盒(瑞士罗氏公司);EcoRⅠ和AgeⅠ内切酶,DNA回收和连接试剂盒(日本TaKaRa公司);Opti-DMEM培养基,Lipofectamine 2000,TRIzol总RNA提取试剂盒(美国Invitrogen公司)。
1.2 实验方法
1.2.1 SIRT1过表达慢病毒载体的构建 根据Gen Bank人SIRT1基因信息,委托上海吉玛公司设计合成针对SIRT1基因的DNA寡核苷酸链。正向5’-CCGGGCGGGAATCCAAAGGATAATTCTCGAGAATTATCCTTTGGATTCCCGCTTTTG-3’,反向5’-AATTCAAAAAGCGGGAATCCAAAGGATAATTCTCGAGAATTATCCTTTGGATTCCCGC-3’(内含EcoRⅠ和AgeⅠ酶切位点),以人SIRT1基因为模板进行PCR扩增,产物经1.5%琼脂糖凝胶电泳,DNA凝胶回收试剂盒回收、纯化。采用EcoRⅠ和AgeⅠ双酶切PCR产物和pCDH-CMV-MCS-EF1-coHGFP质粒,经T4 DNA连接酶连接后转化DH5α大肠杆菌,经氨苄青霉素琼脂培养基筛选阳性克隆,测序。pCHD-SIRT1、pRsv-REV、pMDlg-pRRE和pMD2G共转染HEK293T细胞,收集细胞上清液经0.45 μm过滤器过滤,获得SIRT1过表达慢病毒,经测定病毒滴度(MOI)=50。
1.2.2 实验分组及处理 RVECs细胞株接种于10%胎牛血清的人内皮细胞培养液,37 ℃、5% CO2培养箱培养。生长至80%融合时,0.25%胰蛋白酶消化、传代。取对数期细胞用于后续实验,分为3组:(1)正常对照组(NG组):正常培养RVECs细胞,不经任何处理;(2)高糖组(HG组):在含33 mmol/L葡萄糖的培养液中培养;(3)SIRT1过表达慢病毒组(SIRT1组):用MOI=50的SIRT1过表达慢病毒转染细胞,并在含33 mmol/L葡萄糖的培养液中培养。转染6 h后弃去更换正常培养液继续培养,48 h后于荧光显微镜下观察细胞绿色荧光蛋白(GFP)表达,收集细胞用于后续实验。
1.2.3 实时荧光定量PCR检测基因表达 TRIzol法提取细胞总RNA,逆转录合成cDNA,以cDNA为模板进行PCR扩增。SIRT1 上游:5’-GACTTCAGGTCAAGGGAT-3’,下游:5’-CGTGTCTATGTTCTGGGTA-3’。 VEGF上游:5’-AAACTGTCAGCTCGGTCAGA-3’,下游:5’-TCAGGGGCCGATTAAAGCTC-3’。PEDF上游:5’-CGATGAGATCAGCATTCTCC-3’,下游:5’-ATTCTGGGTCACTTTCAGGG-3’。GAPDH上游:5’-GGAGCCAAACGGGTCATCATCTC-3',下游:5’-ATGCCTGCTTCACCACCACCTTG-3’。扩增条件:94 ℃/3 min,94 ℃/1 min,61 ℃/30 s,72 ℃/30 s,共35个循环,72 ℃/7 min。采用2-△△Ct计算目的基因相对含量(RQ),RQ=2-△△Ct。
1.2.4 蛋白印迹法检测蛋白表达 RIPA裂解液裂解细胞,离心获取细胞总蛋白,二喹啉甲酸法测定蛋白浓度。等量总蛋白上样,聚丙烯酰胺凝胶电泳分离,转至聚偏氟乙烯膜。磷酸盐缓冲液(phosphate buffered solution,PBS)漂洗,5%脱脂奶粉室温封闭1 h,加入兔抗人一抗工作液(抗SIRT1、抗VEGF、抗PEDF,1∶500),4 ℃孵育过夜。PBS漂洗,加入羊抗兔二抗工作液(1∶500),37 ℃孵育1 h。PBS漂洗,BAD显色,Bio-rad系统分析,目的蛋白表达量=目的蛋白光密度值/内参光密度值。
1.2.5 噻唑蓝比色法检测细胞增殖 RVECs细胞株接种于96孔板,具体分组及处理同1.2.2所述,同时设置空白对照组只加培养液。转染48 h后,每孔加入20 μL噻唑蓝(5 mg/mL)。孵育4 h,每孔加入150 μL二甲基亚砜。振摇15 min,充分溶解结晶,酶标仪测定OD (570)值。假设NG组细胞增值率为100%,计算SIRT1组和HG组细胞增殖率=(SIRT1组或HG组OD值-空白对照组OD值)/(NG组OD值-空白对照组OD值)×100%。
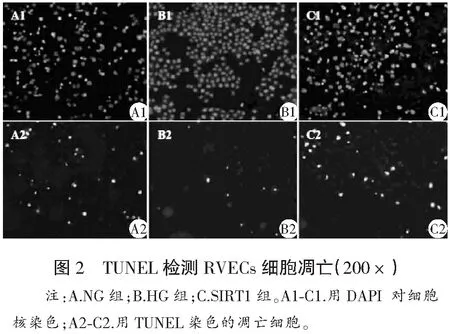
1.2.6 TUNEL检测细胞凋亡 RVECs细胞株接种于放置盖玻片的6孔板中,具体分组及处理同1.2.2。转染48 h后,收集各组盖玻片,二甲苯浸洗2次,梯度酒精浸洗1次,PBS漂洗2次。加入Proteinase K工作液,37 ℃下孵育30 min。PBS漂洗2次,加入50 μL的TUNEL反应混合液,封膜,暗湿盒中37℃下孵育30 min。PBS漂洗3次,加50 μL 的converter-POD工作液,封膜,暗湿盒中37 ℃下孵育30 min。PBS漂洗3次,加入100 μL的DAB显色剂,25 ℃下孵育10 min。PBS漂洗3次,苏木素,自来水冲洗,梯度酒精脱水,二甲苯透明,中性树胶封片。光学显微镜400倍光镜下,取7个阳性视野,每个视野计数200个细胞,计算凋亡细胞占总细胞百分比作为凋亡率。
1.3 统计学分析
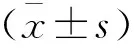
2 结果
2.1 SIRT1、VEGF和PEDF基因表达比较
经单因素方差分析,NG组、HG组和SIRT1组细胞SIRT1、VEGF和PEDF基因表达水平存在显著性差异(F=11.279,P=0.002;F=10.815,P=0.002;F=19.601,P<0.001)。经LSD-t检验,HG组细胞SIRT1基因表达水平低于NG组(t=3.623,P<0.001),而VEGF和PEDF基因表达水平高于NG组(t=4.339、6.037,P<0.001);SIRT组SIRT1基因表达水平较HG组显著增加(t=3.754,P<0.001),而VEGF和PEDF基因表达水平显著降低(t=4.445、5.893,P<0.001)。见表1。
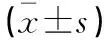
表1 各组细胞SIRT1、VEGF和PEDF基因表达水平比较
注:所有实验均重复5次,*P<0.001,与HG组比较;#P<0.001,与NG组比较。
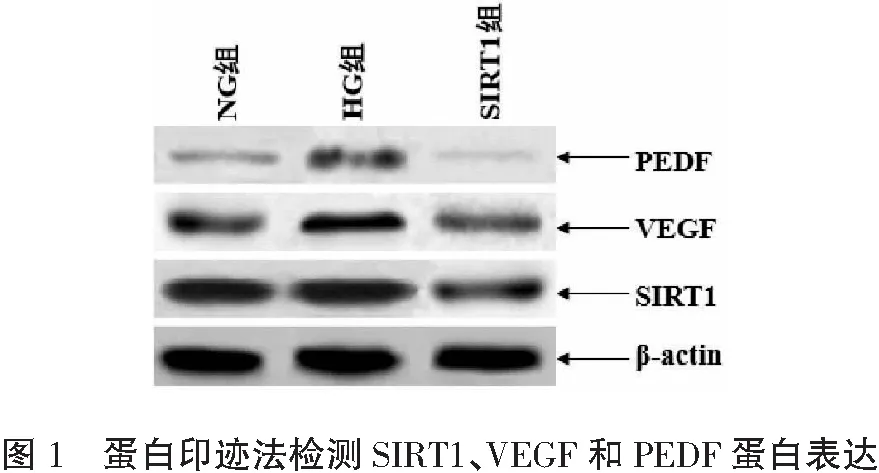
2.2 SIRT1、VEGF和PEDF蛋白表达比较
经方差分析,NG组、HG组和SIRT1组细胞SIRT1、VEGF和PEDF蛋白表达水平均存在显著性差异(F=16.327、27.433、19.981,P<0.001)。经LSD-t检验,HG组SIRT1蛋白表达水平较NG组显著降低(t=11.766,P<0.001),而VEGF和PEDF蛋白表达水平显著增加(t=6.797、5.296,P<0.001);SIRT组SIRT1蛋白表达水平较HG组显著增加(t=12.475,P<0.001),而VEGF和PEDF蛋白表达水平显著降低(t=5.674、6.012,P<0.001)。见表2和图1。
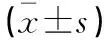
表2 各组细胞SIRT1、VEGF和PEDF蛋白表达水平比较
注:所有实验均重复5次,*P<0.001,与NG组比较;#P<0.001,与HG组比较。
2.3 过表达SIRT1对RVECs细胞增殖和凋亡的影响
经方差分析,NG组、HG组和SIRT1组细胞增殖率、凋亡率均存在显著性差异(F=57.152、7.718,P<0.001)。经LSD-t检验,HG组细胞增殖率较NG组显著增加(t=7.302,P<0.001),而凋亡率显著降低(t=4.014,P<0.001);SIRT1组细胞增殖率较HG组显著降低(t=6.543,P<0.001),而细胞凋亡率显著增加(t=4.783,P<0.001)。见表3和图2。
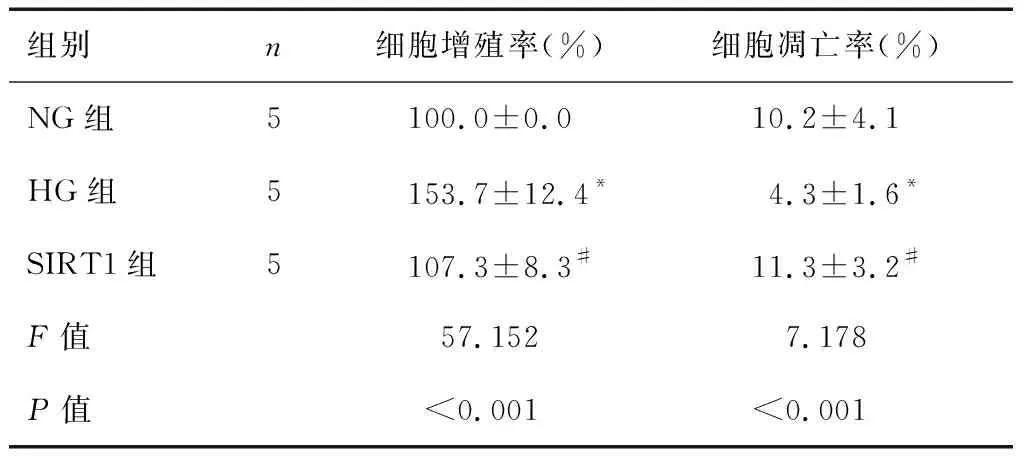
表3 过表达SIRT1对RVECs细胞增殖和凋亡的影响
注:所有实验均重复5次,*P<0.001,与NG组比较;#P<0.001,与HG组比较。
2.4 SIRT1与VEGF和PEDF的相关性分析
经Pearson相关性分析显示,SIRT1表达水平与VEGF和PEDF呈负相关(r=-0.814,P=0.005;r=-0.593,P=0.029)。
3 讨论
SIRT1是一种组蛋白脱乙酰基蛋白酶,通过其脱乙酰基作用而参与体内众多蛋白酶和转录因子的活性调节[7-8]。Mortuza等[4]研究发现,高糖可诱导视网膜血管内皮细胞中miR-195的表达,并通过与SIRT1的3’端非编码区(3’-UTR)结合而抑制SIRT1表达。Li等[5]研究证实,糖尿病肾病模型大鼠SIRT1表达显著降低。Hou等[6]学者认为,SIRT1通过促进能量代谢平衡重建、调节细胞氧化还原状态、抗细胞凋亡、抑制炎症和改善肾纤维化等方面发挥肾脏保护作用,延缓糖尿病肾病的进展。以上结果说明SIRT1在糖尿病及其并发症的发病过程中发挥重要作用。然而有关SIRT1在DR发生、发展中的作用研究,鲜有报道。本实验结果发现:HG组细胞增殖率较NG组显著增加,凋亡率显著降低;SIRT1组细胞增殖率较HG组显著降低,凋亡率显著增加。实验结果提示:高糖环境能够诱导体外培养RVECs细胞增殖和降低其凋亡,而过表达SIRT1能够逆转高糖诱导的RVECs细胞增殖,促进其凋亡。
DR的主要病理特征表现为视网膜血管内皮细胞增生及新生血管形成等。VEGF和PEDF被认为是调节内皮细胞增生及新生血管形成的关键细胞因子,二者表达的失衡是引起DR 发生、发展的中心环节[9-11]。正常情况下,眼部组织VEGF呈低表达,从而维持眼部血管的完整性。如果VEGF过度表达,则会促进血管内皮细胞增殖和新生血管形成,并增加血管通透性,引起血-视网膜屏障损伤[12-14]。目前,临床上采用VEGF抗体治疗DR患者黄斑水肿和新生血管,已取得令人满意的疗效[15]。PEDF可拮抗VEGF表达阻断新生血管形成,能上调抗凋亡基因Bcl-2表达阻止神经元细胞凋亡,被认为是维持新生血管稳态的必要条件[16-17]。Matsuyama等[18]学者报道显示DR患者血清PEDF表达显著高于健康人群。本实验结果发现:HG组细胞VEGF和PEDF表达均显著高于NG组,而SIRT1组细胞VEGF和PEDF表达较HG组显著降低。实验结果提示:高糖环境能够诱导体外培养RVECs细胞VEGF和PEDF表达增加,而过表达SIRT1能够逆这一现象。
国内外有关SIRT与VEGF的研究较少。邵滢等[19]研究发现,miR-217通过与SIRT1的3’-UTR结合而抑制SIRT1表达,从而上调HIF-1α表达。Kang等[20]研究发现,高糖可诱导HIF-1α激活,继而刺激其下游VEGF表达增加,诱导新生血管形成。说明SIRT与VEGF之间存在某种关系,本实验结果显示SIRT1表达与VEGF呈负相关。有关SIRT1与PEDF的研究尚未见文献报道。在本实验中也观察到HG组PEDF表达增加,且过表达SIRT1可逆转高糖引起的PEDF表达增加。我们推测可能是由于高糖诱导VEGF表达增加,而引起PEDF代偿性表达增加。
综上所述,高糖环境能够诱导RVECs细胞增殖、减少凋亡,并上调细胞VEGF和PEDF表达。过表达SIRT1能够抑制高糖诱导的RVECs细胞增殖、促进凋亡,并且下调VEGF和PEDF表达。

