272例腰椎滑脱症手术治疗疗效观察
杨明礼,蒋成,张超
(1.达州骨科医院,四川 达州 635000;2.川北医学院附属医院,四川 南充 637000)
腰椎滑脱症是较为常见的疾病,是引起成年人腰腿痛的重要原因之一,其发病率约5%[1]。腰椎滑脱是某一腰椎相对于下一位椎体向前滑移。轻度滑脱患者常无明显临床症状,多采用保守治疗。中、重度腰椎滑脱患者,可产生持续性下腰痛、下肢麻木疼痛、间歇性跛行、影响行走和负重,严重影响患者生活质量,常需要行手术治疗。本院2003年1月至2016年12月对272例腰椎滑脱症患者进行了后路减压、内固定复位、椎间融合术,术后疗效满意,现报告如下。
1 资料与方法
1.1 一般资料
272例腰椎滑脱症患者,其中男性161例,女性111例;年龄56~75岁,平均(65±18.74)岁,所有患者均行腰椎正侧位片,CT检查,其中102例患者行过伸过屈位X片检查,滑脱合并峡部裂者215例。参考Meyerding 滑脱分级,Ⅱ度210例,Ⅲ度62例。L5滑脱102例,L4滑脱119例,L3滑脱51例。
1.2 手术方法
全麻,俯卧,以滑脱椎体为中心作腰部正中皮肤切口约10 cm,电刀钝性剥离双侧椎旁肌,显露滑脱椎体及下位椎体的棘突、椎板、关节突及横突根部,C臂X线机定位滑脱椎体先将2枚提拉螺钉分别置入滑脱椎体的椎弓根内,再将2枚固定螺钉分别置入下位椎体的椎弓根内,切除滑脱椎体棘突,切除椎板,侧隐窝减压,切除肥厚的黄韧带,对硬膜和神经根彻底减压,将硬膜及神经根牵向对侧,显露滑脱椎体下椎间盘,切除纤维环,取出髓核组织,清除上下终板软骨。再从对侧牵开硬膜和神经根,显露对侧的椎间盘并切除髓核组织,清除上下终板软骨,露出松质骨。将合适的剥离器伸入椎间隙,以下位椎体的后上缘为支点,另一端顶住滑脱椎体的下面,使滑脱椎体松动复位,同时连接螺钉连杆,撑开,提拉,使滑脱椎体复位,触摸滑椎后缘与下位椎体后缘感觉平整,无阶梯感,C臂透视,复位满意。将切下的棘突,椎扳咬成颗粒状,植入椎间隙前2/3,再植入装有骨颗粒的椎间融合器,周围再植入松质骨。两椎间纵向加压固定,再次探查硬膜,神经根无压迫,冲洗切口,置负压引流管,缝合切口。
1.3 术后处理
术后使用抗生素预防感染,给予甘露醇治疗3 d,抗血栓治疗。术后48 h拔除引流管,拔管后行双下肢直腿抬高锻炼,术后2~3周作腰背肌锻炼,术后3~4周佩戴腰背支具下床活动。
1.4 疗效评定
临床效果评价,参照JOA腰痛手术评分系统进行评定,临床好转率RIS=[(术后评分-术前评分)/(29-术前评分)]×100%。优:RIS≥75%;良:50%≤ RIS≤74%;可:25%≤ RIS≤49%;差:RIS≤24%。
影像评价:依据椎间隙高度,滑脱距离以及椎间隙融合情况。
1.5 统计学分析
2 结果
2.1 临床疗效
所有患者获得随访,随访时间15~23个月,平均随访时间16个月,未次随访优良率92.6(优112例、良140例、可14例、差5例、死亡1例),滑脱复位率86.3%,椎间骨性融合率96.5%。典型患者手术前后X片图像,见图1。
2.2 手术前后疗效
表1可见,末次随访与术前比较,JOA评分,椎间隙高度,滑脱距离各项指标,差异均有统计学意义(P<0.05)。
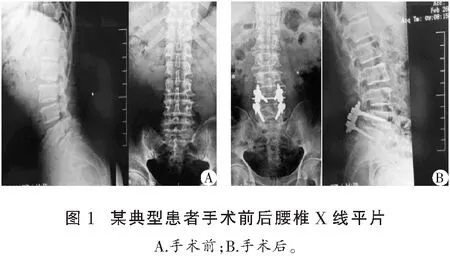
表1 患者手术前后疗效比较
观察指标手术前末次随访P值JOA腰痛评分(分)11.2±0.924.1±2.1<0.05椎间隙高度(mm)6.6±1.411.9±2.1<0.05滑脱距离(mm)17.6±5.41.0±0.6<0.05
3 讨论
3.1 治疗方式及手术适应症
目前对于腰椎滑脱症的治疗方式主要包括保守治疗和手术治疗。国外学者Matsunaga等[2]通过对滑脱患者的长期随访证实,多数滑脱患者经过保守治疗即可以获得明显疗效。国内多数学者也认为对于没有症状或症状轻微,滑脱程度较轻且无进展的患者应首先考虑保守治疗。虽然大多数患者可以通过保守治疗获得明显疗效,但仍有约10%的患者需要通过手术治疗来改善临床症状[3]。本组272例Ⅱ、Ⅲ度腰椎滑脱症患者,通过手术治疗,92.6%的患者消除症状。这一结果与国外学者Weinstein等[4]报道的13 个中心进行的对比研究结果一致,对于有持续症状和明确的影像学表现的腰椎滑脱患者手术疗效明显优于保守治疗。因为保守治疗对大多数患者是一种有效的治疗方案,所以在选择手术治疗方式时需要慎重考虑其适应症。目前对于腰椎滑脱的手术适应症国外较为认可的主要有一下几点[5-6]:(1)Ⅱ度以上的腰椎滑脱,顽固性下腰痛或下腰痛加剧,经保守治疗无效;(2)伴有腰椎间盘突出症或椎管狭窄症,出现下肢根性疼痛,间歇性跛行或马尾神经受压症状;(3)病程长,并有逐渐加重脱位趋势,影像显示滑脱程度加重者;(4)出现进行性神经损害患者。
3.2 手术方式
随着人们对腰椎滑脱这一疾病的认识不断加深以及对脊柱生物力学的研究,彻底减压、复位、固定融合被认为是腰椎滑脱症手术治疗的原则[7-9]。根据这一原则对腰椎滑脱症的手术治疗主要有以下几种方式[10],这些方式各有优缺点。(1)前路椎体间融合术(anterior lumbar interbody fusion,ALIF), Capener}在1932 年首次将ALIF 用于治疗脊椎滑脱,该术式通过前路椎间融合有效解决了节段失稳并通过恢复间盘高度复位滑脱,间接减压神经。同时该术式能更好的维持腰椎生理前凸,不干扰椎旁肌肉有效避免了术后椎旁肌萎缩,前路充分植骨也提高了椎间融合率,但是ALIF有内脏损伤、血管损伤、肾静脉血栓形成等风险及无法进行椎管减压的缺点。(2)后路椎间融合术(posterior lumbar interbody fusion,PLIF),该术式为目前使用较为广泛的方式,其通过椎弓根螺钉起到复位、固定作用,最大程度地保证脊柱的稳定性,可以直视下对椎管及神经根管进行彻底减压。在本组272例患者均采用后路手术方式,其复位及融合均取得了满意的结果,特别是对于215例椎体滑脱合并峡部裂患者,通过 PLIF术式取得了良好的疗效。(3)椎体环周360°融合术,即是后路椎间融合加后侧或后外侧植骨融合,这是近年来部分学者推崇的一种观念[12-13],他们认为该术式可以显著增强椎间的机械强度。在本组有15例患者采用了椎间融合结合后外侧融合的方式,末次随访时15例患者均达到了骨性融合。(4)极外侧椎间融合术(extreme lateral lumbar interbody fusion,XLIF),该术式为腹膜后前方椎间融合入路的改良,在2006 年由Ozgur 等[14]报道,该术式切口在棘突旁肌肉外侧缘,穿过腰大肌进入椎间盘,避免了ALIF 血管损伤等并发症,但是其仍存在无法实施椎管减压的缺点。(5)经椎间孔椎间融合术(transforaminal lumbar interbody fusion,TLIF)。近来采用经椎间孔融合术及微创手术[15-17],对于不能复位的腰椎滑脱仅作内固定、椎管神经根管减压、后外侧融合术,据术后随访资料显示也可以取得良好的疗效,同时微创手术具有术中出血少、减少术后疼痛、缩短住院时间等优势,易于被病人接受。
3.3 复位
对于滑脱复位的问题,目前国内外仍存在争议,部分学者[18]主张完全复位,以恢复脊柱三柱结构的稳定性及腰骶部的生物力学功能,解除椎管及椎间孔的狭窄,消除神经症状。但也有部分学者[19]认为治疗脊柱滑脱合并腰推管狭窄,最重要的是彻底广泛地减压以及牢固地固定和融合,滑脱的复位并非主要目的,脊柱滑脱拉紧后纵韧带,很好地对抗了椎间盘的变性膨出,是患者无明显根性症状的原因。复位后拉长的后纵韧带松驰,变性的椎间盘容易突出,均可造成新的脊髓神经压迫,因此对腰椎滑脱的复位宜采取慎重态度。张伟[20]等通过对Ⅰ或Ⅱ度的轻度滑脱患者进行对比研究发现,腰椎滑脱症两组治疗方法都有良好的疗效,复位组与未复位组在疗效方面无明显统计学差异。认为对于轻度腰椎滑脱症,可以选择不复位。本组272例患者均为Ⅱ度及以上患者,因此均进行了滑脱复位,术后平均16个月随访,其中完全复位115例,部分复位120例,未复位37例,复位率86.3%。特别注意的是,复位应适可而止,不一定追求解剖复位,因腰椎滑脱是长期形成的,其周围的关节囊、韧带、肌肉都发生萎缩,神经根也发生了短缩,如追求解剖复位可引起神经根牵拉伤,同时拉力螺钉在松质骨内的提拉力有限,如果再加用力,螺钉会松动。
3.4 内固定
随着椎弓根螺钉技术以及各种内固定器材的发展,大量的内固定材料被用于临床,对于单节段退变性腰椎滑脱患者是否应用内固定,目前争议较大。总的趋势是,应用内固定,增加融合率。部分学者[18]认为内固定可增加融合率,但不一定改善临床结果,且内固定后可能会加速相邻节段退变。但也有部分学者[18]认为使用椎弓根螺钉固定,不但可以明显提高融合率,且融合速度快,并很好地恢复了脊柱的序列,神经功能恢复也优于非固定组。在本组272例患者均行了内固定,其术后末次随访椎间融合率达到96.5%,临床效果优良率92.6%,总体手术效果与国外相关研究类似。腰椎滑脱的内固定器材有RF、Steffee、SoCon、GSS系统等,每种内固定器材各有其优点,适宜不同的患者。RF、SoCon、GSS系统为双节段复位固定,复位固定可靠,同时有纵向撑开作用,适宜各种滑脱患者。GSS系统的螺钉纵向剖面为圆柱形。螺纹深度自螺尖至颈部逐渐变浅,在其颈部趋于光滑,横向剖面为锥形,这种结构提拉复位力较强适宜Ⅲ度滑脱者。
3.5 减压及融合
对于腰椎滑脱的手术治疗,其疗效主要取决于术中减压是否彻底。术中减压的原则[18]是对引起神经症状的致压因素如增生的黄韧带、小关节、突出的椎间盘等进行减压。若为了追求彻底减压,术中盲目扩大减压范围必然会过多破坏脊柱后柱结构,从而导致脊柱稳定性减低,因此术中盲目扩大减压范围是不可取,但减压不彻底则难以获得近期的效果。因此对于减压范围的确定,需要主刀医师根据患者的临床症状、影像学表现以及术中情况来具体确定。需要强调的是腰椎滑脱患者以神经根减压放首位,神经根减压除了切除神经根管里的增生的关节突,黄韧带外还要摘除突出的椎间盘髓核组织。有部分极外侧型椎间盘突出[21],髓核组织在神经根管内,神经根管口外,并不在椎间盘的后外侧,若遗漏,会造成患者症状不缓解。本组272例患者术中均进行了椎管及神经根管减压,术后患者临床症状缓解非常明显,但仍然有4例患者术后症状缓解不明显甚至加重,其原因可能与患者神经根长期受压变性,减压后神经功能恢复不理想有关,但也不排除术中减压不够彻底这一原因。
融合是防止术后断钉断棒、防止再发脱位、症状复发的有力措施[22-25]。随着椎间融合器广泛应用于临床,其在恢复椎间隙高度、促进植骨融合方面起到了重要作用。本组病例作后外侧融合11例,椎间融合246例,椎间融合结合后外侧融合15例。单节段融融合251例,双节段融合21例。采用Cage椎间融合器211例,采用TFC融合器51例,为力求达到椎间骨性融合,认真准备植骨床和丰富的松质骨是融合成功的关键。
3.6 手术并发症的预防
腰椎滑脱手术治疗的并发症主要包括围手术期并发症及术后远期并发症。其中围手术期并发症包括:(1)术中出血,腰椎滑脱手术操作过程较为复杂,手术创伤大,术中剥离深,手术操作易造成大量失血,特别是术中进入椎管内操作时,易损伤硬膜外静脉丛,导致术中大量失血,我们的经验是进入椎管后若发现硬膜外静脉丛出血,立即用双极电凝烧灼所有硬膜外出血静脉丛,如有渗血可用明胶海绵及脑棉片压迫。值得注意的是术后引流也是患者失血的重要原因,因此在关闭切口前应仔细止血,术后密切观察记录术后引流情况,手术后次日复查患者血常规,了解患者血红蛋白情况,若有必要可考虑输血治疗,低血容量会影响脊髓神经功能的恢复[26]。(2)术中硬脊膜撕裂,腰椎滑脱手术在行椎管内减压时存在硬脊膜撕裂的风险,部分患者突入椎管的椎间盘组织可能与硬脊膜发生粘连,术中在分离粘连过程中可能撕裂硬脊膜,对于曾经有过腰椎手术病史,椎管内存在粘连的患者更容易出现硬脊膜的撕裂,硬脊膜撕裂若裂口较大,术中应予以修复。同时术后脑脊液漏是引起术后切口感染的一个重要原因,因此对术中有硬脊膜撕裂的患者术后应加强护理,注意观察术后引流情况及术后切口情况。(3)术中神经损伤,神经损伤包括术后出现神经根性疼痛、马尾综合征等,比较少见。在本组病例中有1例患者出现术后大小便失禁,行走困难,其发生原因主要与手术中减压和植骨时过度牵拉硬膜囊及神经根有关。因此在行腰椎滑脱手术减压及椎间植骨时操作一定要轻柔、仔细。(4)术后感染,手术切口感染常发生于术后3~5 d,术后感染的原因有许多,因此对于腰椎滑脱术后患者预防性使用抗生素是必要的,但对于患者的基础疾病的检查与控制也是不可忽视的,在本组病例中有1例患者,术前存在基础疾病糖尿病,术后切口感染及椎间隙感染,切口长期流脓不愈合,最终患者衰竭死亡。(5)术后下肢深静脉血栓形成,脊柱手术本身所带来的创伤、失血、脱水造成的血液浓缩,术后需绝对卧床休息及术后疼痛,肢体活动量明显减少,使下肢血流处于相对滞缓状态,这一系列危险因素导致下肢深静脉血栓的发生。曾有腰椎滑脱术后发生深静脉血栓、肺栓塞而死亡的病例报道[27-29]。本组病例我们常规对术后患者进行了抗血栓治疗,因此术后未发现明显的下肢的深静脉血栓形成的情况。术后远期并发症包括:(1)术后滑脱复位的丢失;(2)术后内固定松动、断裂;(3)假关节形成;(4)邻近节段的退变加速。患者术后远期并发症发生的原因多数与术后过早、过频、过度不恰当的活动有关。
采用后路减压、内固定、复位、椎间融合术可使92.4%的腰椎滑脱症患者消除症状。严格掌握病适应症,术中把神经根减压放首位,复位适可而止,术后加强护理、抗栓治疗等是清除死亡、减少手术并发症的重要措施。

