基于O型口蹄疫病毒VP21-33肽段增强VP1141-160肽段免疫原性的新型纳米颗粒疫苗研究
付丽新,唐冬梅,周 彪,刘香易,罗又才,严亨秀
口蹄疫(foot-and-mouth disease,FMD)是一种由口蹄疫病毒(foot-and-mouth disease virus,FMDV)引起的主要感染偶蹄动物的热性、急性、高度传染性疾病.该病可直接或间接地造成严重的经济损失,被世界动物卫生组织(OIE)列为A类传染病之首[1-4].疫苗接种是当前预防口蹄疫最可靠和有效的方法之一.基因疫苗具有稳定性高、保存时间长、易于生产且能够诱导机体产生免疫应答等优点,具有广阔的应用空间[5-6].
口蹄疫病毒是口蹄疫的致病原,口蹄疫病毒属小RNA病毒科口蹄疫病毒属,分为Asia1、SAT1、SAT2、SAT3、O、A和C7个血清型,各型间没有交叉反应[7-8].FMDV抗原位点由4种结构蛋白构成,分别为:VP1、VP2、VP3和VP4,其中VP1蛋白是结构蛋白中最重要的,它是唯一能够产生保护性中和抗体的结构蛋白[9-10].目前研究证明,口蹄疫病毒中至少3个中和抗原位点位于VP1上;从FMDV中分离出来的VP1蛋白可以诱导动物产生中和抗体,因此,VP1作为最主要的抗原位点,具有诱导动物产生中和抗体从而保护机体的作用[11].所以在FMD新型疫苗的研究中,VP1蛋白受到高度重视.在真核表达质粒载体中插入VP1基因,并将载有VP1基因的真核载体转染到受体细胞中,则外源基因产物就会被部分受体细胞表达出来.目前对VP2的研究较少,虽已有研究发现在A型口蹄疫病毒中VP2的1-33位氨基酸序列编码的蛋白能够增强VP1肽段的免疫原性[12],但对于O型口蹄疫中VP2肽段能否增强VP1肽段的免疫原性还未见报道.
DNA转染宿主细胞的效率是影响基因疫苗免疫作用的一个关键问题[13].传统的DNA转染系统包括病毒载体系统和非病毒载体系统[14].由于磷酸钙颗粒具有良好生物相容性、成本低、易配置和毒性低等优势,可作为一种安全有效的非病毒载体具有广阔的应用前景[15].此外,磷酸钙纳米颗粒保存时间长,同常用的载体阳离子脂质体相比,其制作简单,节约成本[16].
虽然口蹄疫基因疫苗的免疫应答机理还未研究清楚,但已有研究发现,载体质粒DNA可刺激机体CTL反应,而这是在蛋白疫苗的免疫反应中无法诱导的,并且还发现当抗原基因被翻译并通过递呈细胞递呈到免疫系统时,在基因疫苗的免疫中还出现B细胞反应和T细胞反应[17].
本实验分别构建两种分别含有VP1和VP2基因的重组质粒,并用磷酸钙将其包裹成纳米颗粒,作为基因疫苗免疫小鼠,分别应用ELISA方法检测小鼠血液中的中和抗体的变化,应用流式细胞术、免疫组化、MTT等方法检测小鼠各组织及血液中淋巴细胞的变化情况.从而发现各组小鼠之间细胞免疫水平和体液免疫水平的变化差异,来研究O型口蹄疫中VP2肽段能否增强VP1肽段的免疫原性及其可能的免疫机制.
1 材料与方法
1.1 材料与试剂 20只6周龄雄性BALB/c小鼠[批准文号:SCXK(川2008-24)],体重约为25 g,购自达硕生物科技有限公司;饲养于SPF级别动物房,温度:20℃,湿度:70°,小鼠自由饮水采食.HEK293细胞由四川大学生物治疗国家重点实验室馈赠.口蹄疫O型液相阻断ELISA抗体检测试剂盒购于兰州兽医研究所;CD4、CD8免疫组化抗体购于Abcam公司,CD3、CD4、CD8流式抗体购于BD公司.
1.2 O型FMDV中VP1和VP2重组基因真核表达载体的构建 在GenBank中(AF308157.1)查询猪O型口蹄疫病毒的VP1的141-160位和VP2的1-33位氨基酸的核苷酸序列,并将VP1与VP2的核苷酸序列用融合蛋白linker连接,并在已知核苷酸序列中加入起始密码子ATG、终止密码子TAA及EcoRⅠ和XhoⅠ的酶切位点GAATTC和CTCGAG,定义为基因VP1-VP2(如表1所示),并将该核苷酸序列委托公司合成,并重组到PUC57质粒中,将重组质粒命名为PUC57-VP1-VP2,并测序鉴定.然后采用PCR方法分别扩增VP1与VP2基因,并测序鉴定,然后同时用EcoRⅠ和XhoⅠ分别对扩增产物及真核表达载体PCDNA3.1进行双酶切反应,然后分别将酶切后的VP1与VP2基因与PCDNA3.1连接,构建成两种新的重组质粒,并命名为 Pc DNA3.1-VP1和 Pc DNA3.1-VP2.并分别进行酶切验证,PCR验证及测序验证.VP1上游引物:5′-TAGAATTCGGCACCATGACTAACAACGTGAGAGG-3.VP1 下 游 引 物:5′-GGGCTCGAGTTAGGGCAGAGTTCTTTC-3′.VP2 上 游引 物:5′-GGGGAATTCGCCACCATGGA-3′.VP2 下 游 引 物:5′-ATCTCGAGTCAAGTCACCCCGA CGCTA-3′.

表1 GenBank中查询的VP1141-160位和VP21-33位的核苷酸序列及设计合成的VP1-VP2序列(5′-3′)Tab.1 Sequences of peptide VP1141-160 and VP21-33 of FMDV serotype Owere from GenBank and the sequences of synthesized VP1-VP2
1.3 纳米颗粒制备及转染效率检测
1.3.1 磷酸钙纳米颗粒的制备 分别取10μg上述构建的重组质粒 PcDNA3.1-VP1,PcDNA3.1-VP2及含有荧光标记的Pc DNA3.1-GFP质粒先与150 μL 12.5 mmol/L CaCl2溶液混匀,静置5 min后,置于磁力搅拌器上,再分别逐滴加入150μL 12.5 mmmol/L Na2HPO4溶液,用10 mmmol/L柠檬酸钠溶液调p H至7.2,磁力搅拌器搅拌3 h.
1.3.2 纳米颗粒转染细胞 HEK293细胞,培养于含10%胎牛血清的DMEM细胞培养基,置于37℃恒温培养箱中,待细胞长至70%时,将细胞用胰酶消化后,铺于24孔板中,每孔细胞数为2×104.将包裹完成的含PcDNA3.1-GFP质粒的纳米颗粒按照每孔2μg质粒的量加入到细胞中,同时加500 μL全培养基;并设立阴性对照组,对照组每孔加入2μg没有包裹成纳米颗粒的裸露的质粒PcDNA3.1-GFP,加入500μL全培养基;12 h后,更换新全培养基;转染48 h后,用荧光倒置显微镜检测两组细胞转染效率.
1.4 VP1和VP2重组基因疫苗的免疫学研究
1.4.1 重组基因疫苗免疫 取25只6周龄雄性BALB/c小鼠随机分为5组,每组5只,分别为:PBS对照组;Pc DNA3.1空质粒对照组;Pc DNA3.1-VP1 组;PcDNA3.1-VP2 组;PcDNA3.1-VP1+PcDNA3.1-VP2组.PBS组每只小鼠每次肌肉注射灭菌的PBS 200μL,其余各组小鼠肌肉注射相对应的纳米颗粒包裹的基因疫苗,每只小鼠每次注射质粒DNA 20μg(200μL),共免疫3次,分别为第0、7 d和21 d,在第一次免疫后的第0、7、14、21、28 d采血,收集血清,置于-80℃保存.
1.4.2 中和抗体检测 小鼠于初次免疫后的第0、7、14、21、28 d分别断尾采血100μL,4℃3 000 r/min离心10 min,收集血清.用口蹄疫O型液相阻断ELISA抗体检测试剂盒按照其说明书所述方法检测所取血清中的抗体滴度.
1.4.3 流式细胞术 各组小鼠于初次免疫后的第28 d,眼球摘除取血后颈椎脱臼处死.分别取各组小鼠淋巴结组织、脾脏组织,一部分用于免疫组化分析,另一部分制备成为单细胞悬液,1 500 r/min离心3 min,弃上清,PBS重悬细胞沉淀.小鼠眼球摘除取血,取20μL抗凝的全血样本置于流式管内.淋巴结、脾脏的单细胞悬液和外周血中加入流式抗体CD3e-PE、CD8a-FITC、CD4-precp各1μL,冰浴30 min后,外周血中加入2 m L红细胞裂解液,室温裂解5 min后,300 g离心5 min,弃上清,PBS洗两次,再用500μL PBS重悬,上机检测.先用空白细胞调节流式细胞仪的前向散射(FSC)与侧向散射(SSC),使细胞能集中分布于视野中央;再分析样品.
同步碎石封层技术主要采用的是沥青胶和颗粒性石料搭配使用的方法,通过专业车辆的反复碾压后,使得石料于地面充分结合,粘合度高,使得整体路面的使用寿命大大增高,具有很强的持久性。并且相较于传统铺路技术来说,同步碎石封层技术由于其操作方法较简单,使得其操作时间较短,不会对正常的路面使用造成很大的影响,极大的迎合了社会城市化发展的需求,有助于路面使用实现可持续利用。
1.4.4 免疫组化分析 于小鼠初次免疫后的第28 d,分别取各组小鼠淋巴结和脾脏组织置于4%的多聚甲醛中固定24 h;然后脱水、透明包埋成蜡块,用石蜡切片机4μm连续切片.淋巴结和脾脏组织石蜡切片分别用CD4和CD8抗体染色,然后用苏木素染色细胞核.光学显微镜下观察阳性细胞,以细胞膜出现黄棕色颗粒且染色强度明显高于背景的非特异性染色为阳性细胞,在×10目镜×40物镜下,每个组织随机选取5个视野,计数每个视野中的CD4或者CD8阳性细胞数.
1.4.5 淋巴细胞增殖实验 小鼠免疫后第28 d,眼球摘除取血后,颈椎脱臼处死.取全血并分离小鼠外周血单个核细胞(PBMCs).将PBMCs接种至96孔板中,每孔5×104个细胞;再分别在每孔中按1∶100的量加入FMDV灭活疫苗,每孔设3个复孔及对照孔,对照孔内只接种细胞,不加病毒抗原.将96孔板置于细胞培养箱中37℃恒温培养45 h;在终止培养前3 h,每孔加20μL MTT溶液(5 mg/m L),继续培养3 h,终止培养后,96孔板2 500 r/min离心20 min,小心吸除孔内上清液,每孔内加入150μLDMSO,置于摇床上震荡20 min,使结晶物充分溶解.比色:在酶标仪上选择570 nm波长测定各孔光吸收值.结果判定:增殖结果用SI值表示.SI值为致密孔细胞的光吸收值与其相对应空白孔的光吸收值的比值.
1.5 统计学分析 实验数据均以均数±标准差(x±s)表示,应用SPSS 16.0统计软件进行统计学分析,率的比较采用方差分析,以P<0.05为有统计学意义.
2 结 果
2.1 重组质粒 PcDNA3.1-VP1和 PcDNA3.1-VP2鉴定 目的基因VP1和VP2片段分别用PCR扩增后,再分别与真核表达载体连接转化,在涂有Amp的琼脂糖平板上随机挑取菌落提取质粒DNA后做酶切分析鉴定.琼脂糖凝胶电泳结果显示在两种新构建的重组质粒中可分别酶切出VP1(84 bp)或VP2(123 bp)片段,表明VP1和VP2片段已被分别重组到真核表达载体PcDNA3.1中,即重组质粒构建成功(图1B、D).为进一步确定是否将目的基因VP1和VP2连接进入真核表达载体PcDNA3.1中,分别用设计好的两段基因的引物,在酶切分析鉴定正确的质粒中用PCR方法扩增两段基因,PCR结果显示,在酶切正确的两种质粒中可分别扩增出VP1或VP2片段,即证明重组质粒构建成功(图1A、C).为确定重组质粒中目的基因核苷酸是否发生突变,取经鉴定为VP1和VP2阳性的克隆送美吉公司测序,结果一致性为100%,核苷酸序列没有改变.
2.2 纳米颗粒转染效率 用制备好的含有PcDNA3.1-GFP质粒的纳米颗粒转染 HEK293细胞,48 h后,荧光显微镜下检测转染效率,每组细胞镜下随机选取5个视野,计算每个视野的转染效率.用磷酸钙纳米颗粒包裹的荧光质粒转染细胞的转染率(28±2.1)%,用裸露的荧光质粒转染细胞,荧光显微镜下观察不到荧光,即转染率为(1.71±0.05)%,见图2.
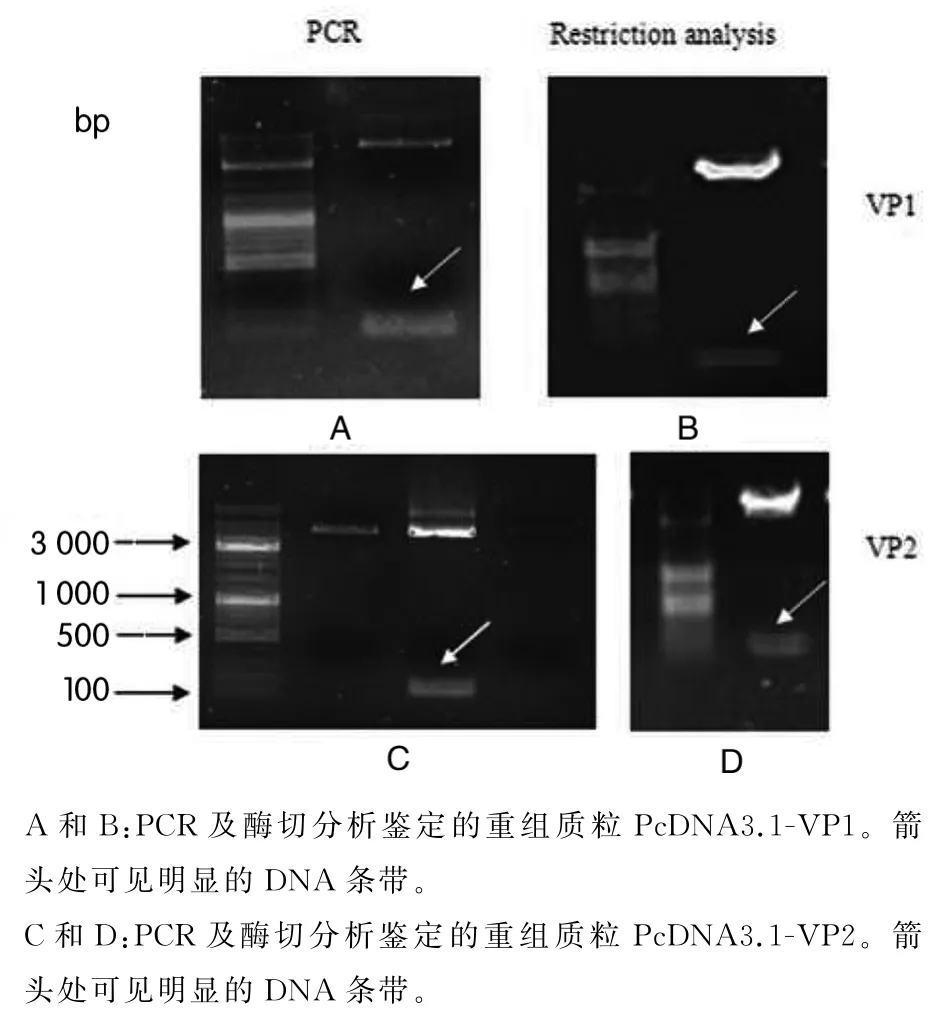
图1 鉴定重组质粒PcDNA3.1-VP1和PcDNA3.1-VP2Fig.1 PCR and restriction analysis of recombinant plasmids
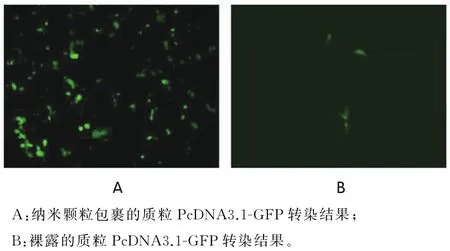
图2 磷酸钙纳米颗粒包裹质粒PcDNA3.1-GFP转染HEK293细胞Fig.2 Transmission fluorescence microscopy(magnification 40×)of HEK293 cells transfected with GFP gene construct
2.3 VP2可提高免疫小鼠的中和抗体滴度 抗体滴度是检测口蹄疫疫苗是否能够发挥保护作用的重要指标.本实验在小鼠第一次免疫后的第0、7、14、21、28 d分别采取小鼠外周血,收集血清,应用口蹄疫O型液相阻断ELISA抗体检测试剂盒检测小鼠血清中的抗体滴度.
检测时设立4孔病毒抗原对照,阳性血清对照与阴性血清对照.应用酶标仪检测每孔在492 nm下的吸光值.抗原对照的4孔中,弃去最高孔和最低孔吸光值,将剩余两孔的平均吸光值除以2定为临界值,表示阻断50%反应的对照吸光值.将被检血清吸光值大于该临界值的孔定为阴性孔,小于或等于临界值的孔定为阳性孔.阳性孔的最高稀释倍数为被检血清的抗体效价.抗体效价大于等于1∶64(Log10≥1.8)时,99%以上保护;小于1∶4(Log10<0.6)时,不保护;介于1∶4和1∶45之间(Log10在0.6与1.65之间)时,50%保护.
图3 各组小鼠初次免疫后第0、7、14、21和28 d血清中抗体水平检测Fig.3 Antibody responses measured at day 28 after immunization by LPB-ELISA(∗P<0.05)
实验结果如图3所示,VP1与VP2共同免疫小鼠在初次免疫后的第28 d,平均抗体效价大于1∶64(Log10>1.8),即对口蹄疫病毒有99%以上的保护;显著高于其他各组(F=4.625,P<0.05).而VP1单独免疫小鼠在初次免疫后的第7、14、21和28 d外周血中的平均抗体滴度在1∶16与1∶45之间,即该组小鼠免疫后对O型口蹄疫病毒有50%的保护作用;VP2单独免疫小鼠及对照组小鼠0~28 d外周血平均抗体滴度均小于1∶4即对于O型口蹄疫病毒无保护作用.
2.4 VP2可显著增加免疫后小鼠的CD8+、CD4+T淋巴细胞 有研究发现,抗原进入机体后与淋巴细胞最终是在外周淋巴器官内相遇,如淋巴结、脾以及黏膜相关的淋巴组织;在骨髓和胸腺中发育成熟但尚未接触特异性抗原的淋巴细胞不断地从血液循环中挤过毛细血管壁的细胞间隙进入外周淋巴组织,然后又通过淋巴管返回到血液,或在脾中直接回到血液[18].在口蹄疫的预防和治疗中,T淋巴细胞反应起到了很重要的作用.在本实验中,通过流式细胞术、免疫组化方法分析免疫后小鼠血液、脾脏和腹股沟淋巴结组织中CD8+、CD4+T淋巴细胞数.
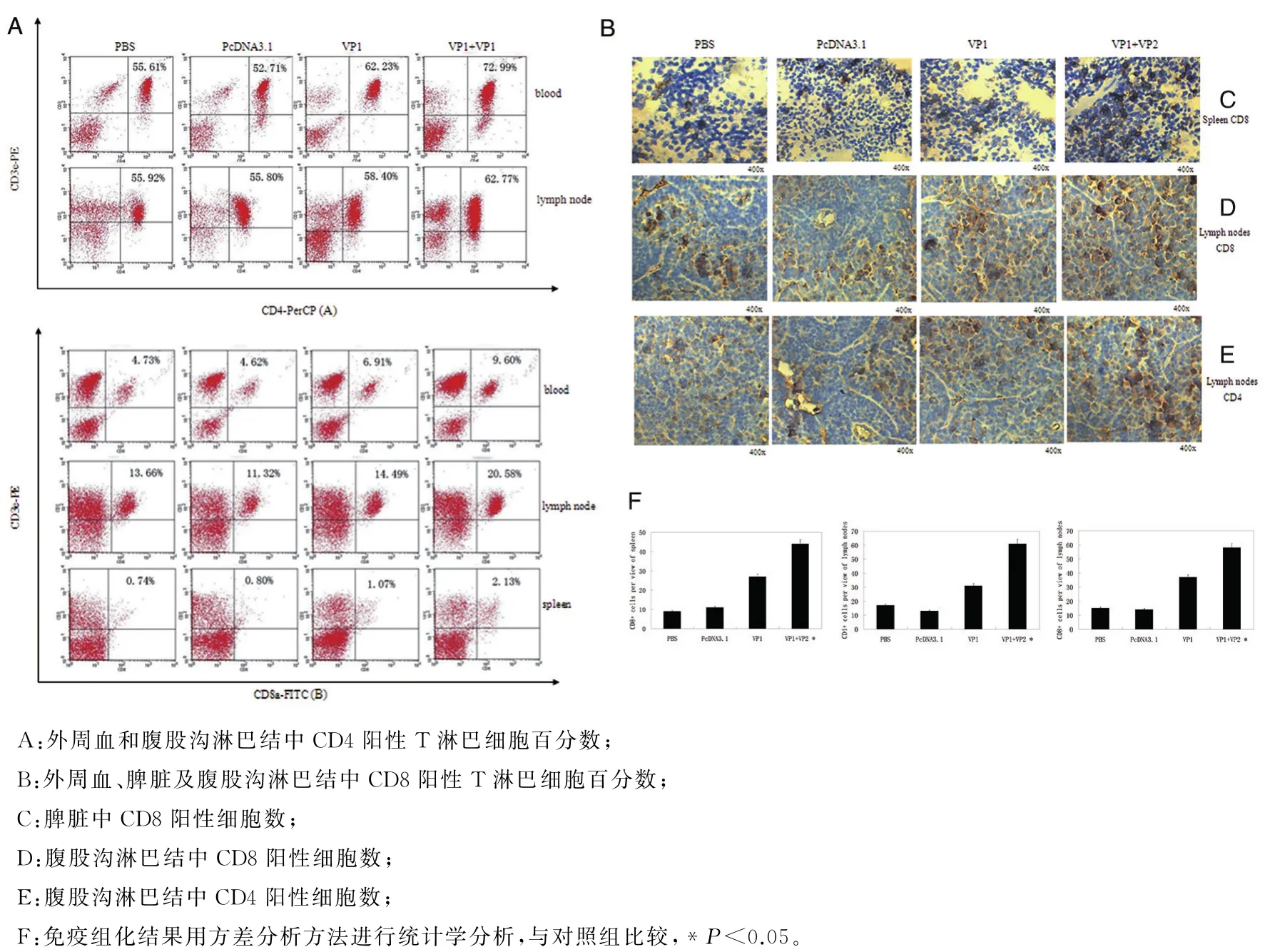
图4 VP2可显著增加小鼠免疫组织的T淋巴细胞数Fig.4 CD4+ and CD8+ T lymphocytes were significantly increased after vaccinated with CaPi-PcDNA3.1-VP1+CaPi-PcDNA3.1-VP2
如图4(A)流式细胞术检测结果所示,小鼠免疫28 d后,VP1和VP2共同免疫组小鼠腹股沟淋巴结、脾脏和血液中CD8+T淋巴细胞数,与VP1单独免疫组,PcDNA3.1组和PBS对照组相比,显著增多(F=35.07,P<0.05;F=54.97,P<0.05;F=12.66,P<0.05);VP1和VP2共同免疫组小鼠腹股沟淋巴结和血液中CD4+T淋巴细胞数,与VP1单独免疫组,PcDNA3.1组和PBS对照组相比,显著增多(F=40.84,P<0.05;F=174.1,P<0.05).
流式细胞术分析后,取脾脏和腹股沟淋巴结进一步进行免疫组织化学染色,分析各组小鼠脾脏和淋巴结中CD4和CD8阳性T淋巴细胞的差异,并进行统计学分析.如图4(B)免疫组化结果所示,小鼠免疫28 d后,VP1和VP2共同免疫小鼠脾脏中CD8阳性细胞数与VP1单独免疫组,PcDNA3.1组和PBS对照组相比,显著增多(F=302.7,P<0.000 1);VP1和VP2共同免疫小鼠腹股沟淋巴结中CD8阳性细胞数和CD4阳性细胞数与VP1单独免疫组,PcDNA3.1组和PBS对照组相比,显著增多(F=469.5,P<0.000 1;F=372.5,P<0.000 1),结果均有统计学差异;免疫组化实验结果与流式细胞术实验结果一致.
2.5 VP2增强免疫小鼠的T淋巴细胞增殖能力T细胞在接触抗原后可转化成T淋巴母细胞,并可以进一步的分化增殖成致敏T淋巴细胞,执行细胞免疫功能,不仅可以直接发挥免疫效应的功能,还可通过产生细胞因子和表达粘附分子而与其他的免疫细胞进行直接或者间接接触,发挥广泛免疫调节作用.T淋巴细胞的增殖反应程度可以反映出T淋巴细胞免疫功能状态.
图5 小鼠外周血中T淋巴细胞增殖实验Fig.5 The stimulation index(SI)difference among the different groups
如图5所示,淋巴细胞增殖实验结果发现VP1单独免疫小鼠的外周血的T淋巴细胞增殖率显著高于VP2单独免疫组及对照组;同时发现VP1和VP2共同免疫小鼠的外周血的T淋巴细胞增殖率显著高于VP1组(F=12.73,P<0.05).T淋巴细胞增殖率可以反映细胞免疫水平,说明VP1和VP2共同免疫小鼠细胞免疫水平明显好于其他各组.
3 讨 论
基因疫苗具有免疫期长,安全性好,成本低,易于构建等优点,尤其是基因疫苗既可诱导体液免疫反应又可诱导细胞免疫反应,被认为免疫学的第2次革命[19].基因疫苗为细菌、寄生虫和病毒等变态反应性疾病、肿瘤以及自身免疫病的治疗等提供了新的方法.
FMDV病毒衣壳由4种结构蛋白构成,分别为:VP1、VP2、VP3和VP4.VP1蛋白是结构蛋白中最重要的,它是唯一能够产生保护性中和抗体的结构蛋白[9].VP1位于病毒颗粒表面,被胰蛋白酶处理后病毒粒子会失去感染敏感细胞的能力.目前研究证明,口蹄疫病毒中至少3个中和抗原位点位于VP1上.因此,VP1作为最主要的抗原位点,具有诱导动物产生中和抗体从而保护机体的作用.VP1是最重要的抗原蛋白,所以在FMD新型疫苗的研究中,VP1蛋白受到高度重视.在真核表达质粒载体中插入VP1基因,并将载有VP1基因的真核载体转染到受体细胞中,则外源基因产物就会被部分受体细胞表达出来.在后期的研究中发现,VP1中决定了免疫原性的主要的抗原表位是141-160和200-213位氨基酸残基[20-21].应用化学方法合成的肽段仍具有免疫原性,并且如果将这些肽段多拷贝串联后,其免疫原性增强.口蹄疫病毒的4种结构蛋白中,VP2相对保守.因此用VP2作为抗原检测FMD抗体具有其自身的一些优点.目前对VP2的研究较少,但已有研究发现在A型口蹄疫病毒中VP2的1-33位氨基酸序列编码的蛋白单独免疫不具有免疫原性,但当与VP1肽段共同免疫时能够增强VP1肽段的免疫原性[12].
本实验构建的重组质粒PcDNA3.1-VP1包含O型口蹄疫病毒的VP1的141-160位氨基酸序列,重组质粒PcDNA3.1-VP2包含VP2的1-33位氨基酸序列.分别用单独的重组质粒PcDNA3.1-VP1,或者重组质粒PcDNA3.1-VP1和PcDNA3.1-VP2,共同免疫小鼠,检测小鼠各组织的免疫效应,从而探讨是VP2肽段能否提高VP1肽段的免疫原性及其可能的免疫机制.
目前有研究认为,最能够有效地摄取外源基因来表达抗原蛋白的组织是肌肉组织,肌肉组织具有很多优点,如体积大、安全、免疫接种容量大等,因此,基因疫苗免疫机体时常选用肌肉注射免疫方式.为了简化免疫程序并能够有效地诱导免疫反应,本实验选择肌肉免疫方式,根据用重组质粒免疫小鼠后均能够诱导抗体反应和细胞免疫的结果,证明了肌肉免疫的优势.也说明了本实验所构建的重组真核表达载体质粒免疫动物后能够在体内表达FMDV衣壳蛋白.
口蹄疫抗体滴度检测结果显示,ELISA检测结果发现 PcDNA3.1-VP1+PcDNA3.1-VP2共同免疫的小鼠血清中的平均抗体滴度均在初次免疫后的第28 d达到最高,对口蹄疫病毒可产生99%以上的保护力,显著高于只用重组质粒PcDNA3.1-VP1免疫的小鼠以及对照组小鼠的抗体滴度以及保护力水平.由此可说明,在本实验中,VP2肽段可增强VP1肽段刺激产生抗体水平的能力,抗体的产生与B淋巴细胞的活化有关,而B淋巴细胞主要参与的是体液免疫反应,即可说明VP2肽段可增强VP1肽段的体液免疫反应.
T细胞在接触抗原后可转化成T淋巴母细胞,并可以进一步的分化增殖成致敏T淋巴细胞,执行细胞免疫功能,不仅可以直接发挥免疫效应的功能,还可通过产生细胞因子和表达粘附分子而与其他的免疫细胞进行直接或者间接接触,发挥广泛免疫调节作用.T淋巴细胞的增殖反应程度可以反映出T淋巴细胞免疫功能状态.常用的检测淋巴细胞增殖反应强度的实验方法为MTT法.细胞能量代谢水平可采用MTT法检测,活细胞特别是增殖期的细胞能量代谢旺盛,MTT(四甲基偶氮唑盐)可被线粒体在能量代谢中可产生琥珀酸脱氢酶由淡黄色还原为蓝紫色结晶,沉积在细胞周围和细胞内,增殖细胞数与结晶的形成成正比.本实验采用MTT法检测免疫后小鼠外周血中T淋巴细胞增殖情况.结果显示淋巴细胞增殖实验结果显示PcDNA3.1-VP1+PcDNA3.1-VP2共同免疫的小鼠淋巴细胞增殖能力均显著高于PcDNA3.1-VP1免疫的小鼠以及对照组小鼠.由此可说明VP2肽段可增强VP1肽段所诱发的T淋巴细胞增殖能力,T淋巴细胞主要参与的是细胞免疫反应,即可说明VP2肽段可增强VP1肽段的细胞免疫反应.
有研究证明,在没有抗体的情况下,基因疫苗诱导产生的细胞免疫反应具有抗病毒感染的作用.基因免疫也可诱导体液免疫产生中和抗体,提供抗病毒感染的保护作用.通过对本实验中接种重组基因疫苗的小鼠血清中口蹄疫抗体水平和各免疫组织中T淋巴细胞增殖反应的结果分析,说明在基因疫苗发挥免疫保护能力过程,除了能够产生特异性抗体的体液免疫反应外,T淋巴细胞介导的细胞免疫反应也发挥了重要作用.
CD4+T淋巴细胞可被主要组织相容性复合物(MHCⅡ)递呈的多肽抗原反应所激活,从而激活辅助性T细胞与B细胞产生体液免疫反应;CD8+T淋巴细胞可通过MHCⅠ与抗原结合诱导机体产生细胞免疫反应.本实验分别采用流式和免疫组化染色方法检测免疫后小鼠的血液、脾脏和腹股沟淋巴结中CD4+T淋巴细胞和CD8+T淋巴细胞的变化.结果显示 PcDNA3.1-VP1+PcDNA3.1-VP2共同免疫的小鼠血液和淋巴结中CD4+、CD8+T淋巴细胞数、脾脏中的CD8+T淋巴细胞数均高于PcDNA3.1-VP1免疫的小鼠以及空质粒对照组和PBS对照组小鼠.由此可推断VP2肽段能够增强VP1诱发体液免疫和细胞免疫水平,其机制可能是VP2肽段通过激活机体免疫组织和血液中的CD4+、CD8+T淋巴细胞而提高VP1肽段的免疫原性.
本实验研究发现PcDNA3.1-VP1与PcDNA3.1-VP2共同免疫的小鼠细胞免疫水平和体液免疫水平均显著高于用只含有VP1肽段免疫的小鼠以及空质粒对照组和PBS对照组小鼠.说明相对于单独的VP1基因疫苗,无论是VP1与VP2两种基因疫苗共同作用后能够诱发机体更强的免疫反应,提示O型FMDV VP2的1-33肽段能增强VP1的免疫原性,其可能通过激活CD4+、CD8+T淋巴细胞诱导的体液免疫和细胞免疫实现.
——一道江苏高考题的奥秘解读和拓展

