基于液相色谱串联质谱技术对血清同型半胱氨酸常规检测系统的正确度评价
钟巧玲, 孙 骥, 翁旭琦, 冯 萍, 谢丹芸
(1. 重庆市巴南区第二人民医院检验科,重庆 400054;2.宁波出入境检验检疫局技术中心,浙江 宁波 315000;3. 美康生物参考实验室,浙江 宁波 315104)
同型半胱氨酸(homocysteine,Hcy)是一种含硫氨基酸,存在于血液及组织中,是人体内蛋氨酸循环的中间代谢产物,参与体内能量代谢[1]。正常情况下,人体中的Hcy水平为5~15 μmol/L,是正常的代谢中间产物[2]。近年来,有临床研究证实,Hcy水平与血脂水平变化、各种心脑血管疾病及其并发症的发生和发展以及转归有重要关系[3-4]。高水平Hcy与老年痴呆、肿瘤的发生和发展有密切关系,其可作为血清肿瘤标志物用于肿瘤诊断或疗效判断[5-7]。因此,及时、准确、高效地检测血液中Hcy水平具有重要意义。
目前,用于Hcy检测的方法较多,有酶循环法、气相色谱-质谱联用法(gas chromatographymass spectrometry,GC-MS)、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、放射免疫分析法、高效液相色谱(high-performance liquid chromatography,HPLC)、全自动荧光偏振免疫法及液相色谱串联质谱(liquid chromatography-tandem mass spectrometry,LC/MS/MS)等,这些方法各自存在不同的优势和不足[8-12]。其中,GC-MS和同位素稀释液相色谱串联质谱法(isotopedilution liquid chromatography-tandem mass spectrometry,ID-LC/MS/MS)被检验医学溯源性联合委员会(the Joint Committee for Traceability in Laboratory Medicine,JCTLM)认定为参考方法[13],这2种方法特异性强、敏感性高、重复性好,但设备昂贵且操作复杂、耗时较长。HPLC应用广泛,费用较低。放射免疫分析法灵敏度高、特异性强,但操作繁琐,且同位素的放射污染对人体有害。酶循环法检测快速,适用于全自动生化分析仪,无需样本预处理。因此,本研究以ID-LC/MS/MS为比对方法,评价酶循环法测定血清Hcy水平的正确度,为临床常规检测血清Hcy的正确性提供依据;并通过与参考方法比对,调整常规检测系统,保证常规检测系统的测定结果与参考方法一致,以提高常规临床检测的质量。
1 材料和方法
1.1 样本
美国国家标准和技术研究院(the National Institute of Standards and Technology,NIST)SRM 1950标准物质,20份新鲜单人份血清样本,5个水平的Hcy工作校准品。
1.2 仪器与试剂
AB SCIEX QTRAP 5500液相色谱串联质谱系统购自美国AB SCIEX公司,XS 205DU型电子分析天平购自瑞士METTLER TOLEDO公司,Eppendorf 移液器、5427R 高速冷冻离心机、Heidolph Multi Reax旋涡混合器均购自德国Eppendorf AG公司,Millipore超纯水仪购自美国Millipore公司。Hcy-d4内标购自美国Iso Sciences公司,DL-二硫苏糖醇和三氟乙酸购自美国Sigma公司,甲醇(色谱级)、甲酸(色谱级)、乙腈(色谱级)购自美国Thermo Fisher公司。7180全自动生化分析仪(日本日立公司)及配套试剂(酶循环法)、校准品。实验用水为一级水。
1.3 ID-LC/MS/MS
1.3.1 样本前处理 用重量法称取样本或标准物质于离心管中,分别加入内标、乙腈溶液,旋涡混合离心后取上清液100 μL,用甲醇水溶液稀释至1 mL,混匀后检测。
1.3.2 测定条件 (1)液相色谱条件:流动相A为0.1%甲酸甲醇溶液,流动相B为0.1%甲酸水溶液,流速为0.5 mL/min,进样量为3 μL,柱温为30 ℃,梯度洗脱;(2)质谱分析条件:电喷雾电离源,离子化电压为5 500 V,气帘气为35 psi,碰撞气强度为中等,雾化温度为550 ℃,雾化气为55 psi,辅助加热气为40 psi,多反应监测模式扫描分析,峰面积定量。
1.3.3 样本检测 采用ID-LC/MS/MS检测NIST SRM 1950标准物质、5个水平的Hcy工作校准品和20份新鲜单人份血清。
1.4 酶循环法
采用7180全自动生化分析仪及配套试剂测定5个水平的Hcy工作校准品和20份新鲜单人份血清。
1.5 统计学方法
采用Excel 2013软件和Origin 8.1软件进行统计分析。以ID-LC/MS/MS作为比对方法,评价Hcy常规检测系统测量结果的正确度。采用改良Bland-Altman图形分析法评价常规方法(酶循环法)与比对方法之间的偏移。
2 结果
2.1 ID-LC/MS/MS的正确度验证
NIST SRM 1950标准物质证书给出的Hcy水平为(8.50 ± 0.20)μmol/L。采用ID-LC/MS/MS检测NLST SRM 1950标准物质,测定结果与证书一致,相对偏移<1.0%。见表1。

表1 ID-LC/MS/MS检测NIST SRM 1950标准物质的结果
2.2 酶循环法与ID-LC/MS/MS的比对
采用ID-LC/MS/MS和酶循环法同时检测20份新鲜单人份血清。以ID-LC/MS/MS测定结果为X轴,酶循环法测定结果为Y轴,进行方法学比对。2种方法的线性拟合方程为Y=1.204 1X+0.364 6(r2=0.987 9)。见图1。
采用改良Bland-Altman图形分析法进行分析,2种方法的测定结果不一致,酶循环法测定结果整体偏高,平均偏移为24.0%。见图2。
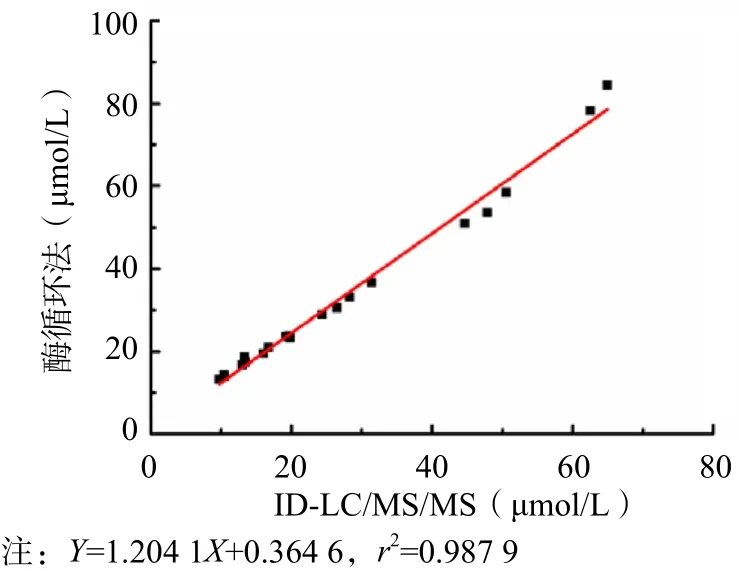
图1 酶循环法与ID-LC/MS/MS测定结果的比较
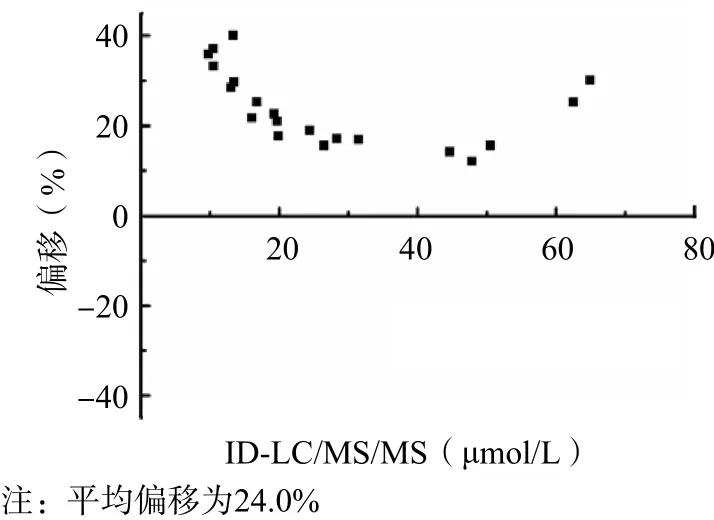
图2 酶循环法与ID-LC/MS/MS的Bland-Altman偏移图
2.3 酶循环法常规检测系统的调整
采用ID-LC/MS/MS和酶循环法同时检测5个水平的Hcy工作校准品,并根据测定结果调整酶循环法试剂盒的校准品值。调整结果后的测定结果见表2。以ID-LC/MS/MS测定结果为X轴,以酶循环法测定结果为Y轴,进行方法学比对。调整后的酶循环法与ID-LC/MS/MS的线性拟合方程为Y=0.988 6X+0.260 3(r2=0.999 7)。见图3。
采用改良Bland-Altman图形分析法进行分析,经校准品值调整后,酶循环法的测定结果与ID-LC/MS/MS一致,平均偏移为-0.09%。见图4。

表2 酶循环法调整后与ID-LC/MS/MS测定结果的比较

图3 酶循环法调整后与ID-LC/MS/MS法结果比较
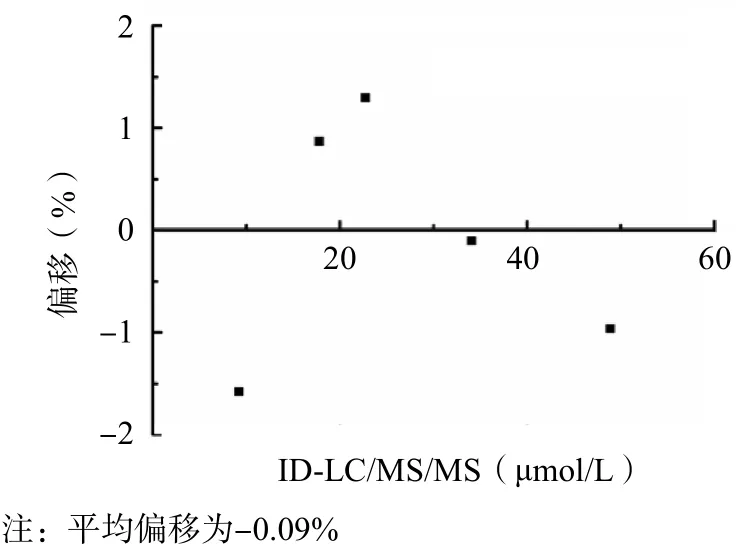
图4 调整后的酶循环法与ID-LC/MS/MS的Bland-Altman偏移图
3 讨论
Hcy水平的变化是多种疾病诊断的依据。目前,血清Hcy水平多采用全自动生化分析仪进行检测。因此,为确保临床检测结果的准确性,有必要对Hcy的常规检测系统进行正确度评价。
Hcy的检测方法有很多。本研究对临床上使用比较广泛的酶循环法进行了评价。首先对JCTLM推荐的参考方法——ID-LC/MS/MS进行了正确度评价,结果显示ID-LC/MS/MS测定NIST SRM 1950标准物质的结果与标准证书标示值的偏移<1.0%,准确性良好。因此,ID-LC/MS/MS可作为Hcy常规检测系统正确度评价的比对方法。
采用酶循环法和ID-LC/MS/MS同时检测20份血清样本的Hcy水平。常规方法的正确度依据线性拟合方程斜率k=1.00±0.02且截距接近于0、设定偏移值并用改良Bland-Altman图形分析法进行判断。酶循环法和ID-LC/MS/MS测定结果的线性拟合方程为Y=1.204 1X+0.364 6(r2=0.987 9),平均偏移达24.0%。由此说明常规方法和参考方法测定结果的相关性并不理想,2种方法存在较大的偏移,为保证临床检测结果的准确性,需对其检测系统进行校正。
采用ID-LC/MS/MS和酶循环法同时测定5个水平的工作校准品,根据测定结果反复调整校准品值,直至酶循环法的测定结果与ID-LC/MS/MS一致。调整后的酶循环法与ID-LC/MS/MS的线性拟合方程为Y=0.988 6X+0.260 3(r2=0.999 7),平均偏移为-0.09%。由此可见,酶循环法调整后的测定结果与ID-LC/MS/MS的测定结果达到了一致。
综上所述,采用酶循环法测定血清Hcy水平的正确度难以保证。因此,需要利用参考方法对常规检测系统进行正确度评价,同时也可以利用参考方法校准常规检测系统,以有效保证临床样本测定结果的正确性,提升临床检测质量。为保证临床样本的准确测定,各厂家和临床实验室应建立常规检测项目的测量正确度评价方法,以保证常规检测系统的正确性[14]。

