花生黄曲霉毒素污染拮抗菌B25-5的筛选、鉴定及控制效果
杜瑞焕 高素艳 张 谊 姚彦坡
(农业部农产品质量安全风险评估实验站;唐山市畜牧水产品质量监测中心,唐山 063000)
黄曲霉毒素是一类由黄曲霉 (A.Flavus) 和寄生曲霉 (A.Parasiticus)产生的强致癌、剧毒性真菌毒素,包括B、G和M族,其中B1最普遍且毒性最强,为氰化钾的10倍、砒霜的68倍,致癌力为六六六农药的10 000倍,人或动物食用受毒素污染的农产品和食品后会导致机体病变甚至死亡,严重威胁消费者健康与生命安全[1]。黄曲霉毒素主要污染花生、玉米等农产品,给我国农产品和食品安全带来严重威胁[1-2]。因此,消除花生等农产品中黄曲霉毒素污染,减轻其对人畜的不良影响,降低其代谢产物在农产品及畜禽产品中的残留,保证农产品质量安全,是当前农业生产研究的热点之一[3-6]。
花生黄曲霉毒素污染的防控重在源头治理,目前,防控花生等农产品中黄曲霉菌侵染及毒素污染过程中以化学防治为主。由于化学防治成本较高和易污染环境,而且产毒黄曲霉易对杀菌剂产生抗药性,所以,寻找一种对人畜健康、对环境友好的控制措施势在必行[7-8]。花生荚果内拮抗细菌分布广、种类多、数量大,在长期进化过程中,与作物建立了密切关系,其中有些细菌具有抑制病原菌、促进植物生长、增强植株抗逆性、增殖和扩散快等优点,因而成为发展前景很好的病原微生物生防菌[8]。本文以产毒黄曲霉及毒素为研究对象,从花生中分离有益微生物,并采用活体方法筛选拮抗细菌,研究拮抗菌的抗菌活性,以期探索解决花生黄曲霉毒素污染的防控瓶颈问题途径。
1 材料与方法
1.1 供试菌株
产毒黄曲霉由中国农业科学院油料作物研究所质标室/农业部生物毒素检测重点实验室提供。有益微生物从采自河北省滦南、滦县、迁西、迁安、玉田及丰南等主产区县的健康花生荚果中分离获得。
1.2 花生中细菌的分离、纯化与保存
花生中细菌的分离参照Dey等[7]的方法。选取上述区县主产区的花生荚果,带回实验室分离。在超净工作台中将花生荚果用1%次氯酸钠溶液浸泡10 min,再用无菌水冲洗5次,沥干水分。用研钵研碎后放置于牛肉膏蛋白胨培养基平板中,于28℃恒温培养,每天观察菌落生长状况,并及时挑取特征差异明显、分离良好的单菌落,进一步纯化获得纯菌株,在牛肉膏蛋白胨斜面培养基上保藏备用。
1.3 产毒黄曲霉拮抗细菌的离体筛选
采用对峙培养法对黄曲霉拮抗细菌进行筛选。将预先准备好的黄曲霉菌菌碟置于PDA平板中央,然后用高温灭菌的牙签蘸取内生细菌,等距离(距病原菌2 cm处)对称点接到PDA平板上,于28 ℃黑暗培养,3~7 d观察抑菌带的有无及大小,重复3次。选出抑菌带大于5 mm的内生细菌菌株在花生仔仁上进行复筛及计算抑制率。抑制率=(对照生长量-处理生长量)/对照生长量×100%。
1.4 产毒黄曲霉拮抗细菌的活体筛选
1.4.1 拮抗菌发酵液的准备:用挑针挑取离体实验中具有抑菌活性的拮抗细菌菌株的单菌落,转移至装有50 mL NB培养液的三角瓶中,于28 ℃、150 r/min振荡培养1 d。吸1 mL培养液转接至装有50 mL NB培养液的三角瓶中,28 ℃、150 r/min振荡培养2 d,获得拮抗菌株的发酵液。
1.4.2 拮抗细菌的活体筛选:把发酵2 d的拮抗菌发酵液(孢子最终浓度为3.0×106孢子/mL)和培养7 d生长旺盛的黄曲霉菌菌悬液(孢子最终浓度为3.0×106孢子/mL-1)分别浸泡花生荚果30 min,阴凉处被干后放入无菌平板,每板20粒花生仔仁,放入光照培养箱培养10 d。培养箱培养条件为:温度28 ℃,湿度70%~80 %,光照为12 h黑暗,12 h光照。以不浸菌液为空白对照,每处理设3次重复。
1.5 拮抗菌B65-2对产毒黄曲霉的抑制作用
1.5.1 上清液和过滤液制备:生防菌B65-2在LB斜面上活化后,取一环于LB培养液中,100 mL/300 mL装液量,37 ℃,160 r/min振荡培养48 h后,制备成以下处理液:上清液:培养液在120 00 r/min下离心15 min,取上清,用0.22 μm细菌过滤器过滤后得到无菌的过滤液。
1.5.2 菌悬液制备:培养液在12 000 r/min下离心15 min,弃上清,菌体用无菌水清洗3次再离心,加入无菌水。
1.5.3 蛋白粗提液:培养液于4 ℃下12 000 r/min离心15 min弃沉淀,在上清液中加固体硫酸铵至70%饱和度,4 ℃静置过夜,于4 ℃下10 000 r/min离心20 min,弃上清液,沉淀用1/25体积10 mmol/L,pH7.0磷酸缓冲液悬浮,然后用0.22 μm细菌过滤器过滤可能存在的细菌。
1.5.4 生防菌代谢产物对黄曲霉孢子萌发的影响:产毒黄曲霉的孢子浓度调整为1×106个/mL,与终浓度为1×107个/mL的拮抗菌混合培养于 PD 液体培养基中(以不加拮抗菌为对照),置于28 ℃摇床培养。分别于培养 8、16、24 h 后显微镜观察黄曲霉孢子萌发情况。每个处理随机观察 200 个黄曲霉孢子,计算孢子萌发率。实验重复 3 次。
1.5.5 拮抗菌抑制黄曲霉菌丝生长及黄曲霉毒素产生的研究:用上述制备好的上清液、过滤液及蛋白粗提液培养黄曲霉,以测定其对黄曲霉生长和产毒的影响,28 ℃ 霉菌培养箱中培养8 d 后,培养液经 Beacon 黄曲霉毒素固相萃取柱纯化后,用 LC-MS / MS 检测黄曲霉毒素含量,实验重复3 次;用无菌打孔器打直径6 mm 的长有黄曲霉的琼脂块,倒置于 PDA 培养基平板中央,在等距离处分别放置4 个直径6 mm 的无菌滤纸片。取10 μL 细菌培养液(37 ℃营养肉汤中培养过夜,调整浓度为1×107个/mL)滴加到每张滤纸片上,对照加空白培养基,28 ℃恒温培养2 d,每株细菌重复3次;液相色谱条件:ZORBAX Eclipse Plus C18,1.8 μm,3. 0×100 mm;柱温 40 ℃;流动相:A:甲酸水(含0.1%甲酸),B:乙腈,梯度洗脱,流速0. 4 mL/ min,进样量20 μL,质谱条件:电喷雾离子源,多重反应监测,GAS Temp:350 ℃,GAS Flow:10 L/ min;Nebulizer:40 psi。
1.5.6 拮抗菌对黄曲霉毒素的分解作用:选取复筛拮抗菌菌株接种于营养肉汤培养基中发酵 24 h,取 5 mL 菌体发酵液加入4种黄曲霉毒素的混合标准品至终浓度为 20 μg / L,以空白培养基加入黄曲霉毒素作为空白对照,置于 37 ℃ 培养箱培养,分别于 2、4、6 d 取样,检测 4 种黄曲霉毒素的含量,3 次重复实验。
1.6 拮抗菌株B65-2的鉴定
1.6.1 常规鉴定方法参见文献[7]。
1.6.2 16S rDNA PCR扩增及序列测定: B65-2基因组DNA的提取采取试剂盒的方法。以27 F(5′- AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′)为引物扩增细菌菌株的16S rDNA。PCR体系:10×PCR缓冲液5 μL,dNTPs (10 mmol) 1 μL,引物27 f (10 μmol/L-1) 1 μL,引物R1492 (10 μmol/L-1) 1 μL,模板DNA约10 pmol,Taq酶 (5 μ/μL-1) 0.25 uL,加重蒸水至50 μL。扩增条件:98 ℃ 5 min;95 ℃ 35 s,55 ℃ 35 s,72 ℃ 1 min,35个循环;72 ℃ 8 min。琼脂糖凝胶电泳并回收目标DNA片段,由上海派诺森生物科技公司进行测序;测序结果用BLAST软件在GenBank进行同源性比较,以ClustalX进行多序列比对。
2 结果与分析
2.1 花生中微生物的分离
根据菌落形态、颜色及出现早晚的差异,从表面彻底消毒的花生荚果碾碎液涂布的平板中挑取不同菌落进行纯化,得到988株细菌,其中,滦南花生荚果中分离细菌菌株208株,滦县花生荚果分离出162株,迁西花生荚果分离出182株,迁安花生荚果分离出211株,玉田和丰南获得花生荚果225株。结果显示,不同产区花生仔仁中的细菌数量明显不同。
2.2 内生拮抗细菌的筛选
2.2.1 离体拮抗筛选
将花生仔仁中分离获得的988株细菌通过对峙培养法进行拮抗筛选,对产毒黄曲霉拮抗效果在50%以上的10株菌进行下一步的研究(表1)。其中菌株B25-5对产毒黄曲霉的抑制率可达95.5%,其次为菌株B38-2和B22-1,抑制率分别达到83%和79.5%,拮抗效果显著。

表1 生防菌株对黄曲霉菌的拮抗作用
2.2.2 活体拮抗筛选
将上述离体条件下具有较强拮抗作用的细菌在花生仔仁上进行抑黄曲霉毒素筛选(表2),结果表明获得的拮抗细菌在花生仔仁上表现出较强的抑毒效果。其中,菌株B25-5抑毒率可达92%,其次为B19-3的84.5%及B38-2的78.5%,对菌株B25-5抑黄曲霉菌毒素的效果进一步进行研究。
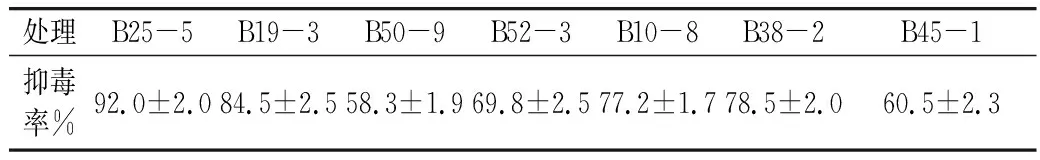
表2 生防菌对黄曲霉毒素的抑制效果
2.3 菌株B25-5代谢物对黄曲霉菌的影响
利用已制备的培养液、上清液、滤液及蛋白粗提液对黄曲菌丝生长的影响进行研究,菌株B25-5培养液对黄曲霉菌菌丝生长的抑制作用可达95.5%,生防菌的上清液抑菌率达到70%以上,滤液达到65%以上,蛋白粗提液的抑制作用效果较低,为57.6%。实验结果证实,菌株B25-5及活性物质对黄曲霉菌具有较强的抑制作用,且在-4 ℃的低温条件下具有显著的拮抗活性(表3)。
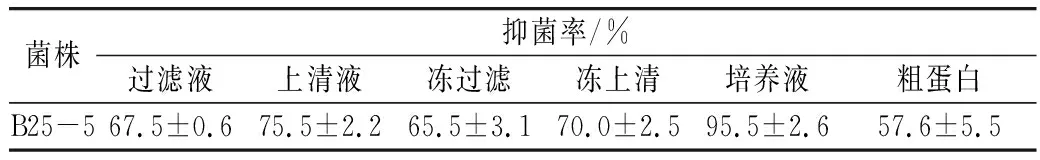
表3 菌株B25-5及活性物质对黄曲霉菌生长的抑制作用
2.4 菌株B25-5对黄曲霉孢子萌发及黄曲霉毒素产生的抑制作用
菌株B25-5对黄曲霉菌孢子萌发具有显著的抑制作用,黄曲霉与拮抗菌混合培养 24 h 后黄曲霉孢子的萌发率显著降低(P<0. 01),黄曲霉孢子的萌发率由 96.5 % 下降至 4.2 %(表4);黄曲霉与拮抗菌混合培养后,LC/MS/MS检测结果发现黄曲霉毒素的产生量急剧下降,72h后4 种黄曲霉毒素未检出(表5)。
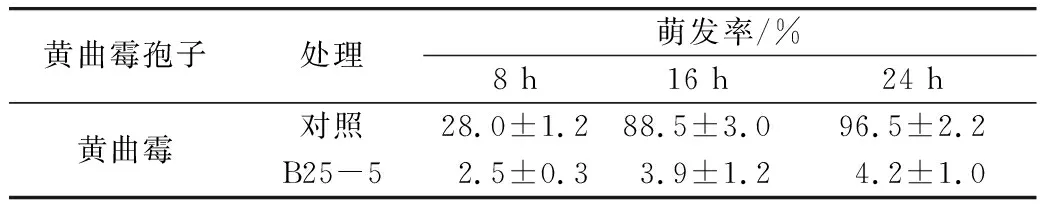
表4 菌株B25-5对黄曲霉孢子萌发的抑制效果
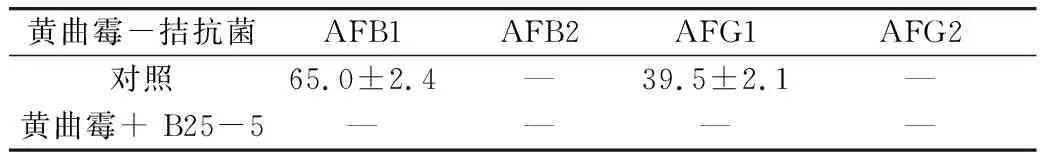
表5 菌株B25-5对黄曲霉毒素的抑制效果(%)
2.5 菌株B25-5对黄曲霉毒素的降解作用
利用 LC/ MS/ MS技术检测黄曲霉毒素浓度,实验结果证实,拮抗菌B25-5具有显著降解黄曲霉毒素的作用,随着时间的增加,对黄曲霉毒素的降解率逐渐升高,到第6天时,菌株B25-5对黄曲霉毒素的降解率可达 92.5%。黄曲霉毒素 G1 和 G2 在菌株B25-5培养第 4天时未检出,拮抗菌降解黄曲霉毒素 G1、G2 的速度显著高于降解黄曲霉毒素 B1、B2的速度(表6)。

表6 菌株B25-5对黄曲霉毒素的降解作用/μg/mL
2.6 黄曲霉拮抗菌株B25-5的鉴定
2.6.1 常规鉴定
形态观察发现,菌株B25-5在NA培养基上菌落圆形,边缘不规则,表面较光滑,不产色素;菌体杆状,大小为(0.9~1.2) μm×(2.8~3.2) μm;革兰氏染色阳性;产芽孢,芽孢椭圆形;具有运动性,证明该菌株为芽孢杆菌(Bacillussp.)。
菌株生理生化测定结果见表7。菌株B25-5接触酶反应、葡萄糖、甘油、D-木糖、淀粉水解、山梨醇、甘露糖、果糖、肌醇及纤维二糖均为阳性,氧化酶、D-阿拉伯糖等试验均为阴性,参照文献中细菌鉴定方法[8,9],该菌株符合芽孢杆菌(Bacillussp.)的基本理化特性,与解淀粉芽孢杆菌有极高的相似性。
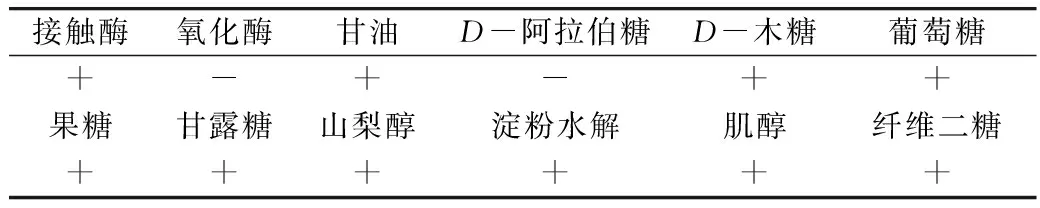
表7 菌株B25-5的生理生化特征
注:“+”为阳性反应;“-”为阴性反应。
2.6.2 16S rDNA的序列分析
以菌株B25-5基因组DNA为模板,通过PCR扩增得到该菌株的16S rDNA。测序结果表明该菌株16S rDNA序列长度为1477 bp。BLAST分析发现该菌株的16S rDNA序列与芽孢杆菌属细菌的16S rDNA相似,调出其中已鉴定菌株的16S rDNA,用Clustal W进行多重序列对比,菌株B25-5与解淀粉芽孢杆菌菌株JF496388同源性达98%。结合菌株B25-5形态特征及理化指标测定等鉴定结果,初步将菌株B25-5鉴定为解淀粉芽孢杆菌。
3 讨论与结论
黄曲霉毒素是已知的毒性、致癌性最强的一类天然生物毒素,被世界卫生组织认定为Ⅰ类致癌物[10-13]。黄曲霉毒素具有稳定的理化性质,耐高温,难以用一般的加工处理方法去除,人或畜禽食用受黄曲霉毒素污染的农产品可导致机体病变,甚至死亡。治理农产品中黄曲霉毒素的最佳办法就是预防[14,15],应用微生物或其代谢产物来抑制黄曲霉毒素产生或脱毒的生物防治技术,由于对人体无害、对环境友好,成为近年来真菌毒素防治研究的热点。利用生物技术体系来防控黄曲霉毒素污染的成功案例国外早有报道,由于种种原因,我国相关的研究起步较晚,能够有效做为防控黄曲霉毒素污染技术手段的微生物制剂亟待开发。
本研究针对花生中黄曲霉毒素污染防控难题,采用生物防治技术,以期为我国花生黄曲霉毒素污染治理探索一条有效途径。本研究从唐山市各种植区收获的花生荚果中分离获得微生物菌株988多株,其中菌株B25-5对黄曲霉生长的控制效果达90%以上,效果显著,具有极大的开发应用潜力。在抑制黄曲霉菌生长的实验中,拮抗菌株B25-5和黄曲霉混合培养24 h后,黄曲霉几乎被完全抑制,培养液对黄曲霉菌菌丝生长的抑制作用可达95.5%,上清液和过滤液对黄曲霉也具有良好的控制效果,因此拮抗菌株B25-5代谢产物应该是抑制黄曲霉菌丝生长的主要机制。实验过程中发现拮抗菌B25-5与黄曲霉孢子混合培养时能显著抑制黄曲霉孢子的萌发,使用B25-5发酵液与黄曲霉孢子混合培养时,孢子萌发速度显著小于空白对照,几乎不产生黄曲霉毒素,证明拮抗菌发酵液能够显著抑制孢子萌发,且能够降低毒素的产生。拮抗菌生长过程中产生的某些胞外抑菌活性物质,能够显著的干扰黄曲霉孢子的萌发,抑制黄曲霉菌丝的生长和黄曲霉毒素的产生。关于拮抗微生物对黄曲霉毒素的降解研究,国内学者孔青等报道的海洋巨大芽胞杆菌对黄曲霉毒素合成的抑制率为50.75%[16],Abbas等[17]的研究结果显示,他们获得的不产黄曲霉毒素的黄曲霉菌株能够显著的控制产毒菌株,能够降低 65%~94%的黄曲霉毒素产生。本研究中获得的拮抗菌株B25-5对黄曲霉毒素B1的降解率可达 90%以上,对G1和G2可在第4天时可全部降解,证明菌株B25-5具有极强的解毒能力,应用前景广阔。本研究表明,内生拮抗细菌B25-5可通过分泌抗菌物质,来抑制黄曲霉菌丝生长和分生孢子萌发,抑制和减轻黄曲霉菌侵染和毒素污染的发生,即菌株分泌的抗菌物质为菌株抑菌抑毒机制之一。但其解毒机制、对环境中微生物种类和区系影响、对花生等农产品品质是否影响有待进一步深入探索和研究。

