m-CT值在预测临床Ia期肺癌和癌前病变恶性程度中的应用研究
吴汉然 柳常青 徐美青 熊燃 徐广文 李彩伟 解明然
肺癌在全世界范围内发病率和死亡率居所有恶性肿瘤之首[1,2]。近年来随着影像学技术的发展和低剂量螺旋计算机断层扫描(computed tomography, CT)体检的普及,肺部磨玻璃结节(ground-glass opacity, GGO)的检出率逐年升高。GGO好发于双肺外周或胸膜下,CT肺窗表现为肺部局灶密度增高的云雾状区域,内部血管和支气管未受侵犯。临床上绝大多数GGO为早期肺癌或癌前病变,包括:非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinomain situ, AIS)及微浸润腺癌(minimally invasive carcinoma, MIA),这三种病变均较浸润性腺癌预后更好[3,4]。近期研究[5,6]表明,仅对这部分患者进行亚肺叶切除,就能获得良好的预后。因此,术前预测GGO的恶性程度,避免临床上过度的外科手术切除非常重要。
目前临床上尚无评判GGO恶性程度的统一标准,临床上常根据GGO的影像学特征如形态、边缘、界面、内部结构、血管集束征、胸膜凹陷征等来预测其恶性程度,误诊率相对较高。本研究回顾性分析了129例术前诊断GGO、接受肺切除手术且术后病理证实为腺癌或癌前病变的患者的临床相关资料和CT参数(GGO的直径、C/T比值、Max CT值和m-CT值),评价上述CT参数与GGO恶性程度的相关性。
1 资料与方法
1.1 一般资料 收集中国科学技术大学附属第一医院胸外科2012年1月-2013年12月接受肺切除手术并有病理证实的肺GGO患者129例,其中男性59例,女性70例,平均年龄(62.0±8.6)岁。患者的病理类型根据最新的国际肺癌协会、美国胸科学会、欧洲呼吸学会联合发布的肺腺癌的国际多学科分类标准分为:AAH、AIS、MIA。将AAH和AIS归为非浸润(noninvasive cancer, NC)组,MIA和腺癌归为浸润(invasive cancer, IC)组。患者的术前检查包括:血常规、生化、凝血象、免疫组合,心电图、超声心动图,肺功能,气管镜检查,同时行胸部平扫+增强CT+肺部GGO三维重建明确病变性质,行腹部+双侧肾上腺彩超、头颅MRI平扫+增强、骨扫描检查以排除远处转移。
1.2 方法
1.2.1 患者纳入与排除标准 纳入标准:(1)行高分辨率CT检查提示肺部外周型孤立性结节,直径小于2 cm,病理证实为腺癌或癌前病变;(2)气管镜检查提示段及段以上支气管无病变;(3)术前分期为cT1N0M0;(4)手术方式为肺段切除、肺叶切除及肺楔形切除。排除标准:(1)术前检查提示有淋巴结肿大(CT上直径≥1 cm)或正电子发射型断层显像(positron emission tomography, PET-CT)怀疑有淋巴结转移;(2)术前接受肺穿刺活检,已明确病理类型的患者;(3)临床资料不完整。
1.2.2 方法 临床资料分析:所有患者的临床资料均来自我院病案室,统计患者的年龄、性别、术前cTNM分期,术后TNM分期,病理类型,手术方式。CT扫描及图像分析:收集所有患者的CT扫描结果。设备为Simens Somatom Sensation 64层螺旋CT机,行CT检查时嘱患者在吸气末屏气用5 mm层面的薄层CT机从胸廓入口扫面到肺底部。扫描参数为:120 kV,80 mA-160 mA,螺距1.375,进床速度为27.5 mm/r,扫描FOV 30 cm-35 cm。需要行三围重建的CT图像采用层厚1.25 mm-1.5 mm,层距1 mm-1.5 mm进行图像重建。观察窗位为:肺窗窗宽1,500 HU-2,000 HU(Hounsfied units, HU),窗位-700 HU-600 HU,纵隔窗窗宽350 HU-400 HU,窗位35 HU-50 HU。
CT数据采集由两位工作高年资影像科医师在未知患者病理结果的情况下采集,将肺部外周型孤立性结节阴影完全为云雾状、气管和血管无外侵且在HRCT中无实性成分的归为GGO。在行三维重建时应用ADW3.1(Advantage Workstation 4.3; GE Healthcare),利用重建软件(Lung VCAR; GE Healthcare)进行三维重建。采集GGO的影像学数据应用View Pro-X软件进行分析,包括:病灶位置、GGO最大径、GGO中实性成分最大径、最大CT值、平均CT(m-CT)值、C/T比。两位高年资医师得出的上述数据出现分歧时通过计算平均值得出结果。

表 1 患者临床病理特征(n=129)Tab 1 Patient clinical and pathologic characteristics (n=129)
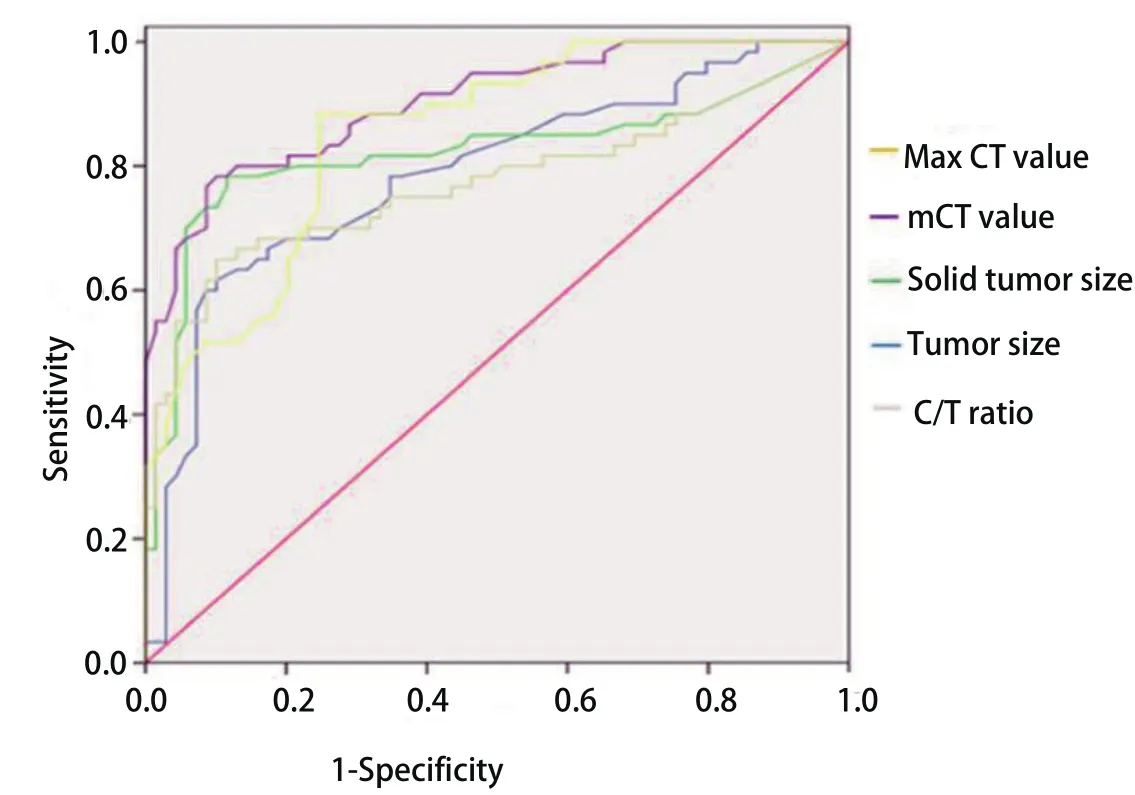
图 1 CT参数的ROC曲线Fig 1 Receiver operating characteristics (ROC) curves predicting GGO invasiveness.GGO: ground-glass opacity.
1.3 统计学方法 采用SPSS 18.0统计学软件对数据进行分析。正态分布资料用(Mean±SD)表示,计量资料均数比较采用t检验,计数资料比较采用卡方检验。应用单因素和多因素分析来研究患者的临床资料,计算95%的可信区间,单因素分析中P<0.05的指标结合文献报道后纳入多因素分析,并绘制GGO最大径、实性成分最大径、m-CT、C/T比值等的受试者工作特征曲线(receiver operating characteristics, ROC),同时计算曲线下面积(area under the curve, AUC)和cut-off值,AUC在0.5-0.7之间为诊断价值较低,0.7-0.9为诊断价值中等,>0.9诊断价值价高。以P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床资料 本研究共入组了129例患者,其中男59例,女70例,平均年龄(62.0±8.6)岁。患者的TNM分期、手术方式、分化程度和IASLC分类情况见表1。
2.2 两组患者的临床资料和CT参数的比较 两组患者在性别、年龄、分化程度方面没有差异无统计学意义(P>0.05)(表2)。通过绘制患者的实性成分大小、肿瘤大小、C/T比值、m-CT值和Max CT值的ROC曲线发现(图1),上述指标的cutoff值分别为:9.4 mm、15.3 mm、47.5%、-469.0 HU和-35.0 HU,对应的AUC分别为:0.89、0.79、0.82、0.90、0.85,对应的95%CI分别为:0.826-0.959、0.706-0.868、0.738-0.906、0.851-0.954、0.788-0.915。上述指标中m-CT值的AUC最大,对评估GGO的恶性程度效果最佳。根据文献报道的结果结合本文纳入的指标将患者的性别、实性成分大小、肿瘤大小、C/T比值、m-CT值和Max CT值纳入单因素分析发现,实性成分大小、肿瘤大小、C/T比值、m-CT值和Max CT值与GGO的恶性程度存在相关性(P<0.001,表3),通过多因素分析发现,肿瘤大小、C/T比值、m-CT值和Max CT值均GGO恶性程度的独立危险因素(表4)。
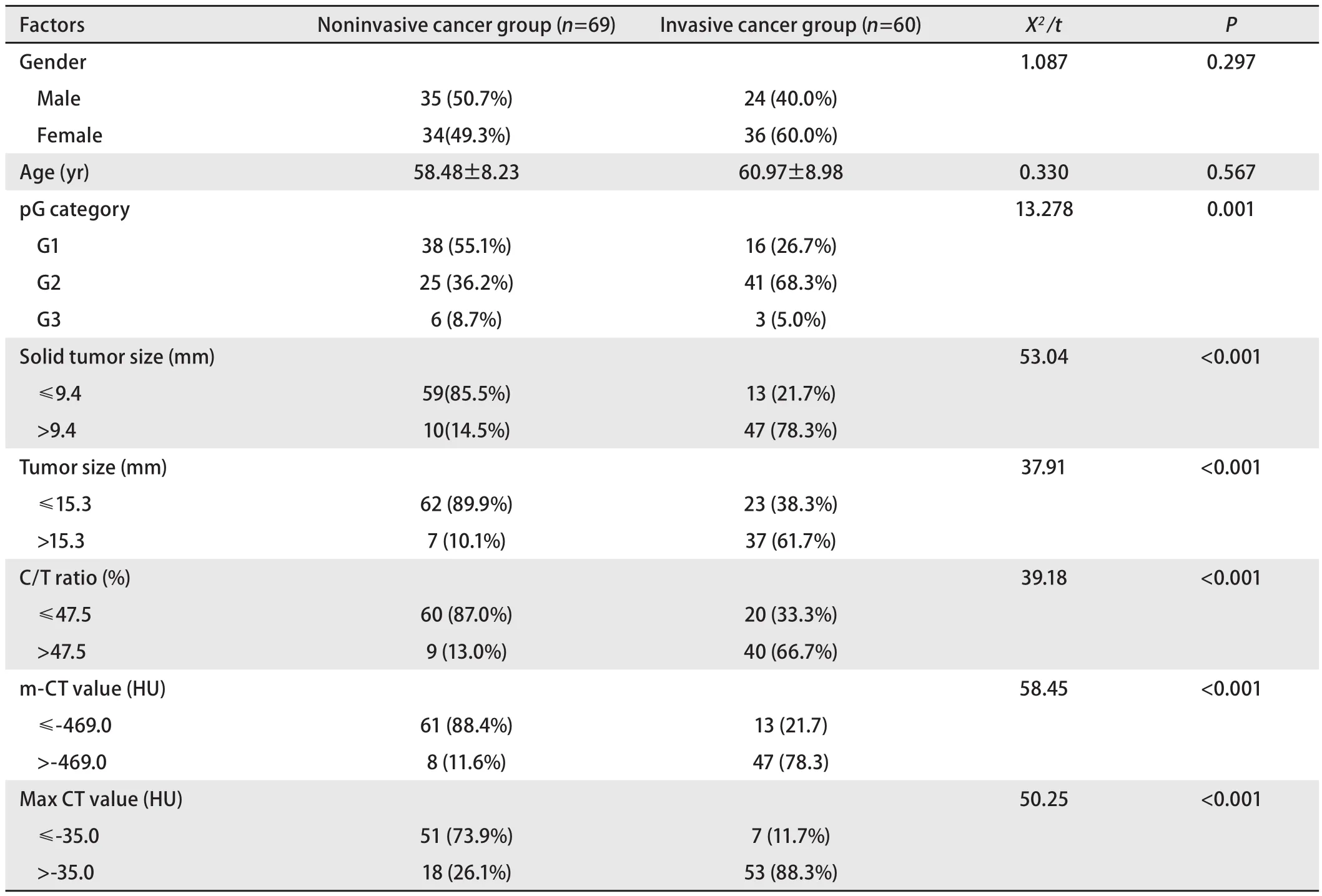
表 2 两组患者临床资料和CT参数间的比较Tab 2 Comparison of clinical and radiologic data between lesions in NC and IC
3 讨论
近年来随着影像学技术的快速发展,GGO的检出率也越来越高[7-10]。目前对于GGO的处理主要包括定期随访和手术切除,临床上常根据GGO的倍增时间和影像学特征来预测其恶性程度。但仅根据影像学特征来判断GGO的恶性程度与阅片医师的经验相关较大,误诊率较高,导致部分只需要接受亚肺叶切除手术的患者接受了更大范围手术治疗,部分需要手术切除的患者在随访过程当中错过了最佳手术时机。近年来,各种CT参数在GGO诊断中的应用逐渐被重视,特别是通过对C/T比值、m-CT值、Max CT值、GGO及GGO中实性成分大小的研究发现,上述指标与GGO的恶性程度关系密切[11,12]。本研究发现,GGO的大小及其实性成分大小、m-CT值及Max CT值与GGO的恶性程度均有显著相关性,其中m-CT值的评估价值最高。
2016年美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)发布的肺癌筛查指南中指出,对于实性成分>5 mm的混合GGO或直径>10 mm的纯GGO,根据其风险程度怀疑恶性病变的建议活检或手术切除[13]。本研究发现,GGO最大径、实性成分最大径与GGO的恶性程度密切相关,当GGO的直径>15.3 mm时或GGO中实性成分>9.4 mm时,倾向为浸润性病变,建议及时的外科干预治疗。有研究[7]通过对188例GGO患者的CT资料进行分析发现,不同病理类型的GGO的直径存在差异,并且认为当GGO直径>15.5 mm GGO的恶性程度较高,建议手术切除。Lee等[11]通过对纯GGO的病理类型和CT资料研究发现,当GGO的直径>15 mm时GGO倾向于浸润性腺癌。Tamura等[12]报道当GGO>15.6 mm、GGO中实性成分>9 mm时,GGO的恶性程度较高。目前文献报道的GGO的直径的临界值差别不大,均在15 mm左右。本研究中GGO直径的阈值为15.3 mm,与文献[7,11,12]报道的类似。
本研究发现,C/T比值与混合型GGO的恶性程度具有显著相关性。GGO中实性成分的主要病理改变为:(1)肺间质的纤维炎性增生和炎性细胞浸润;(2)表现为层叠排列的癌细胞,肺泡结构不同程度受损且在致密的纤维结构中存在肿瘤细胞浸润。周边毛玻璃样变的主要成分为出血和炎症反应。所以理论上GGO的肿瘤成分越多,GGO的C/T比值越大,恶性程度也相对较高。美国胸科医师学会(American College of Chest Physicians, ACCP)在2013年修订的肺癌诊治指南[14]中指出,当混合密度GGO在随访过程中实性成分比例增大(>50%),GGO的恶性程度较高。Tamura等[12]通过对494例GGO患者的C/T比值进行研究发现,当GGO中C/T比值>50.4%时,GGO倾向为浸润性病变。本研究中通过绘制ROC曲线计算临界值发现,C/T比值大于47.5%时,GGO的恶性程度较高,此时外科切除是最佳选择。

表 3 预测sGGO恶性程度的临床资料和CT参数的单因素回归分析Tab 3 Univariate Logistic regression analysis predicting the GGO invasiveness

表 4 预测sGGO恶性程度的临床资料和CT参数的多因素回归分析Tab 4 Multiple Logistic regression analysis predicting the GGO invasiveness
目前关于m-CT值与GGO恶性程度的研究报道较少[11,12],本研究中通过绘制GGO直径、GGO实性成分直径、C/T比值、m-CT值的ROC曲线发现,m-CT值的AUC最大,以m-CT值来评估GGO恶性程度价值最高。当m-CT大于-469 HU时,GGO倾向为浸润性病变。Tamura等[12]研究发现,m-CT值对评估GGO的恶性程度有重要意义,同时通过绘制ROC曲线发现,区分GGO浸润性的m-CT值临界值为-445 HU。该研究认为对于纯GGO病变,m-CT的评估价值最高;而对于混合密度的GGO,需要同时结合m-CT值和C/T比值来进一步诊断。Ikeda等[15]通过分析33例GGO患者的CT值发现,m-CT值对鉴别GGO的良恶性价值较高,同时得出AAH和AIS的鉴别临界值为-584 HU,AIS和肺腺癌的鉴别临界值为-472 HU。Peng等[16]通过对160例GGO患者的三维CT进行分析,通过绘制ROC曲线得出结论:m-CT值鉴别GGO中NC和MIA的临界值为-615.5 HU,鉴别MIA和腺癌的临界值为-464 HU。目前m-CT值对鉴别GGO恶性程度的意义已被文献证实[11,12,15,16],但对m-CT值的临界值各中心报道不一,主要在-490 HU-440 HU之间,本研究中m-CT值的临界值为-469 HU,与文献报道相似。我们认为,对于纯GGO病变,以m-CT值来评估恶性程度最佳,对于混合密度的GGO,同时结合m-CT值、Max CT值及GGO大小来综合评估准确性更高。
综上所述,综合应用GGO大小、GGO中实性成分大小、MaxCT值、m-CT值、C/T比值预测GGO的恶性程度较为可靠,其中m-CT值预测纯GGO的恶性程度相对最为准确。当纯GGO的m-CT值>-469 HU时,GGO病灶恶性程度较高,建议及时外科手术治疗,当m-CT值<-469HU时,可建议暂时随访观察。而对于混合密度的GGO病变,需要结合m-CT值、Max CT值及GGO大小来综合评估。由于本研究是单中心回顾性分析,存在一定病例选择性偏倚,随访时间相对较短,虽然近期效果明显,远期效果有待进一步验证。

