上海市肺科医院磨玻璃结节早期肺腺癌的诊疗共识(第一版)
姜格宁 陈昶 朱余明 谢冬 戴洁 靳凯淇 沈莹冉 王海峰 李辉 张兰军 高树庚 陈克能 张雷 周晓 史景云 汪浩 谢博雄 蒋雷 范江 赵德平 陈乾坤 段亮 何文新 周逸鸣 刘鸿程 赵晓刚 张鹏 秦雄
1 引言
近年来,随着胸部计算机断层扫描(computed tomography, CT)检查,尤其是低剂量薄层CT筛查项目在中国的广泛开展,越来越多的无症状肺部磨玻璃结节(ground glass nodules, GGNs)被发现。其发病特点包括:以东亚裔人群最为常见,非吸烟为主的人群,女性患者,低龄化表现。
目前国内及国际上,发布了一系列针对肺部GGNs的指南,但由于这些指南的撰写者多来自呼吸、肿瘤及影像专业,缺乏对现代微创胸外科的充分认识,因此造成现有指南对外科手术在肺部GGNs诊治中的作用不明确,甚至被低估;而且,肺部肿瘤相关的各学科对于早期肺癌,尤其是浸润前病变的处理也缺乏统一规范。
2011年,肺腺癌新分类[1]将肺腺癌分为:浸润前病变、微浸润腺癌(minimally invasive adenocarcinoma,MIA)以及浸润性腺癌。浸润前病变分为不典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)和原位腺癌(adenocarcinomain situ, AIS)。
本共识推荐对疑似肺腺癌的GGNs进行多学科评估,依据诊断,选择合理的处置方式。现对于疑似AIS、MIA、浸润性腺癌及多原发肺癌的处置原则分叙如下。
2 原位腺癌
AIS典型的影像学表现为直径大于5 mm且小于30 mm的纯磨玻璃结节(pure ground-glass nodules, pGGN)。pGGN,是指CT肺窗上的局灶性磨玻璃样阴影,且结节内不含能够遮挡血管或支气管结构的实性成分[2]。AIS需要与AAH和MIA进行鉴别。小于5 mm的pGGN通常为AAH[3],若pGGN最大径为2 mm-5 mm,其为AAH的可能性约为97%[4];CT值小于-520 HU亦提示AAH的可能[5]。若pGGN≥6.5 mm、边界完整[5],或CT上出现血管形态改变[6],或出现空泡征(vacuole),则AAH的可能较小。AIS还需与MIA鉴别,若GGN出现分叶征,胸膜牵拉[7],支气管充气征[5],通常提示MIA。GGN实性部分平均CT值在鉴别MIA与浸润前病变(AAH/AIS)亦有重要意义,浸润前病变实性成分平均CT值为-318.1 HU,而MIA为-194.7 HU[8]。
对首次发现的疑似AIS的GGN应进行定期随访[9]。推荐在结节首次发现后的3个月进行首次的薄层CT平扫检查[2,10];若患者首次CT检查层厚大于3 mm,建议在1个月后复查薄层CT平扫以获得结节的基线资料[10],然后3个月后再次复查薄层CT平扫观察结节的变化情况。
随访过程中,若结节明显缩小,则考虑良性病变可能。若患者年龄小于40岁,无吸烟史及二手烟暴露史,无肺癌家族史,无肺部其他需长期随访的疾病(慢性阻塞性肺病、肺纤维化、支气管扩张等),则无需常规随访胸部CT;其他患者推荐进行每年1次的薄层CT随访[11,12]。
若结节持续稳定存在,可视病灶形态及大小等因素继续随访。对于直径小于8 mm,CT值较低,边界模糊的pGGN可每半年或1年随访一次;对于直径大于等于8 mm,边界清楚的pGGN,或含有实性成分的部分实性结节(part-solid nodules),可适当缩短随访时间间隔至6个月;对于持续稳定存在的外周优势部位的疑似AIS病变,也可考虑微创外科手术切除。其依据如下:①部分pGGN仍具有生长和恶变的可能[13,14];②亚肺叶切除即可将病灶完整切除,且不影响患者预后[15,16];③术前无需进行正电子发射型断层显像(positron emission tomography,PET-CT)、头颅磁共振、支气管镜等,术前检查简单[17,18];④术中无需进行纵隔淋巴结清扫/采样,手术创伤小[15,19];⑤手术可在一定程度上降低患者焦虑水平,改善生活质量[20]。外科手术治疗AIS也存在一定的缺点:①若患者手术后再次出现其他部位的肺部结节,可能需要再次手术,则再次手术的难度和风险有可能增加;②AIS进展到危及生命,可能需要多年,过早的手术介入,会导致过早的手术损伤,术后可能出现的长期疼痛或其他并发症,可能影响患者的生活质量,早期手术与随访择期手术相比并不能显著改善患者总体生存,但却可能使患者过早的承受手术的风险及术后疼痛;③术前的AIS的诊断依赖影像学判断,缺乏病理支持,对术前判断的AIS进行手术,术后可能证实为AAH或良性病变。所以,对于稳定存在的AIS应当进行胸部薄层CT随访,仅当同时满足以下4个条件时,可考虑对患者进行外科手术治疗:①对于结节诊断AIS的准确性较高(MDT讨论或结节直径≥8 mm且边界清楚的pGGN);②结节位于外周或优势段,行楔形切除、亚肺段或肺段切除可完整切除病灶;③随访过程中,患者存在明显的焦虑症状,影响生活质量;④患者无影响其生命的其他系统的严重基础疾病,预期寿命超过10年,且不伴有其他恶性肿瘤。
若结节随访过程中出现体积增大,或实性成分增多,考虑疾病进展为MIA或浸润性腺癌时,应考虑及时外科介入。AIS的处理流程如图1所示。
【肺科共识——原位腺癌】
术前随访
可疑AIS患者,术前至少随访1次,且距首次发现间隔3个月以上。
术前检查
术前推荐薄层胸部CT平扫,无需行头颅磁共振、全身骨扫描、气管镜、胸部CT增强、PET/CT或经皮肺穿刺检查。
手术指征
1.长期随访,结节持续存在;
2.对于结节诊断AIS的准确性较高(MDT讨论或结节直径≥8 mm且边界清楚的pGGN);
3.结节位于外周或优势段,行楔形切除、亚肺段或肺段切除可完整切除病灶;
4.随访过程中,患者存在明显的焦虑症状,影响生活质量;
5.随访中,结节明显增大或密度变实;
6.患者不伴有影响其生命的其他系统的严重基础疾病,或其他恶性肿瘤,患者的预期寿命超过10年。
手术原则与手术切除范围
1.如病灶位于周边“优势部位”:行肺楔形切除;
2.如病灶位置较深,但仍位于某一个肺段内:行亚肺段或肺段切除;
3.病灶处于多个肺段之间或支气管根部,切除需要联合肺段切除或肺叶切除者,不推荐或慎重选择手术;
4.手术切缘应符合基本肿瘤学原则;
5.术中冰冻病理结果决定是否需要扩大切除及淋巴结清扫。
淋巴结清扫范围
术中无需淋巴结清扫或采样。
术后辅助治疗
术后不需要放疗、化疗或靶向治疗。
预后
完全切除后肿瘤学预后良好,5年生存率可达100%。
术后随访
如无明显残余病灶,AIS术后可每年复查一次胸部CT平扫,不必复查头颅磁共振、全身骨扫描、气管镜或血肿瘤标志物。
3 微浸润腺癌
MIA是一类早期肺腺癌(≤3 cm),主要以贴壁方式生长,且病灶中任一浸润病变的最大直径≤5 mm,不伴有浸润胸膜、血管、淋巴管或肿瘤性坏死[1]。其在影像学上多数表现为pGGN,也有部分表现为部分实性结节,极少数表现为实性结节。在Lee等[21]的研究中,三类影像表现的比例分别为53.8%、42.3%和3.8%。在pGGN中,结节的直径及特殊影像征象的有无决定结节的浸润性。持续存在的,直径≥10 mm的pGGN是MIA的一个CT特征[22],其CT值约为(-536.2±113.1)HU[8]。分叶征、胸膜牵拉[7]和支气管充气征[5]的出现可作为MIA与AAH/AIS鉴别的要点。而对于部分实性结节,根据其内实性成分的比例来区分浸润前病变(AIS/MIA)和浸润性腺癌至关重要。MIA的实性成分最大径一般小于5 mm[23-26],实性面积占比总面积(consolidationtotumor ratio, C/T)<0.25[25,27,28],结节CT值约为(-517.5±161.2)HU,实性部分平均CT值为-194.7 HU[15]。对于实性成分的测量目前仍存在较多争议。Fleischner学会推荐在纵隔窗中进行[3],然而也有研究[29]指出肺窗上测量得到的实性成分与病理诊断更为符合。故仍需更多的研究来解答这个问题。表现为实性结节的MIA较少见[15]。
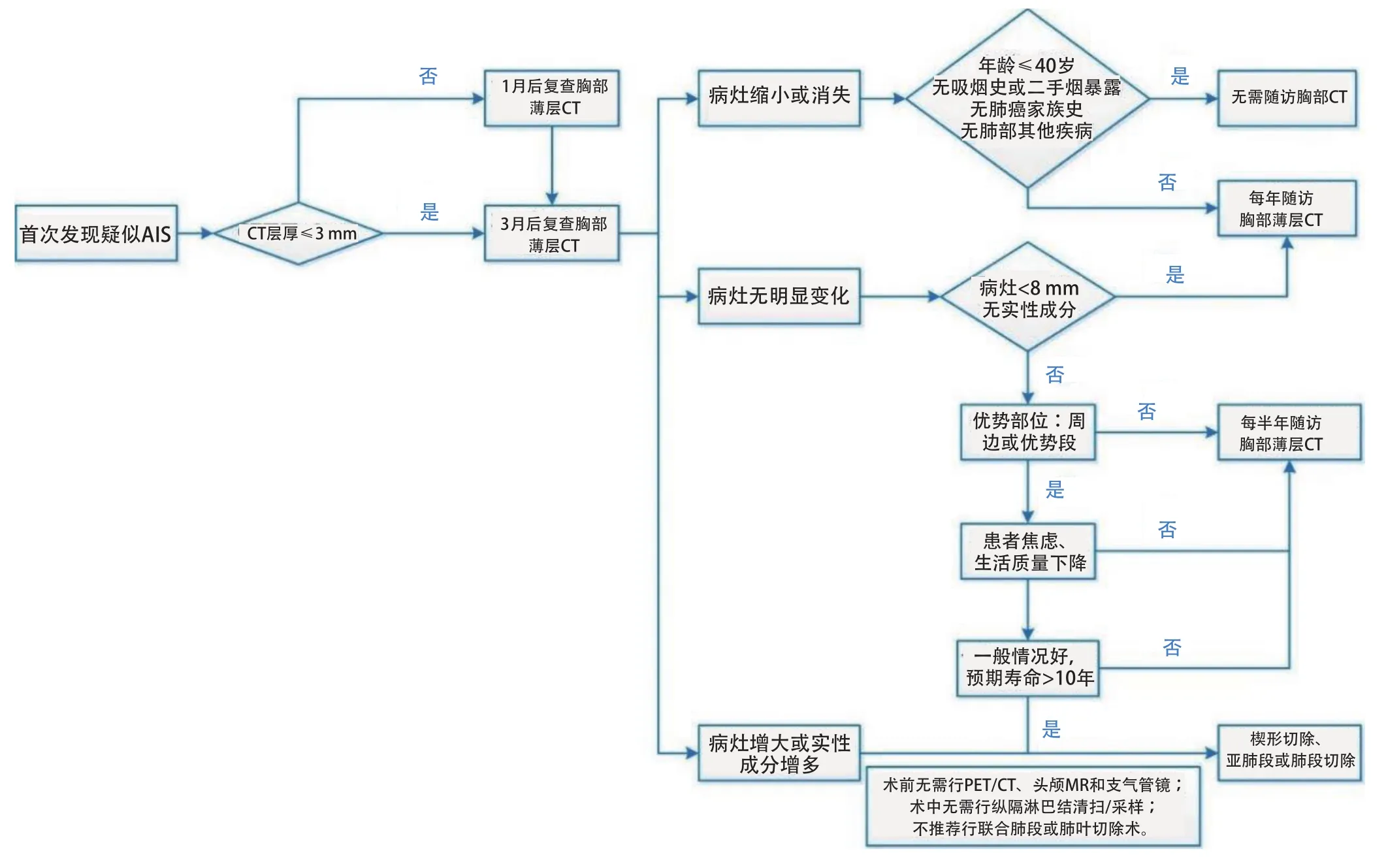
图 1 原位腺癌的处理流程图Fig 1 Management of adenocarcinoma in situ
PET/CT对于pGGN良恶性鉴别及术前分期的价值有限,假阴性率高[30]:pGGN的摄取很低或无摄取;部分实性结节大多数呈低摄取(随着实性成分比例增加,摄取值会相应升高)。pGGN很少出现气道内转移或远处转移,传统的气管镜下刷检或穿刺诊断阳性率低,径向探头EBUS下,GGN病变可表现为暴风雪征,活检有利于此类病灶的术前确诊[31]。pGGN发生远处转移或气道内转移的风险小,术前无需进一步检查[17,18],目前有待进一步大规模证据证实。
若影像学上高度怀疑MIA,则需考虑手术切除。术中对于肺部结节的定位方法包括术中肉眼观察、卵圆钳胸膜表面滑动定位、术中手指触诊定位、术中胸腔镜B超探头定位,术中CT定位等。对于直径大、CT值高或靠近胸膜表面或肺裂的结节,多数可通过肉眼观察结合术中触诊定位。术前定位则包括3D重建、CT引导下标记、电磁导航支气管镜引导定位、Virtual Assisted Lung-Mapping(VAL-MAP)等。术前CT引导定位包括:胸膜表面亚甲蓝注射、经皮肺穿刺放置微弹簧圈、经皮肺穿刺Hookwire定位、放射性示踪剂注射、影像辅助导航定位等。
大量研究[32,33]表明,在肿瘤小于2 cm的Ia期患者中,肺叶切除与亚肺叶总体生存无显著差异。影像评估若为MIA,目前的国际共识是局部切除即能达到痊愈。手术方式需遵循个体化原则,综合病灶的具体部位以及患者的身体状况制定最优方案。如病灶位于周边“优势部位”,可行楔形切除;病灶位置较深,但仍位于某一个肺段,可考虑行肺段切除;病灶位置处于两个或多个肺段之间或支气管根部,需行肺叶切除或联合肺段切除。术中冰冻诊断AIS/MIA是可行的。在Liu等[34]的研究中,AIS/MIA术中冰冻和术后病理的诊断一致率高达95.9%,术后病理升级为浸润性腺癌的发生率为4.6%,其中贴壁型占56.5%,腺管型占39.1%,乳头型占4.3%。在He等[35]的研究中,术中冰冻与术后病理不一致的发生率为4.41%。根据我院经验,若术中行楔形切除,术后病理升级为浸润型腺癌,根据浸润型腺癌亚型决定下一步处理方案:若为微乳头型或实体型,建议再次手术行肺段切除或肺叶切除;若为贴壁型、乳头型或腺管型,建议随访[36]。
综上所述,可疑MIA病灶具有手术切除的指征。肺叶切除和亚肺叶切除均可适用于MIA,手术方式的选择取决于病灶的位置和患者的身体状况。完全切除后肿瘤学预后良好,目前文献报道5年生存率可达100%,累积复发率为0%[37,38],由于样本量较小,仍需进一步临床研究证实。MIA的处理流程如图2所示。
【肺科共识——微浸润腺癌】
术前随访
可疑MIA患者,术前至少随访1次,且距首次发现间隔3个月以上。
术前检查
术前推荐薄层胸部CT平扫,而头颅磁共振、全身骨扫描、气管镜、胸部CT增强、PET/CT或经皮肺穿刺等为非必须检查项目,可根据患者具体情况进行选择。
手术指征
1.长期随访,结节持续存在;
2.对于结节诊断MIA的准确性较高(MDT讨论);
3.随访中,结节明显增大或密度变实;
4.患者不伴有影响其生命的其他系统严重基础疾病或其他恶性肿瘤,患者的预期寿命超过5年。
手术原则与手术切除范围
1.若病灶位于周边“优势部位”:行肺楔形切除;
2.若病灶位置较深,但仍位于某一肺段内:行肺段切除;
3.病灶位于多个肺段之间或支气管根部:行联合肺段切除或肺叶切除;
4.手术切缘应符合基本肿瘤学原则。
淋巴结清扫范围
术中冰冻病理初步诊断为MIA者,无需淋巴结清扫或采样。
术后辅助治疗
术后无需放疗、化疗或靶向治疗。如果术中病理为MIA,行楔形切除,术后病理升级为浸润型腺癌,根据浸润型腺癌亚型决定下一步处理方案:如果为微乳头型或实体型,建议再次手术行肺段切除或肺叶切除;如果为贴壁样生长型、乳头型或腺管型,建议随访。

图 2 微浸润腺癌的处理流程图Fig 2 Management of minimal invasive adenocarcinoma
预后
完全切除后肿瘤学预后良好,5年生存率可达100%,累积复发率为0%。
术后随访
若无明显残余病灶,MIA术后可每年复查一次胸部CT平扫,不必复查头颅磁共振、全身骨扫描或血肿瘤标志物。
4 浸润性肺癌
浸润性肺癌即具有手术切除的指征,因此术前的准确判断至关重要。影像学上,非钙化的实性结节若无典型良性结节特征(如错构瘤、胸膜旁结节),直径大于8 mm或体积大于300 mm3[25],边界存在毛刺征,则恶性可能大[2]。部分实性结节如果实性部分直径大于5 mm[23],或者实性面积占比总面积(consolidation-to-tumor ratio)大于25%[28],或者肿瘤纵隔窗消失率(tumor disappearance ratio)小于50%[39],往往提示结节已呈浸润发展。对于pGGN,结节直径大于15 mm、存在支气管充气征、以及CT值>-472 HU则提示为浸润性肺癌[40]。同时,患者年龄(55岁-74岁)、吸烟史(>30年包、或戒烟年限<15年)、既往恶性肿瘤和家族史、肺部合并疾病(慢性阻塞性肺病、肺纤维化)和职业接触史(石棉)等均应纳入结节综合评价[41]。
对疑诊浸润性肺癌,术前检查需判断结节的可切除性,主要评估肿瘤临床分期和患者躯体功能[41]。前者包括原发肿瘤评估(胸部CT、支气管镜),纵隔淋巴结评估(纵隔镜、EBUS或EUS-FNA[42]),和远处转移情况[(PET/CT、上腹部超声/CT(包含肾上腺)和头颅磁共振检查]。躯体功能评估主要指患者心肺储备功能、合并症以及血液学检查(血常规、肝肾功能和凝血情况)[41]。美国胸科医师协会(American College of Chest Physicians, ACCP)指南规定若术后第一秒用力呼气量预计值(ppoFEV1%)和/或一氧化碳弥散量预计值(ppoDLCO%)小于30%,或者峰值氧耗量(VO2peak)小于10 mL/kg/min或小于35%预计值,则为手术高危人群,围术期死亡率较高[43]。对于FEV1%和DLCO%均大于80%者,往往可耐受全肺切除术[44]。
戒烟指导和呼吸功能锻炼应贯穿肺癌手术治疗的始终。ERS/ESTS指南建议术前应至少戒烟2周-4周,否则将增加术后并发症发生的风险[44]。围术期有效的呼吸功能锻炼,也可增加手术安全性,同时减少住院天数[45]。
选择何种手术方式和途径主要与肿瘤生物学特性、患者因素和手术者经验有关。目前研究已证实微创手术,如电视辅助胸腔镜(video-assisted thoracoscopic surgery,VATS)在早期肺癌治疗的远期预后,包括局部控制率和长期生存率,不亚于传统开胸手术[46,47];并且在围术期安全性、住院花费和生活质量方面优于开胸手术[47,48]。
手术切除范围主要与肿瘤大小和位置等因素有关,也受患者肺功能和基础疾病的影响。目前NCCN和ACCP指南均指出,解剖性肺叶切除术+淋巴结采样/清扫仍是早期非小细胞肺癌手术切除的标准术式[41,49]。近些年研究发现对于早期肺癌(<2 cm),亚肺叶切除术和肺叶切除术在远期生存率上并无统计学差异[50],尤其在亚肺叶切除术联合纵隔淋巴结采样时[51]。亚肺叶切除应保证足够的切缘,且切缘直径需大于2 cm或大于肿瘤直径。ACCP指南认为,对于pGGN直径小2 cm,在保证切缘的情况下,也可行亚肺叶切除[49]。欧洲临床肿瘤学会(European Society for Medical Oncology, EMSO)指出,结节在PET-CT上呈低摄取可能是亚肺叶切除的良好指征[52]。最近一项基于SEER大数据的研究显示,对于<1 cm的肿瘤也可行楔形切除术[53]。相比以上的研究和指南,英国胸科协会(British Thoracic Society)分析了既往相关文献,认为亚肺叶切除仅适用于pGGN,对于部分实性结节,目前支持亚肺叶切除的证据尚不足[2]。但也有研究认为,pGGN和部分实性结节行亚肺叶切除和肺叶切除,在3年无复发率上无显著差异[54]。实性结节是否可行亚肺叶切除,仍有待进一步临床研究证实。在组织学类型上,多数研究表明鳞癌则更推荐行标准肺叶切除术[55]。对于老年、心肺储备功能较差患者,亚肺叶切除亦是一个较好的选择[56]。
对于术中淋巴结处理的方式,是否淋巴结清扫比纵隔淋巴结采样提高肺癌总体生存期,仍存在较多争议[57]。对于清扫或采样个数,随机对照试验(ACOSOG Z0030)研究结果认为至少采样12个淋巴结[58],AJCC指南推荐至少采样6个淋巴结,其中需有3站取自纵隔淋巴结(包括第7组),3站取自肺内淋巴结[59]。
浸润性腺癌患者,推荐常规行基因突变检测(推荐常规检测靶标包括EGFR、ALK、KRAS、ROS1、RET)。目前关于术后辅助治疗,对已行完整切除的Ia期肺癌患者不推荐行辅助治疗[60],Ia期的微乳头型肺癌,复发风险较高,是否需要辅助治疗,尚缺乏证据,目前已有相关临床研究开展。对于Ib期肺癌,如果存在复发的高危因素,如肿瘤细胞低分化(或组织学亚型为微乳头型或实体型)、病理上存在血管或脏层胸膜受侵、淋巴结情况未评估、或者手术切除范围仅为楔形切除,则推荐行辅助化疗[41]。对于完整切除的II期-III期肺癌,推荐术后行全身性辅助治疗,包括化疗或靶向治疗(基因检测突变阳性者)[61],切缘阳性者需增加切除范围或在术后辅以放疗[41]。
在早期肺癌预后方面,腺癌病理亚型是影响预后的主要因素。根据2011年IASLC/ATS/ERS联合推出的腺癌组织学分类[1],将浸润性腺癌分为五大类,包括贴壁型、腺泡型、乳头型、微乳头型和实体型。其中微乳头型和实体型预后最差,腺泡型和乳头型预后次之,贴壁型预后较好[62,63]。浸润性腺癌的处理流程如图3所示。
【肺科共识——浸润性腺癌】
术前检查
术前推荐薄层CT平扫,必要时术前行头颅磁共振,全身骨扫描等检查,如果存在明显肿大纵隔淋巴结,行PET/CT检查,或EBUS,纵隔镜检查排除N2疾病。
手术原则与手术切除范围
解剖性肺叶切除术+淋巴结采样/清扫仍是浸润性肺腺癌的标准治疗方式,如果病灶较小的非实性结节(<1 cm),或术中冰冻提示贴壁样生长为主型腺癌,可以考虑肺段切除+淋巴结采样/清扫。
淋巴结清扫范围
推荐清扫或采样3组6个以上纵隔淋巴结,至少包括第7组淋巴结。
术后辅助治疗
根据病理分期以及基因检测结果,决定是否行辅助治疗,以及辅助治疗的策略。
术后随访
按肺癌NCCN指南随访。
5 肺部多发结节的处理
由于胸部CT影像技术的不断提高,同期多发肺部磨玻璃结节(synchronous multiple ground-glass nodules, SMGN)的检出率也呈上升趋势;研究显示,大约20%-30%的GGN患者,存在肺内多发的GGN病变。目前多数学者认为其更可能是同期多原发肺癌(synchronous multiple primary lung cancers, SMPLC),而非转移性肺癌[64]。其中多原发病理类型为腺癌者约占80%以上[65]。
关于同期多原发肺癌的诊断,目前主要依据Martini标准(M-M标准)和ACCP指南。1975年Martini和Melamed率先建立了同期多原发肺癌的临床病理诊断标准[66],包括:(a)肿瘤部位不同且相互独立;(b)组织学类型不同;(c)组织学类型相同,但位于不同的肺段、肺叶或双侧肺,起源于不同的原位癌,共同的淋巴引流区域无癌,无肺外转移。随后,在2013年ACCP指南对其做了更新[67],具体为:(a)组织学类型不同,分子遗传学特征不同,或起源于不同的原位癌;(b)组织学类型相同时,肺癌位于不同肺叶,且无N2、N3转移,无远处转移。分子生物学检测对诊断同期多原发肺癌有了很大的提高,如克隆分析(clonality analysis)、杂合性丢失(loss of heterozygosity)等,但也同样面临着挑战,如肿瘤细胞内在异质性[68]。
同期多发肺部结节的术前检查,往往需要行PETCT和/或头颅磁共振排除远处转移,并通过胸部CT、支气管镜对纵隔情况进行评估。多发肺部结节的分期,根据最新国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)提出的8版分期指南,对已确诊的多原发肺癌患者,应根据每一个肺癌结节分别制定肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期。对于CT上表现为多发GGNs的肺癌患者(多数为贴壁型腺癌、微浸润腺癌或原位腺癌),T分类则根据最高结节的T分期,然后在括号内标注多发GGNs个数(#)或用字母“m”表示。
对同期多发肺部结节的治疗,目前相关高质量的研究较少。一项针对全球范围的调查研究发现,81%的外科医生倾向行手术切除,手术方式以肺叶切除术(针对主要病灶)联合肺段切除术(针对次要病灶)为主[69]。有研究结果显示,仅主病灶与患者生存期相关,而是否存在残留结节、残留结节是否增长、有无新发GGNs均与预后无关[70]。因此,对于多发GGN,手术切除范围应根据结节具体位置而定,需优先考虑主病灶的切除[71]。如果多个GGN处于同一肺叶内,可行多处肺楔形/肺段切除、或者整个肺叶切除;如果多个GGN位于同侧的不同肺叶内,应根据病灶的位置,个体化设计手术方式,可行肺叶/肺段切除联合多处肺段或楔形切除。研究发现,手术中包含楔形或肺段切除术并不影响患者预后,而行全肺切除术患者则预后较差[72]。因此,对于SMGN切除所有病灶时,需在符合肿瘤学原则的基础上,尽可能保留肺功能;亚肺叶切除(楔形切或段切)是可行的手术方式,但不推荐行全肺切除术[73]。

图 3 浸润性腺癌的处理流程图Fig 3 Management of invasive adenocarcinoma
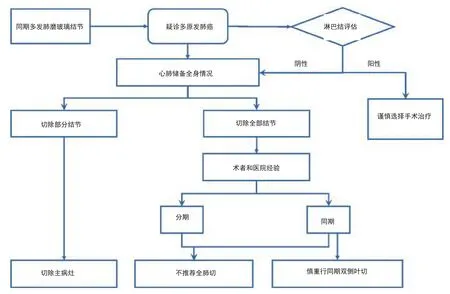
图 4 多发肺磨玻璃结节的处理流程图Fig 4 Management of multiple ground-glass nodules
如果多个GGN位于双侧肺,可同期或分期行肺切除术。2013年ACCP指南规定,若考虑为多原发肺癌,则应尽量做到根治性切除[67]。同期或分期的选择,主要取决于患者心肺储备功能,并且与术者及医院经验相关。同期手术可通过一次手术麻醉将病灶全部切除,减少再次手术创伤的应激[74]。双侧同期手术增加围术期手术风险,特别是呼吸衰竭的风险。分期手术时,由于前次手术创伤,往往需间隔6周-8周的时间窗,这对于患者是一种精神消耗。如果同期手术安全,应先行手术切除范围较小的一侧,以确保对侧手术的安全实施;如果同期手术存在风险,应先切除主病灶,在情况允许下再行对侧手术[68],一般要求肺的总切除范围不宜超过10个肺段。分期手术时则应先切除主病灶,二期再行对侧手术。双侧浸润性病变行双侧纵隔淋巴结清扫/采样时,应注意神经保护(膈神经和迷走神经),以免引起双侧膈肌瘫痪或胃瘫。
多原发肺癌预后公认的危险因素包括纵隔淋巴结侵犯和最高肿瘤T分期[75]。而多发结节的个数、位置是否位于同侧肺、以及组织病理学是否一致对预后的影响,目前仍有争议[76]。关于辅助化疗,目前尚无明确研究证实其能使多原发肺癌患者生存获益[72];因此辅助化疗的选择,仍应根据肿瘤分期,而非结节个数。
总的来说,对于肺部多发GGN疑诊多原发肺癌时,应评估纵隔淋巴结情况(PET/CT、EBUS或纵隔镜),如果N2淋巴结阳性,则不推荐手术治疗;N2淋巴结阴性时,根据患者病灶分布,心肺功能及体力状况,来决定是切除所有病灶,还是切除主病灶;应根据术者和医院经验选择同期或分期手术,但不推荐行单侧全肺切除术,慎重行同期双侧肺叶切除术。当CT表现多发GGN时,应优先处理主病灶;对于次要GGN病灶,如在同侧,且位于优势部位,可考虑同期手术切除,如在对侧且考虑为AAH或AIS,可密切随访。对于无法完全切除所有病灶的患者,残余病灶应进行密切随访,若随访过程中病灶出现进展,可根据患者情况,考虑再次手术、立体定向放疗(stereotactic body radiation therapy, SBRT)或多学科综合治疗。多发肺磨玻璃结节的处理如图4所示。
【肺科共识——多原发磨玻璃结节】
术前检查:术前推荐薄层平扫CT,必要时术前行头颅磁共振,全身骨扫描等检查,如果存在明显肿大纵隔淋巴结,行PET/CT检查,或EBUS,纵隔镜检查排除N2疾病。
手术原则与手术切除范围:多原发肺癌的治疗原则为主病灶优先,兼顾次要病灶。多个GGN处于同一肺叶内,可行多处肺楔形切除、肺段切除或肺叶切除,如多个GGN位于同一侧的多个肺叶内,应根据病灶的位置,个体化设计手术方式,行多处肺段切除或楔形切除,符合肿瘤学原则基础上,以尽可能保留肺功能为宜,不推荐行全肺切除术。如多个GGN位于双侧肺内,可同期或分期行双侧VATS肺切除术。双侧手术者,同期双侧肺叶切除需要慎重考虑,肺的总切除范围不宜超过10个肺段。优先处理主病灶;对于次要GGN病灶,如在同侧,且位于优势部位,可考虑同期手术切除,如在对侧且考虑为AAH或AIS,可密切随访。
淋巴结清扫范围:推荐清扫或采样3组6个以上纵隔淋巴结,至少包括第7组淋巴结。
术后辅助治疗:多原发病灶中的最高分期病灶为是否行辅助治疗之标准,结合肿瘤基因检测结果,决定辅助治疗的策略。主病灶经手术切除后是否残留次要病灶,不作为辅助治疗的选择依据。
术后随访:按肺癌NCCN指南随访。

