脑出血合并维持性血液透析24例临床分析
杜 静 王 训 高宗良
安徽医科大学第二附属医院神经内科,安徽 合肥 230601
脑出血是神经科常见疾病,在我国发病率为(60~80)/10万人·年,其病死率及致残率较高,为社会带来沉重的负担[1]。众所周知,脑出血的主要原因为高血压。高血压在肾衰竭维持性血液透析(maintenance hemodialysis,HD)的患者非常多见,研究发现,该类患者的脑出血发生率明显高于正常人群[2],是导致患者死亡的主要原因之一。然而,目前对于该类患者的临床研究不多,本研究回顾性分析了安徽医科大学第二附属医院近5 a脑出血合并维持性血液透析的患者资料,研究其临床特点,为临床治疗及改善预后提供帮助。
1 资料与方法
1.1一般资料收集安徽医科大学第二附属医院2014—2018年收治的脑出血合并维持性血液透析患者24例,符合2005年中华医学会神经病学分会制定的《中国脑血管病防治指南》脑出血诊断标准,并排除颅内肿瘤、头部外伤、凝血功能障碍引起的脑出血患者。所有患者符合慢性肾衰竭诊断标准并行血液透析治疗。其中男18例,女6例,年龄37~89(55.38±12.43)岁。收集同期我院无肾脏疾病的脑出血患者 24 例为对照组,男16例,女8例,年龄39~83(59.21±12.84)岁。2组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2治疗方法2组患者均给予监护、卧床、控制颅内压、调控血压、改善脑代谢、维持水电解质平衡、防治并发症等综合治疗,根据病情复查颅脑CT。HD组患者在病情允许的条件下行无肝素血液透析。
1.3观察指标入院后对2组患者进行神经功能缺损评分(National Institutes of Health Stroke Scale,NIHSS)及格拉斯哥昏迷评分(Glasgow Coma Scale,GCS),观察患者血压,分别检测血红蛋白、血小板、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血尿素氮、肌酐及血糖、PT系列,采用全自动生化仪检测。评估住院时间及病死率。根据CT检查判断脑出血部位,脑出血量按多田公式进行计算:血肿体积= π/6×长×宽×层面数。患者出院前再次进行NIHSS和GCS评分,并复查头颅CT,了解血肿变化情况。
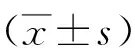
2 结果
2.1临床症状评定HD组及对照组的出血量、GCS、NIHSS评分和住院时间比较,差异无统计学意义(P>0.05)。2组血压均高于正常值,但组间无显著差别。见表1。
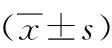
表1 2组住院时间、入院时出血量、NIHSS、GCS及血压比较Table 1 Comparison of hospitalization time, blood loss at admission, NIHSS, GCS and blood pressure in the 2
2.2 2组实验室检查指标比较HD组血红蛋白、血小板水平均低于对照组,差异有统计学意义(P<0.01)。HD组肌酐及尿素氮水平显著高于对照组(P<0.01)。HD组胆固醇为(3.55±0.61)mmol/L,较对照组显著降低,LDL水平也低于对照组,2组甘油三酯水平与高密度脂蛋白比较,差异无统计学意义(P>0.05)。见表2。HD组凝血酶原时间(PT)为(12.65±1.26)s,凝血酶时间(TT)为(20.32±5.99)s,纤维蛋白原(FIB)为(2.7±0.92)g/L,血糖为(7.57±5.93)mmol/L。对照组PT为(15.83±20.5)sTT为(18.74±1.67)s,FIB(2.51±0.6)g/L,血糖为(7.34±4.04)mmol/L,2组无显著差异(P>0.05)。
2.3治疗与转归HD组中7例死亡,4 例因病情较重自动出院,病死率为29.2%。对照组中死亡1例,自动出院1例,病死率为4%。2组病死率比较有显著差异(χ2=5.96,P<0.05)。去除死亡及自动出院患者后,对2组患者治疗前后的临床症状及出血量比较。2组患者治疗前出血量、NIHSS、GCS评分无显著差异。治疗后HD组NIHSS评分为(13.23±10.93)分,高于对照组的(8.45±5.39)分,差异有统计学意义(P<0.05)。HD组治疗后出血量较入院时有所减低,但差异无统计学意义(P>0.05)。NIHSS及GCS分值差异也无统计学意义(P>0.05)。对照组治疗后出血量及NIHSS较治疗前显著降低,GCS分值较治疗前增加,差异有统计学意义(P<0.05)。见表3。
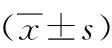
表2 2组患者实验室检查指标比较Table 2 Comparison of laboratory examination indicators of patients in 2
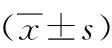
表3 2组治疗前后临床评分及出血量比较Table 3 Comparison of blood loss and clinical score before and after
3 讨论
脑出血具有高发病率、高复发率、高致残率的特点。不同病因的脑出血有不同的病理机制,预后也不尽相同。目前,对于维持性血液透析患者并发脑出血的临床特点及机制尚不明确,引起了广大学者的关注。对该类型病因的脑出血进行研究,有利于提高临床的治疗效果,对减轻患者的痛苦具有重要意义。
本研究发现,合并HD的脑出血患者血红蛋白(Hb)、血小板水平均显著低于对照组,这与以往报道相似[3-4]。贫血是HD的常见并发症,主要与内源性促红细胞生成素缺乏有关。近年来,HD患者的Hb水平及波动现象与临床预后的相关性逐渐引起重视。KURAGANO等[5]研究发现,HD并发贫血患者发生脑血管疾病以及住院的风险明显高于未并发贫血HD患者。HD患者Hb水平每上升10 g/L,患者病死率和住院风险分别下降5%和6%[6]。Hb 平均水平高的患者临床不良事件及死亡的发生风险相对较小,Hb 标准差、变异系数为发生脑血管事件的独立危险因素[7,28],其机制可能为Hb减少引起组织的慢性氧缺乏,出现局部的缺血、缺氧,造成器官功能障碍或器官损伤,导致并加重心脑不良临床事件的发生[8]。众所周知,血小板在凝血功能中起重要的作用,其数量减少会导致促凝活性减低,聚集与释放功能降低,使维护血管内皮完整性等功能下降,引起出血。研究发现,血液透析患者发生大出血的风险在服用阿司匹林后显著增加,减少阿司匹林后出血几率则减少[9-10,29]。此外,对脑出血患者来说,血小板减少可能是血肿扩大的因素之一。这种异常同时会影响脑出血的吸收。积极调整血红蛋白及血小板异常,对减少和改善HD合并脑出血的预后可能有一定帮助。
脑卒中患者常伴有血脂代谢的异常。自发性脑出血发病率增加与低水平的胆固醇相关性已在动物试验与人类的研究中得到证实。曾伟英等[11]对急性脑梗死后出血转化患者研究发现,其总胆固醇(TCH)、低密度脂蛋白(LDL)水平较无出血组显著降低,回归分析提示脑出血转化的危险因素保护性因素为LDL,说明低水平LDL与脑梗死后出血转化相关。在HD患者中,脂质代谢紊乱与脑血管事件的相关性也得到学者们的重视。国外研究表明,发生脑血管事件的患者以总胆固醇和低密度脂蛋白变化为主,脑梗死患者表现为LDL-C升高,脑出血患者表现为总胆固醇及LDL-C降低[12,30]。国内资料也显示MHD合并脑出血的患者表现为总胆固醇明显降低,与本研究相同[13,31]。合理的血脂水平能维持小血管壁的完整性,但水平减低可能会破坏小血管壁,引起血管内皮细胞受损,导致脑出血。然而,也有患者表现为甘油三酯及LDL升高[14-15,32],这可能与人群的纳入标准不同,患者的病程、发病类型差别,血脂测定的影响因素等有关。
研究发现,脑血管疾病是透析患者的前3位的死亡原因[16,33],而血液透析患者的卒中病死率比普通人群高3倍,其中脑出血比率高于脑梗死[17,34]。出血的部位可累及基底节区、脑叶、蛛网膜下腔[18],甚至胼胝体等[19]。WAKASUGI等[20]研究表明,脑出血是透析患者病死率最高的卒中亚型。本研究中,合并HD的脑出血患者病死率为29.2%,远高于对照组的脑出血患者,与国外研究一致[21]。此外,与对照组治疗后临床症状及血肿量均好转不同,合并HD的脑出血存活患者治疗前后的NIHSS、GCS并无显著改善,血肿吸收较少。SHIMOYAMA等[22]研究也显示,合并血液透析的脑出血患者早期病死率及血肿扩大均高于非透析者,说明其预后不良。导致脑出血的主要死亡原因为血肿占位和继发性脑水肿。HD患者由于肾功能异常,多为无尿状态,常规的脱水、利尿、降颅压对其并无显著疗效,最终因脑疝而死亡。透析过程本身对脑出血的血流动力学影响会引起颅内压水平的变化,加重脑水肿[23,35]。另一方面,血肿的内源性吸收,对于预防和减轻脑出血后脑组织损伤有重要意义。合并HD的脑出血患者血肿吸收较慢,这是其预后不佳的重要原因。内源性血肿清除系统主要包括CD36、CD47介导的红细胞吞噬、CD163、A 类清道夫受体以及内源性铁清除机制等[24-25]。已经发现肾功能异常患者存在A 类清道夫受体和CD36表达异常[26],这些损害可能影响了血肿的吸收。此外,合并HD的脑出血患者一般进行无肝素化透析,为防治体外凝血,透析时间较普通HD者少,会导致体内毒素清除不充分,从而影响血肿的吸收。改变透析模式如减少血流动力学的明显波动,调整透析时间等可能对脑出血的治疗有一定帮助[27,36]。
合并维持性透析的脑出血病死率高,预后不良。积极纠正贫血,调控血脂,促进血肿吸收可能对治疗有一定帮助。进一步阐明HD患者脑出血的病理机制,从而早期干预及治疗有助于减少脑血管事件的发生,改善长期预后,提高生活质量。

