分子蒸馏单甘酯对谷维素-谷甾醇凝胶油结构和性质的影响
李 胜,马传国,,*,刘 君,司天雷
由于传统的塑性脂肪主要是通过氢化、分提以及酯交换得到的,这些脂肪一般含较多的反式脂肪酸或饱和脂肪酸,长期摄入对人体健康不利[1-2],因此,需要寻找一种完全或部分替代塑性脂肪的新途径。研究发现[3],一些小分子(<1 000 Da)能通过氢键力、范德华力、π-π堆砌等非共价作用力结构化液体油形成无反式脂肪酸、低饱和脂肪酸固体脂肪[4-5],如果这些小分子还是一些对人体有益的成分,那么这种新型的脂肪将具有较大的市场潜力。然而,目前发现的小分子凝胶剂还比较少[6-12],一些凝胶剂还是偶然被发现的[13],对于每种凝胶剂形成凝胶油的机理还不是很清楚,因此,在寻找何种小分子能使植物油凝胶时还比较困难,此外还有一些小分子单独不能使植物油凝胶化,当同时加入两个小分子时,由于特殊的分子排列及形成高级网络结构也能使植物油凝胶化,甚至可能存在结合多个单独不能凝胶化的小分子能形成凝胶油的情况;因此,要寻找合适的凝胶剂有较多的工作需要进行。
目前发现的具有较大潜力的食品级凝胶剂是谷维素-谷甾醇以及单甘酯,然而这两种小分子形成的凝胶油具有一些缺陷,主要是谷维素和谷甾醇成本较高,另外,即使在其临界凝胶浓度下,形成的凝胶油硬度也很大,不易涂抹[14]。此外,还有研究表明这种凝胶油对水敏感[15],结构中小管的形成依赖于分子间氢键,谷甾醇能和水形成甾醇一水化合物结晶[16],干扰分子间氢键的形成。单甘酯凝胶油硬度较小,结合油的能力不强[17-18],因此,一种可行性的途径是结合谷维素-谷甾醇和单甘酯形成复合凝胶油。对于混合两种可以单独形成凝胶油的凝胶剂的研究目前鲜见报道,本实验研究这种更复杂的体系中,尤其是两种形成机理不同的凝胶剂分子间的相互影响,或许能从另外一个角度更好地理解凝胶油的形成机理,探讨不同机理形成凝胶油的规律,同时,根据终端固体油脂产品的性质,研发功能更加完善的凝胶油作为固体油脂替代品。
1 材料与方法
1.1 材料与试剂
一级压榨葵花籽油 中粮集团有限公司;γ-谷维素(纯度≥99%) 济宁市安康制药有限责任公司;β-谷甾醇(纯度≥99%) 湖北只启生物化工有限公司;分子蒸馏单甘酯(纯度≥90%,食品级) 郑州晨旭化工产品有限公司;三氟化硼、氢氧化钾甲醇溶液、无水乙醚、95%乙醇溶液、酚酞试剂、正己烷均为分析纯。
1.2 仪器与设备
DF-101Z集热式恒温加热磁力搅拌器 巩义市京华仪器责任有限公司;SHZ-D III循环水多用真空泵河南予华仪器设备有限公司;MQC-23脉冲式核磁共振仪英国Oxford公司;TAQ20差示扫描量热仪 美国TA公司;TA-XT Plus质构仪 英国Stable Micro Systems公司;Rheostress60流变仪 德国Haake公司;TGL-16G型飞鸽高速台式离心机 上海安亭科学仪器厂;XPV-203型偏振光显微镜 上海长方光学仪器有限公司;标准数字系列制冷/加热型循环水浴 美国Polyscience公司;WQF-510型傅里叶变换红外光谱仪北京北分瑞利分析仪器公司。
1.3 方法
1.3.1 凝胶油样品的制备
分别向葵花籽油中加入0%、1.2%、2.4%、3.6%、6.0%、8.4%、9.0%的分子蒸馏单甘酯和9.0%、7.8%、6.6%、5.4%、4.0%、0.6%、0%的谷维素-谷甾醇(谷维素和谷甾醇质量比3∶2),然后样品在90 ℃和0.1 MPa的真空条件下磁力搅拌加热40 min,置于5 ℃冷却12 h后室温贮藏至少3 d备用。
1.3.2 凝胶油硬度的测定
将在50 mL烧杯中凝固的30 g凝胶油(圆柱状,直径×高:45 mm×26 mm)置于25 ℃恒温水浴中保持24 h,用质构仪进行硬度测定。质构仪参数:探头P5,测前速率2 mm/s,测试中速率1 mm/s,测后速率2 mm/s,探头感受到5.0 g力后下压12.00 mm,取下压过程峰值为硬度值。
1.3.3 油结合能力的测定
取1.5 mL离心管并记其质量为a,称取约1 g的人造奶油样品置于1.5 mL离心管中,记含有凝胶油的离心管质量为b,将离心管置于高速台式离心机中,7 000 r/min离心30 min,将不能结合的油析出。然后将离心管取出,在滤纸上倒置5 min以使析出的油完全沥出,称此时离心管质量为c。持油性以离心后析油率表示,公式如下:

1.3.4 流变学性质的测定
取适量样品放在样品台上,用直径为35 mm、角度为1°的锥板,间隙设置为0.051 mm,在20 ℃条件下,保持应变为0.01%,对凝胶进行小变形频率扫描,测定弹性模量(G’)和黏性模量(G”)随频率变化的曲线,频率范围为0.1~100 Hz。
1.3.5 固体脂肪含量的测定
将凝胶油样品放入脉冲核磁共振仪专用玻璃管,在80 ℃熔化0.5 h以消除结晶记忆,然后转移至恒温器中,在0 ℃保留60 min,测得其固体脂肪含量,然后升温至5、10、15、20、25、30、35、40、45、50、55、60、65、70 ℃,各保留30 min,测得各个温度下的固体脂肪含量。
1.3.6 热力学分析
精确称取样品5~8 mg,程序升温,以30 ℃/min的速率快速将其从室温加热至120 ℃,并保持10 min以消除结晶记忆,再以10 ℃/min的速率降至20 ℃,并保持20 min使其充分结晶,再升温至120 ℃,升温速率为10 ℃/min。氮气流速为100 mL/min。
1.3.7 微观形态观察
取适量熔融样品于载玻片上,盖上盖玻片,用木塞将样品压平使其均一分布,室温下放置24 h,采用XPV-203型偏振光显微镜在室温下对样品的微观晶体形态进行观察。
1.3.8 红外光谱分析
取适量样品与KBr混合,研磨,制片,然后用红外光谱仪测定谷维素、谷甾醇与单甘酯的红外光谱即可。
将KBr研磨,制片,然后取适量微熔的凝胶油样品,均匀涂布在KBr薄膜上,冷却一段时间,至形成稳定的凝胶时,再用红外光谱仪测定。
1.3.9 氧化稳定性分析
每隔30 d测定一次过氧化值,过氧化值的测定参见GB/T 5538—2005《动植物油脂 过氧化值测定》。
1.4 数据处理
本研究获得的数据采用3 次重复实验的平均值表示。利用SPSS 16.0软件进行数据统计分析,P<0.05,差异显著。
2 结果与分析
2.1 谷维素与谷甾醇比例对复合凝胶油硬度和油结合能力的影响
凝胶剂添加量为9%,其中单甘酯为3.6%,谷维素-谷甾醇为5.4%,谷维素与谷甾醇比例与复合凝胶油硬度和油结合能力之间的关系如图1所示。当单甘酯添加量为3.6%时,谷维素与谷甾醇比例会影响凝胶油的外观,谷甾醇添加越多,凝胶油的透明度越低(图1A)。其比例对凝胶油的硬度和析油率也有显著影响(图1B),谷维素与谷甾醇比例为10∶0时(谷维素与单甘酯物质的量比0.86∶1),不能形成凝胶油(倒置流动);而两者比例为0∶10时(谷甾醇与单甘酯物质的量比1.25∶1),样品只能形成较弱的凝胶油;当谷维素与谷甾醇比例为6∶4时(谷维素、谷甾醇与单甘酯的物质的量比刚好为1∶1∶2)凝胶油的硬度最大,析油率最低。Bot等[19]研究发现在形成谷维素与谷甾醇凝胶油时,谷维素与谷甾醇添加量质量比为6∶4形成凝胶油的临界浓度更低,因为此时谷维素与谷甾醇恰好以物质的量比为1∶1参与氢键的形成。在本实验中3.6%的单甘酯并未形成凝胶油,根据文献[20]谷甾醇单独是不能形成凝胶油的,因此谷维素与谷甾醇比例为0∶10的样品能形成凝胶油是因为谷甾醇和单甘酯之间存在协同作用,由于谷甾醇和单甘酯形成的凝胶油较弱,所以单甘酯与谷甾醇间的协同作用很可能不是通过氢键形成的。
Gandolfo等[21]研究了16~22碳的脂肪酸和脂肪醇形成凝胶油的能力,发现相同碳原子数(C18)的脂肪酸和脂肪醇以7∶3和3∶7的比例形成凝胶油时具有协同效应。在此条件下硬脂酸和硬酯醇分子物质的量比分别为1∶3和3∶1,显然不是以1∶1形成氢键,而在形成的凝胶油中观察到大量的小晶体。Mohd等[22]研究了利用谷甾醇与单甘酯形成葵花籽油凝胶,发现形成的谷甾醇与单甘酯凝胶油中含有比单甘酯凝胶油更细小的结晶。在本实验中这种协同作用究竟是由弱的作用力还是产生更小的结晶引起的,亦或是两者皆有,需要进一步验证。
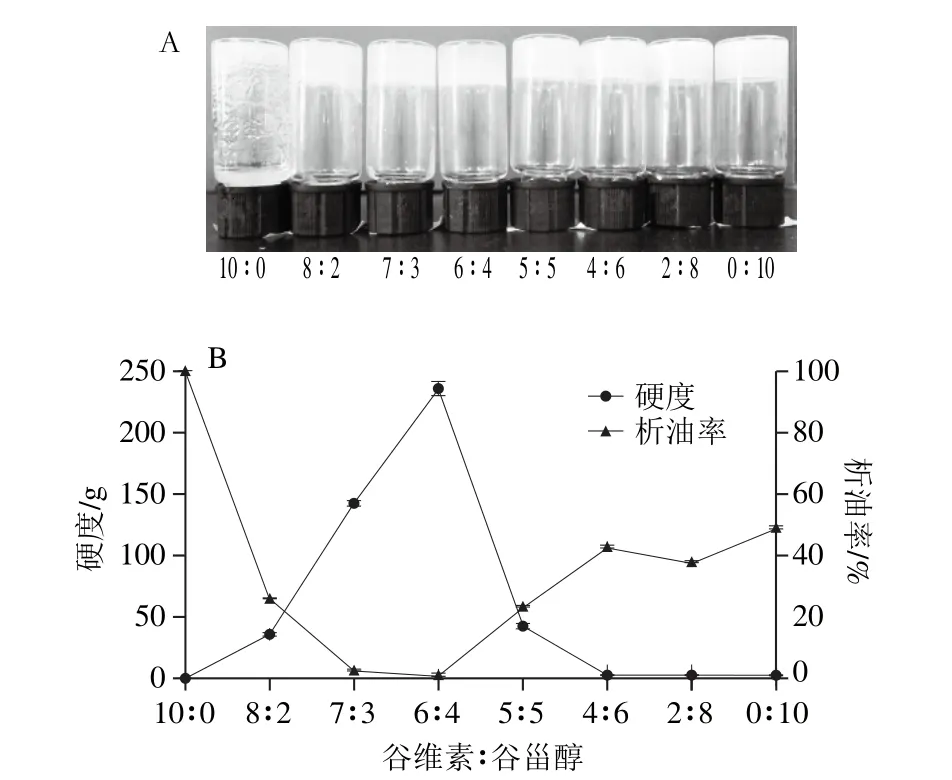
图1 谷维素与谷甾醇比例与复合凝胶油照片(A)及硬度和油结合能力之间的关系图(B)Fig. 1 Relationships between oryzanol to sitosterol ratio and the hardness and oil binding capacity of organogels
在后续的实验中,恒定谷维素与谷甾醇比例为6∶4,研究不同单甘酯添加量对复合凝胶油结构和性质的影响,进一步明确单甘酯在谷维素-谷甾醇凝胶油形成过程中所起的作用。
2.2 单甘酯的添加比例对复合凝胶油黏弹性的影响
通常凝胶状态材料的G’、G”比液体状态要大,且G’大于G”。不同单甘酯添加量下谷维素-谷甾醇与单甘酯复合凝胶油的频率扫描曲线如图2所示,所有样品的G’均比G”大(约一个数量级),此结果表明所有测试样品都形成了凝胶油结构。凝胶油的G’和G”与其网络结构的强度紧密相关,G’和G”与单甘酯添加量的关系如图3所示,随着单甘酯含量的增加,其黏弹性模量均呈现先减小后增加的趋势,有研究表明,这可能是由微观结构中结晶分支程度不同导致的,结晶分支程度越高的结构中结晶间的交联点越多,结构的强度也就越大[23]。
Wang Rongyao等[24]研究了冷却速率和温度对GP-l/ISA(二酰胺/异硬脂醇)凝胶形成的影响,表明凝胶的流变特性与交联区相互作用强度也有关系。在这项研究中高冷却速率(50 ℃/min)比低冷却速率(10 ℃/min)下形成的凝胶具有更高的弹性模量,另外,在高冷却速率下可以看到由球状晶体组成较高结晶分支程度的GP-1结构,研究发现这些球状晶体凝胶比纤维凝胶弹性模量更低,然而在线性黏弹区范围内球状晶体凝胶能承受更高的应变,笔者认为球状晶体凝胶弹性模量低是因为存在两种结构即:球状结晶内部分支纤维网络和球状结晶网络。因此,在球状晶体之间缺少相互渗透作用,导致球状晶体间交联区数量不足,球状晶体凝胶更大的临界应变是因为交联区相互作用的强度比纤维凝胶大。

图2 不同单甘酯添加量下谷维素-谷甾醇与单甘酯复合凝胶油的频率扫描曲线Fig. 2 Frequency scanning curves of organogels prepared with different monoglycerides concentrations

图3 G’和G”与单甘酯添加量的关系Fig. 3 Relationships between elasticity modulus and viscosity modulus and monoglycerides concentration
微观结构由最初的纤维网络到中间的球状晶体,最终变成针状结晶。因此,在复合凝胶油的球状结构中也可能含有球状结晶内部分支纤维网络和球状结晶网络,这种结构导致了结晶之间交联区数量的较少,以及凝胶油网络强度的降低,但是这种结构含有氢键等强的相互作用力,使得单甘酯添加量小于4.8%的复合凝胶油弹性模量比单甘酯凝胶油大,继续增加单甘酯含量,凝胶油中几乎没有氢键作用,并且交联区数量继续减小,因此,单甘酯添加量为6%和8.4%的复合凝胶油弹性模量小于单甘酯凝胶油,而在单甘酯凝胶油中由于形成了结构单一的细小针状结晶,交联区数量增加,从而使弹性模量增加。此外,还发现凝胶油体系的G’随着扫描频率的增加而略有增加,反映了凝胶油内部的网络是由非共价“物理”交联组成的[25]。
2.3 单甘酯的添加比例对复合凝胶油固体脂肪含量的影响

图4 不同单甘酯添加比例下复合凝胶油固体脂肪含量随温度变化曲线Fig. 4 Curves of solid fat content against temperature with different monoglycerides concentrations
如图4所示,总凝胶剂添加量为9%的所有凝胶油在0 ℃的固体脂肪质量分数几乎都小于9%,说明所测的固体脂肪基本成分为凝胶剂,在单甘酯凝胶油中固体脂肪质量分数稍大于9%是因为葵花籽油中也存在少量熔点稍高甘三酯;随着单甘酯含量的增加,固体脂肪质量分数从谷维素-谷甾醇凝胶油(0%单甘酯)的3.6%增加到单甘酯凝胶油(9%单甘酯)的9.3%,单甘酯添加量分别为6%、8.4%和9%的凝胶油在20 ℃前变化较平缓,20 ℃附近晶体结构逐渐被破坏,固体脂肪含量开始随温度急剧降低,说明凝胶油的凝胶-溶胶转变温度范围在20~65 ℃之间,在30 ℃时的固体脂肪含量已经减少了约20%,即凝胶剂形成的结构减少了20%,因此需要在低于20 ℃贮藏;而单甘酯添加量分别为0%、1.2%、2.4%和3.6%的凝胶油的转变温度范围为25~60 ℃。此外,在相同凝胶剂添加量的情况下,谷维素-谷甾醇凝胶油的固体脂肪含量比单甘酯凝胶油低,但宏观上,谷维素-谷甾醇凝胶油的硬度却比单甘酯凝胶油大很多,反映了谷维素-谷甾醇凝胶油中单位含量凝胶剂形成的结构比的单甘酯凝胶油强。
2.4 单甘酯的添加比例对复合凝胶油热力学性质的影响


图5 不同单甘酯添加比例下的复合凝胶油热力学熔化(A)和结晶(B)曲线Fig. 5 Thermodynamics curves of organogels with different monoglycerides concentrations
如图5所示,不同单甘酯添加比例下复合凝胶油热力学参数见表1。单甘酯添加量对谷维素-谷甾醇凝胶油的熔化温度影响不大,只有3.6%的样品熔化温度较低且比其他样品低10 ℃左右,复合凝胶油样品的熔点小于单一任何一种凝胶油的熔点。在结晶过程中随着单甘酯添加量从1.2%单甘酯增加到9%单甘酯,结晶峰值温度从25.43 ℃增加到51.87 ℃,而谷维素-谷甾醇凝胶油(未添加单甘酯)没有表现出结晶放热峰,这可能是由于样品的结晶过程非常缓慢,而差示扫描量热通常不适合检测这种极其缓慢的相变过程。从图4固体脂肪含量的变化可以看出凝胶-溶胶转变温度范围,而结晶和熔化峰值温度可以看成是在此范围内进行凝胶-溶胶转变的节点温度。

表1 不同单甘酯添加比例下复合凝胶油热力学参数Table 1 Thermodynamics parameters of organogels with different monoglycerides concentrations
单甘酯添加量对谷维素-谷甾醇凝胶油的熔化结晶焓具有一定影响,随着单甘酯添加量的增加,熔化焓逐渐减小,结晶焓逐渐增大。通过线性拟合得到熔化焓与单甘酯添加量之间的拟合方程为:y=-1.649x-0.428,R2=0.944 2;结晶焓与单甘酯添加量之间的拟合方程为:y=0.702x-0.841,R2=0.972 1,线性较好;根据文献中报道谷维素-谷甾醇凝胶油结构的形成是焓驱动的过程[26],焓变能近似反映凝胶油形成的自发性,焓变越大,形成凝胶油的自发性越强。结果表明,随着单甘酯含量的增加凝胶油形成的自发性增强。这可能是由于单甘酯降低了体系的界面张力和单位表面积,界面张力的减少导致更小的临界成核半径和更大的成核速率,使得凝胶化自发性增强。单甘酯的添加量与熔化焓、结晶焓拟合曲线如图6所示,凝胶油形成的焓变随单甘酯含量呈近似线性变化,揭示了复合凝胶油结构是纤维网络结构与结晶结构的混合,这与上述流变学实验中球状结晶中含两种类型结构的推论一致。熔化和结晶曲线始终分别都只有一个峰,说明虽然含有两种结构,但熔化和结晶没有呈现先后顺序,而是几乎同时结晶和熔化。

图6 单甘酯添加量与熔化焓、结晶焓拟合曲线Fig. 6 Fitting curves of melting enthalpy and crystallization enthalpy against monoglycerides concentration
2.5 单甘酯的添加比例对复合凝胶油微观形态的影响

图7 不同单甘酯添加比例凝胶油的偏光显微镜图Fig. 7 Polarization micrographs of organogels with different monoglycerides concentrations
如图7所示,凝胶油微观形态与纯单甘酯(图7h)、谷维素(没有明显形态)和谷甾醇(图7i)都不同。未添加单甘酯,即谷维素-谷甾醇凝胶油样品形成的是较为规则的纤维网状结构(图7a),与12-羟基硬脂酸的网状结构较为相似[27],而这两种凝胶油都是通过分子自组装形成的,其形态明显不同于其他样品。韩立娟等[14]认为在初级组装体生长过程中,溶解的凝胶剂分子,不管是以单体还是聚集体形式存在,都会扩散和依附到已形成的初级组装体表面。取决于溶解分子黏附到不同初级组装体表面的相对速率,组装体可能会沿着一维、二维或者三维方向生长。当聚集过程中垂直于层状晶面方向的生长速率大于平行于晶面方向上的生长速率时,会形成纤维状或片状结构。在其他样品中没能看到这种纤维网状结构,是因为谷维素-谷甾醇凝胶油形成的非晶纤维结构在偏光显微镜下不明显。在1.2%单甘酯(图7b)和2.4%单甘酯(图7c)样品中观察到球状结构,而在9%单甘酯(图7g)即单甘酯凝胶油样品中,可以看到单甘酯形成的是针状结晶,在2.4%单甘酯样品中由于单甘酯更多,球状结构更明显,这与Mustafa等[28]观察到的不同浓度单甘酯凝胶油的结构类似,因此,推测这些球状结构可能是单甘酯的添加量较少,不足以形成针状结晶时所形成的中间结构。在3.6%单甘酯(图7d)样品中开始有细小的单甘酯结晶前体开始形成,随着单甘酯所占比例逐渐增加,6.0%单甘酯(图7e)和8.4%单甘酯(图7f)样品中,基本都是球状晶体,比9%单甘酯(图7g)样品中针状结晶大。
2.1 节中探讨了谷甾醇和单甘酯的协同作用可能是由弱的作用力或产生更小的结晶引起,也有可能两者皆有,但从图7可以看出,含谷甾醇和单甘酯凝胶油的结晶相比单甘酯凝胶油结晶大,这说明这种协同效果只能是由弱的相互作用形成的。
2.6 单甘酯的添加比例对复合凝胶油氢键作用力的影响

图8 不同单甘酯添加比例下复合凝胶油红外光谱图Fig. 8 Infrared spectra of organogels with different monoglycerides concentrations
如图8所示,谷甾醇的羟基峰为3 459 cm-1,谷维素中没有羟基峰,单甘酯中存在甘油羟基峰为3 477 cm-1。而单甘酯凝胶油中则看不到明显的羟基峰位移变化,尽管单甘酯结构中含有羟基和羰基基团,也有文献中分析认为理论上单甘酯分子能形成分子内和分子间氢键[29],实际上,从图8可以推断单甘酯凝胶油中羟基峰为3 477 cm-1,因此,结构中很可能没有形成氢键。在谷维素-谷甾醇凝胶油中甾醇羟基峰明显向低波位移动至3 436 cm-1,说明谷维素-谷甾醇凝胶油中形成了氢键,从氢键的形成机理分析,β-谷甾醇可以通过羟基(R—O—H)与γ-谷维素中电负性强的羰基(—C=O)氧原子形成分子间氢键R—O—H…O—R’[30-34],此外,还可以看到,随着复合凝胶油中单甘酯所占比例的增加,羟基峰向低波位移动逐渐减小,氢键减弱;而当单甘酯添加量超过6%时,氢键作用几乎不存在。谷维素、谷甾醇、单甘酯及复合凝胶油甾醇羟基峰位置见表2。

表2 谷维素、谷甾醇、单甘酯及复合凝胶油甾醇羟基峰位置Table 2 Sterol hydroxyl peak positions of oryzanol, sitosterol,monoglycerides and organogels
2.7 单甘酯的添加比例对复合凝胶油贮藏稳定性的影响
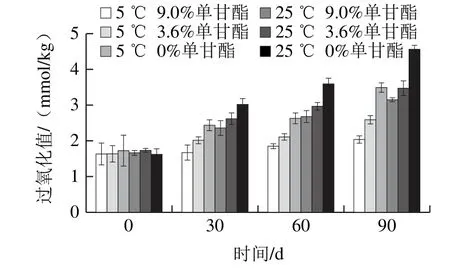
图9 单甘酯的添加比例对复合凝胶油氧化稳定性的影响Fig. 9 Effect of monoglycerides concentration on oxidation stability of organogels
如图9所示,随着时间的延长,样品的过氧化值均呈现一定程度的增加,其中,5 ℃条件下贮藏的样品过氧化值明显比25 ℃的小,而且氧化速率上0%单甘酯样品最快,3.6%样品次之,而9.0%单甘酯样品最慢;这可能是由于随着贮藏温度的升高,凝胶剂分子在植物油中的溶解度提高,结晶量降低引起的。而氧化速率与预期中谷维素-谷甾醇凝胶油氧化更慢,这可能是由于虽然谷维素具有一定的抗氧化作用,但其凝胶化机理与单甘酯不同,其形成的结构中有较多的油脂暴露在空气中,而单甘酯由于具有较强的表面活性,能更多存在于油脂和空气界面保护油脂。因此,从一定程度上说,单甘酯的加入有利于凝胶油的长期贮藏。
3 结 论
通过考察恒定单甘酯添加量下不同谷维素与谷甾醇比例对复合凝胶油硬度和析油率的影响,分析了凝胶剂分子间相互作用,即单甘酯与谷甾醇分子存在着范德华力等弱的非氢键作用力;随后考察了最优谷维素与谷甾醇比例下,不同单甘酯添加量对复合凝胶油结构和性质的影响,发现随着单甘酯含量的增加,复合凝胶油中氢键强度逐渐减弱直至消失,且偏光显微镜形态发生纤维-球晶-针状结晶的转变,这可能是由于单甘酯改变了谷维素-谷甾醇凝胶油成核-生长-分支方式,从而导致流变学和热力学等宏观性质均产生较大改变。由于单甘酯对谷维素-谷甾醇凝胶油结构和性质的影响较大,因此用合适的单甘酯添加量可以较好地改性谷维素-谷甾醇凝胶,制备出符合市场需求的固体脂肪。另一方面,单甘酯成本更低,氧化慢,用其替代一部分谷维素-谷甾醇凝胶具有较大的实用意义。由于发现新的凝胶剂难度非常大,在未能发现更好的凝胶剂之前,将两种具有前景又各有缺点的凝胶剂结合,在未来的一段时间将会越来越受到人们的重视。

