在猪油体系中模拟茶叶籽油酚类物质和VE在贮藏过程中的抗氧化活性及相互作用关系
刘国艳,徐 鑫,刘 莉,张 洁,庄林武,金青哲,王兴国,张 晖,*
茶叶籽油作为一种新兴的可食用植物油脂,不饱和脂肪酸含量达80%以上,其中多不饱和脂肪酸含量约25%左右,是大多数植物油的2 倍[1-3]。油脂的不饱和程度与氧化酸败呈正相关,但茶叶籽油在常温条件下保存1~2 a后品质良好,氧化稳定性较高[4-5],这应与其中酚类、甾醇、角鲨烯、VE等天然抗氧化活性成分有关[6-7]。茶叶籽油中酚类物质主要包括没食子儿茶素、儿茶素、表没食子儿茶素、表没食子儿茶素没食子酸酯、表儿茶素、没食子儿茶素没食子酸酯、表儿茶素没食子酸酯、咖啡酸、没食子酸酯、山柰酚、肉桂酸、槲皮素、没食子酸、咖啡酸、芦丁、槲皮素等[8-10]。酚类物质和VE均具有较强的抗氧化效果[11-12],但二者之间在不同含量和结构组成时可能存在多种抗氧化相互作用类型,在茶叶籽油中天然存在的这两类物质的抗氧化能力和相互作用关系鲜见报道。由于多数食用植物油中源于次生代谢的活性物质含量丰富且种类繁多,在一般的植物油体系中,研究上述物质对脂肪酸组成复杂的植物油氧化稳定性的影响及相互作用关系存在诸多困难。而猪油的脂肪酸组成相对简单,且自身存在的抗氧化成分极少,本研究以其作为参考体系,模拟茶叶籽油自身所含有的酚类物质和VE在油脂加速氧化过程中的抗氧化能力及相互作用关系,避免因复杂的脂肪酸组成及其他抗氧化活性物质带来的干扰,旨在研明富含不饱和脂肪酸的茶叶籽油具有强氧化稳定性的机理,为茶叶籽油适度精炼提供理论依据。
1 材料与方法
1.1 材料与试剂
茶叶籽 云南随县洪山镇云雾山茶场;猪板油市售。
VE(α-生育酚,纯度>96%) 美国Sigma-Aldrich公司;芦丁标准品 南京替斯艾么中药技术研究所;异丙醇、正己烷、甲醇、石油醚、冰醋酸(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
LC-20AT高效液相色谱仪 日本岛津公司;UV 1000紫外-可见分光光度计 天美科技有限公司;EYELA MG-2200氮吹仪、EYELA N-1200B旋转蒸发仪东京理化器械株式会社;FW 100高速粉碎机 天津市泰斯特仪器有限公司;D2F-6020真空干燥箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 茶叶籽油制备
茶叶籽烘干后粉碎,加入正己烷,料液比为1∶10(g/mL),采用超声波辅助提取法,超声功率280 W,20 min后45 ℃水浴搅拌,提取1.5 h,旋转蒸发去除溶剂。
1.3.2 猪油制备
称取一定量的猪板油,清洗干净后于绞肉机中搅碎,置于烧杯中按料液比1∶4(g/mL)加水混匀,于90 ℃水浴20 min,8 000 r/min离心30 min,取上层猪油样品。
1.3.3 茶叶籽油酚类物质的制备
称取1 kg茶叶籽油于10 L反应釜中,加异丙醇(料液比1∶1(g/mL)),300 r/min混匀,加甲醇(料液比1∶5(g/mL)),混匀,于50 ℃水浴萃取30 min,混匀,静置1 h,从反应釜放料口排去下层,将上清液50 ℃旋转蒸发至2 L,按照上述步骤重复萃取3 次,合并3 次上清液,50 ℃旋转蒸发去除溶剂。
脱脂处理:取上述样品10 g,用甲醇定容至150 mL,再加入300 mL的正己烷脱脂,静置30 min,取下层,萃取3 次,合并3 次萃取液,50 ℃旋干。按照上述方法多次制备并混匀,测定其总酚含量。
1.3.4 常温氧化实验
称取300 g茶叶籽油于封口透明锥形瓶,置于室温避光贮藏12 个月,每隔30 d测一次油样的过氧化值和酸值,以过氧化值和酸值上升速率来衡量茶叶籽油的贮藏稳定性。
1.3.5 恒温加速氧化实验
采用Schaal法(63±1)℃烘箱加速氧化,对不同组的油样进行为期一个月的油脂氧化稳定性实验,每隔12 h搅拌1 次,每隔3 d取一次样,每次取样5.0 g,测定各氧化指标及活性成分含量。
实验分5 组进行,每组样品具体如下:
茶叶籽油组:称取400 g茶叶籽油于棕色锥形瓶,敞口避光置于烘箱;猪油组:称取400 g猪油于棕色锥形瓶,敞口避光置于烘箱;猪油+VE组:称取400 g猪油+VE(α-生育酚标准品)0.112 g于棕色锥形瓶,使得VE含量为382 mg/kg(依据茶叶籽油中VE实际含量),敞口避光置于烘箱;猪油+酚类物质组:称取400 g猪油+茶叶籽油酚类物质于棕色锥形瓶,使得总酚含量为530 mg/kg(依据茶叶籽油中酚类物质实际含量),敞口避光置于烘箱;猪油+VE+酚类物质组:称取400 g猪油+茶叶籽油酚类物质+VE(α-生育酚标准品)0.112 g,于棕色锥形瓶,使得总酚和VE含量分别为530、382 mg/kg,敞口避光置于烘箱。
1.3.6 氧化指标的测定
过氧化值:依据GB/T 5538—2005《动植物油脂过氧化值测定》测定[13];酸值:依据GB/T 5530—2005《动植物油脂酸值和酸度测定》测定[14];茴香胺值:依据GB/T 24304—2009《动植物油脂茴香胺值的测定》测定[15];丙二醛含量:依据GB/T 5009.181—2003《猪油中丙二醛的测定》测定[16]。
1.3.7 活性成分测定
采用福林-酚法[17]测定总酚含量:1 g油样(茶叶籽油或猪油)溶于1 mL异丙醇,加5 mL甲醇50 ℃浸提30 min,8 000 r/min离心5 min,重复萃取3 次,合并上清液,40 ℃条件下氮气吹干,用100%甲醇定容至5 mL后取1 mL与1 mL福林-酚试剂混合,加入3 mL 7.5% Na2CO3于室温条件下静置反应1 h,于波长765 nm测定吸光度。以没食子酸做标准曲线。
VE含量的测定参照文献[18],并略作修改。取1.0 g样品油,精确至0.001 g,正己烷定容至10 mL,取VE混标0.01 g定容至10 mL,进行高效液相色谱分析。
高效液相色谱条件:Waters Spherisorb Silica色谱柱(4.6 mm×250 mm,5 µm);流动相:正己烷-异丙醇(98.5∶1.5,V/V)溶液;流速1 mL/min;进样量10 µL;柱温25 ℃;紫外检测器;检测波长295 nm。
1.3.8 酚类物质与VE相互作用类型
根据过氧化值,确定诱导时间、传播时间,进而计算协同价,相关计算方法如下[19-23]:
诱导时间、传播时间的计算:油脂氧化反应在动力学上属于一级反应,反应方程为:-dc/dt=kc,进行积分推导得方程:lnc=-kt+lnc0。其中c为过氧化值(mmol/kg),k为速率常数,c0为起始油样的过氧化值(mmol/kg)。令y=lnc、x=t,进行回归计算,即可得到(63±1)℃条件下各油样的回归方程。作图法确定空白组的氧化诱导时间IPA,根据方程确定此时的过氧化值CA。选定空白组的过氧化值达某一固定值CB,此时的时间减去诱导时间IPB。其余组别根据上述方程求出样品的过氧化值达到CA时所需的时间,即为诱导时间,过氧化值达到CB的时间减去IPA即为传播时间IPB。
协同价按下式计算:
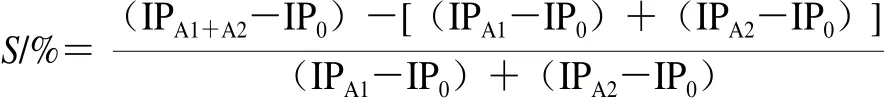
式中:S为协同价;A1、A2为酚类物质和VE;S小于0表示A1和A2呈拮抗作用,数值越小,代表拮抗作用越强;S等于0表示A1和A2为加和作用;S大于0表示A1和A2呈协同作用,数值越大,代表协同作用越强;若IPA1=IP0,且IPA2≠IPA1+A2≠IP0,则A1对A2起增效作用;若IPA1=IP0,且IPA2=IPA1+A2≠IP0,则A1与A2无作用。
1.4 数据统计分析
采用SPSS Statistics 19.0软件进行相关性分析。
2 结果与分析
2.1 茶叶籽油常温贮藏稳定性分析
过氧化值主要反映油脂氧化的初级阶段,是用来测定油脂在贮藏过程中氧化的初级产物量[24-26],过氧化值国家标准为6 mmol/kg。酸值主要表示油脂中游离脂肪酸的含量,油脂在贮藏过程中发生水解或热裂解反应从而导致游离脂肪酸的增加,GB/T 2716—2005《食用植物油卫生标准》对食用植物油有统一的最高限量标准,即食用植物油成品油酸值不大于3 mg/g,植物原油的酸值不大于4 mg/g[27]。如图1所示,茶叶籽油过氧化值、酸值随着贮藏时间的延长逐渐增加,茶叶籽油过氧化值在4月和8月时出现下降的现象,这是因为过氧化值反映的是油脂中氢过氧化物的含量,氢过氧化物由油脂中的不饱和酯在氧化过程中形成,性质极不稳定,易进一步分解形成醛、酮、酸等小分子物质,这意味着油脂氧化形成氢过氧化物的同时也伴随着氢过氧化物的分解,是一个动态过程,由此推测在这两段时间里,茶叶籽油中氢过氧化物进行降解反应速度大于生成速度,所以出现了过氧化值下降的现象[28]。12 个月后过氧化值和酸值分别达3.27 mmol/kg和1.78 mg/g,均在安全质量范围之内。徐莉等[29]测定橄榄油常温条件下贮藏35 d时过氧化值为5 mmol/kg;吕艳春等[30]测定了大豆毛油常温贮藏5 个月后过氧化值达14 mmol/kg。与上述植物油相比,茶叶籽油在常温条件下表现出较强的耐贮性,这可能是源于其富含酚类、VE、甾醇等活性抗氧化物质。其中酚类及VE在油脂氧化稳定性方面贡献突出,而关于这2 种物质的抗氧化能力及相互作用关系则需进一步探讨。
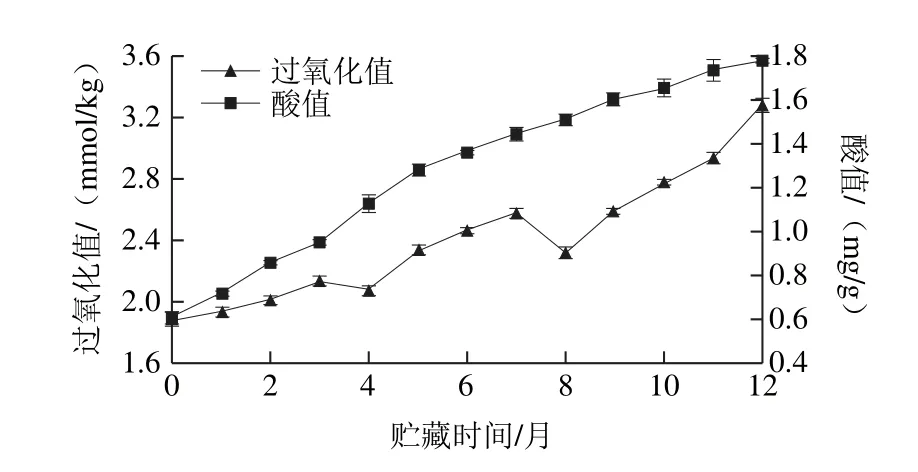
图1 常温贮藏条件下茶叶籽油过氧化值和酸值的变化Fig. 1 Changes in peroxide value and acid value of tea seed oil during storage at room temperature
2.2 茶叶籽油酚类物质和VE的抗氧化活性及相互作用分析
2.2.1 茶叶籽油和猪油的活性成分及理化指标
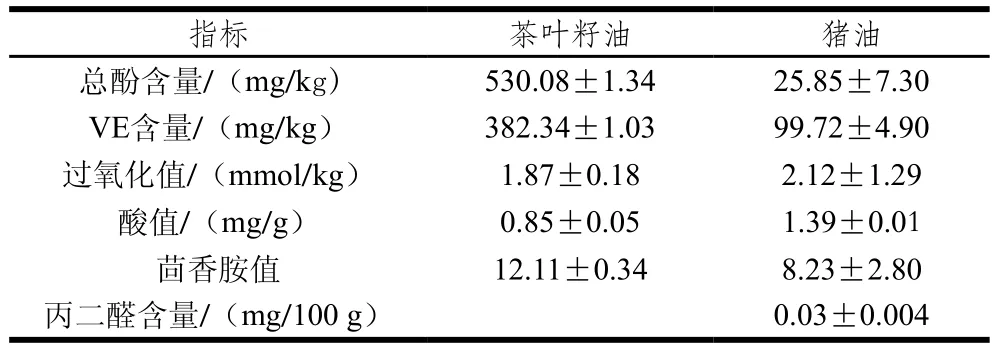
表1 茶叶籽油和猪油各活性成分与理化指标Table 1 Physicochemical properties and bioactive components of tea seed oil and lard
如表1所示,茶叶籽油中总酚与VE含量较高,极可能是茶叶籽油中的主要天然抗氧化剂,赋予茶叶籽油较强的抗氧化能力,抑制或延缓不饱和脂肪酸的氧化酸败,成为茶叶籽油耐贮性强的本质原因。然而,茶叶籽油酚类物质组成非常复杂,会干扰其对茶叶籽油抗氧化效果的测定。猪油中总酚与VE等天然抗氧化成分含量较低,体系较简单。因此,以猪油为研究体系,采用Schaal法(63±1)℃烘箱加速氧化,进行后续实验。
2.2.2 加速氧化过程中茶叶籽油和猪油的氧化稳定性分析
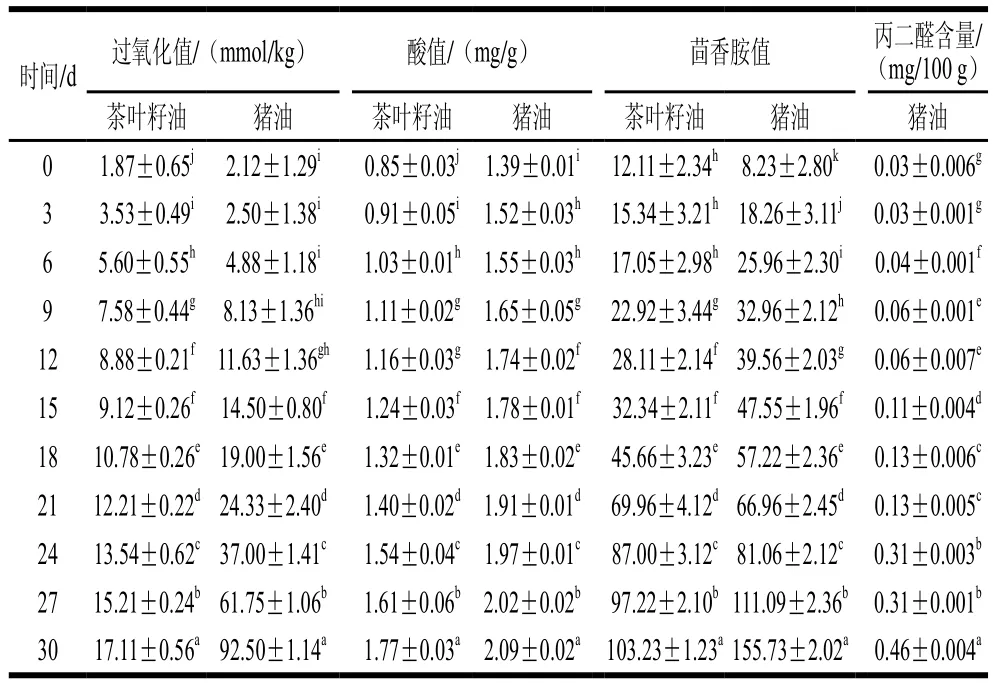
表2 加速氧化过程中茶叶籽油和猪油的氧化指标变化Table 2 Change in oxidation indexes of tea seed oil and lard during accelerated oxidation
茴香胺值和丙二醛含量能很好地反映油脂氧化程度[31-32]。但丙二醛主要用于动物油脂氧化稳定性的测定,尤其用于反映猪油的氧化酸败程度,因此未对茶叶籽油进行丙二醛含量的分析。由表2可知,在加速氧化过程中,茶叶籽油和猪油的各氧化指标均随时间的延长逐渐上升,但猪油的上升速率要显著高于茶叶籽油,在加速氧化30 d后,猪油过氧化值是茶叶籽油的5.41 倍,茴香胺值是茶叶籽油的1.51 倍。结合表1可以看出,茶叶籽油总酚和VE的含量分别是猪油的16.33 倍和3.83 倍,因此推测茶叶籽油较好的氧化稳定性与其具有较高含量的活性物质密切相关。由于猪油中活性物质含量较低,因此以猪油为载体,探究茶叶籽油中酚类物质和VE对猪油氧化稳定性的影响及二者的相互作用类型,可有效降低油脂中原有活性物质的干扰。
2.2.3 加速氧化过程中VE对油脂氧化稳定性的影响
由表3可知,在添加VE后,猪油的氧化稳定性显著提高,加速氧化30 d后过氧化值、酸值、茴香胺值、丙二醛含量与空白组猪油相比分别下降了72.97%、3.83%、54.62%、47.83%。结合表4的相关性分析可进一步证明VE对油脂氧化稳定性具有重要贡献。
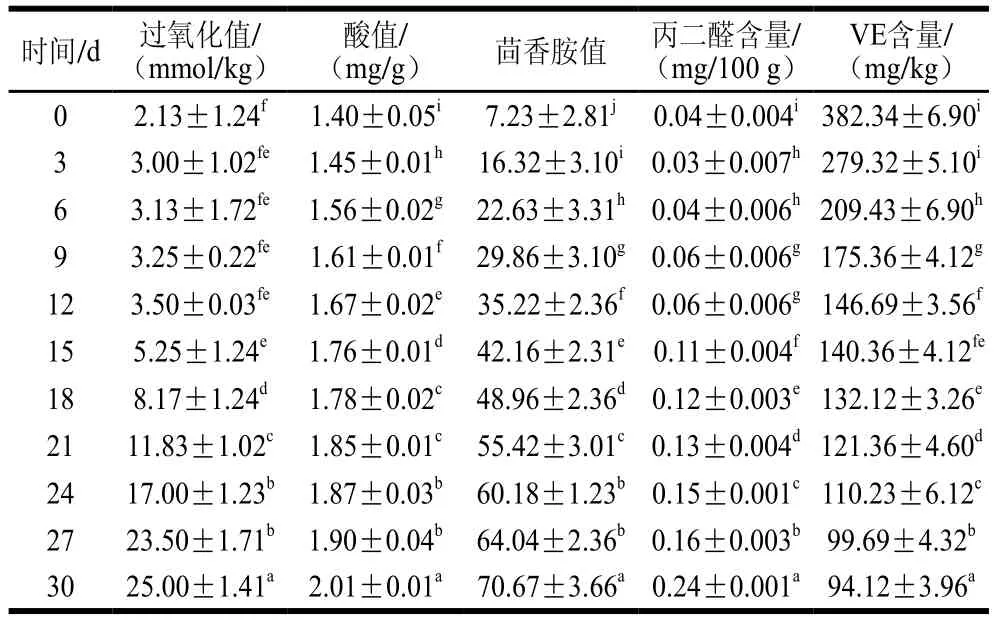
表3 加速氧化过程中添加VE的猪油氧化指标及VE含量变化Table 3 Changes in oxidation indexes and VE content of lard with added VE during accelerated oxidation
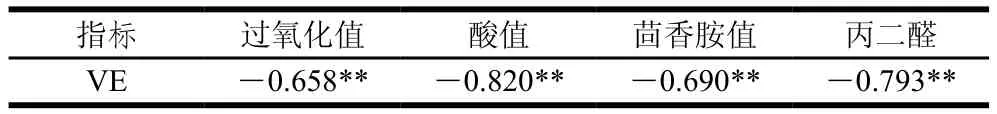
表4 VE与各氧化指标的相关性分析Table 4 Correlation analysis of VE with each oxidation index
2.2.4 加速氧化过程中酚类物质对油脂氧化稳定性的影响
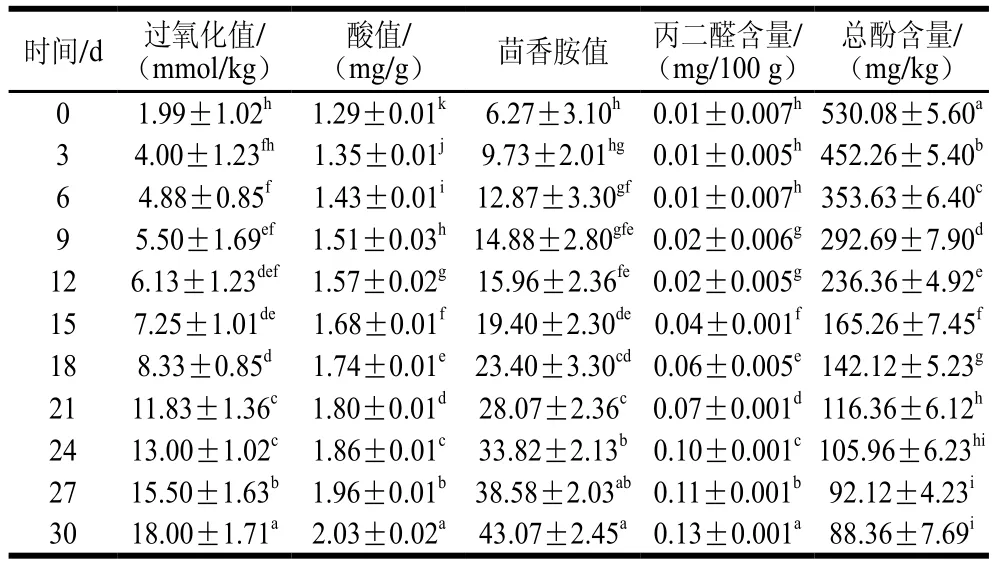
表5 加速氧化过程中添加酚类物质的猪油氧化指标及总酚含量变化Table 5 Changes in oxidation indexes and polyphenol content of lardwith added polyphenols during accelerated oxidation
由表5可知,在添加茶叶籽油酚类物质后,猪油的氧化稳定性较空白组和添加VE组均有显著提高。加速氧化30 d后过氧化值、酸值、茴香胺值、丙二醛含量与空白组猪油相比分别下降了80.54%、2.87%、72.26%、71.74%,对比添加VE组可知,酚类物质抑制油脂氧化产物的生成效果明显高于VE,尤其在抑制二级氧化产物的生成上贡献突出,可能是因为VE分子中芳香烃环上只有一个氢被羟基取代,而酚类物质中有多个羟基,且酚类物质比VE多2 个苯环,酚类物质分子被氧化后产生的自由基间也会互相作用,生成新的酚型化合物,发挥抗氧化功能,故其抗氧化能力相对于VE会更强[33-36]。表6的相关性分析进一步证明油脂的氧化稳定性与茶叶籽油酚类物质尤其是酚类物质的含量密切相关。

表6 酚类物质与各氧化指标的相关性分析Table 6 Correlation analysis of polyphenols with each oxidation index
2.2.5 加速氧化过程中VE和酚类物质共同存在对油脂氧化稳定性的影响
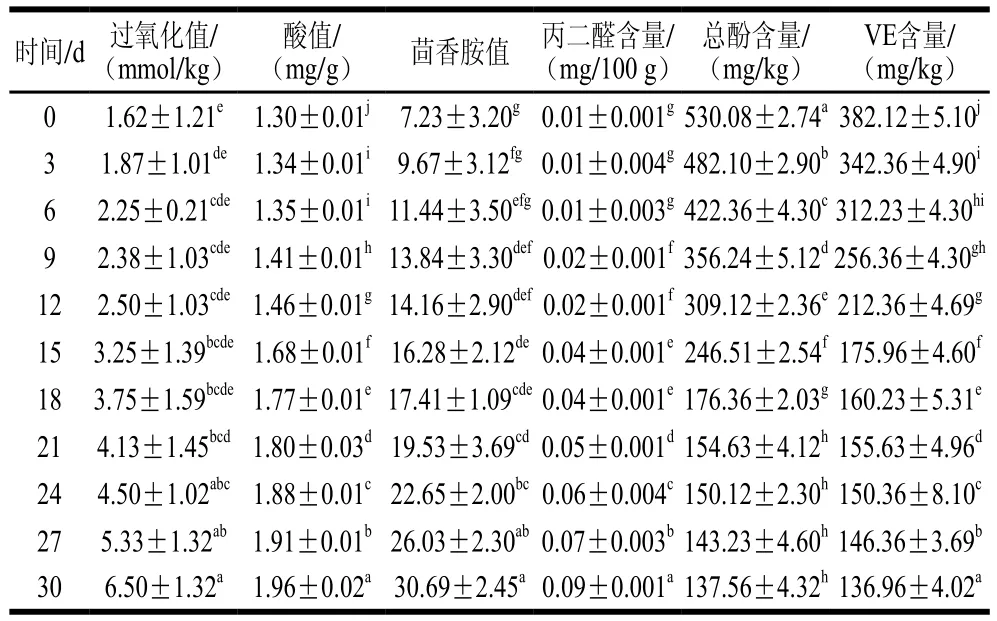
表7 加速氧化过程中添加VE和酚类物质的猪油氧化指标及VE和总酚含量变化Table 7 Changes in oxidation indexes, VE, polyphenols of lard with addition of VE and polyphenols during accelerated oxidation

表8 VE、酚类物质与各氧化指标的相关性分析Table 8 Correlation analysis of VE and polyphenols with each oxidation index
由表7可知,加速氧化30 d后过氧化值、酸值、茴香胺值、丙二醛含量与空白组猪油相比分别下降了92.97%、6.22%、80.20%、80.43%,表明二者同时添加后,氧化产物的生成得到显著抑制,与分别添加相比,抗氧化能力显著增强。结合表8的相关性分析,与VE相比,酚类物质与各氧化指标的相关系数较大,表明其抗氧化贡献越大。
2.2.6 VE和酚类物质抗氧化相互作用分析
作空白猪油组过氧化值与时间的关系图,通过双切线法求得其氧化诱导时间为14.72 d。油脂氧化反应在动力学上属于一级反应。作油脂的ln(1/POV)-t图,求得一级反应速率常数k和相关系数(R2)。空白猪油组的一级反应速率常数k为0.132 8,R2=0.913 9;猪油+VE组的一级反应速率常数k为0.088,R2=0.949 8;猪油+酚类物质组的一级反应速率常数k为0.064 3,R2=0.953 4;猪油+VE+酚类物质组的一级反应速率常数k为0.044 6,R2=0.989 1。根据方程确定此时的过氧化值CA为14.98 mmol/kg,其余组别根据上述方程求出样品的过氧化值达到CA时所需的时间,即为诱导时间,猪油+VE组的氧化诱导时间为21.59 d;猪油+酚类物质组的氧化诱导时间为31.42 d;猪油+VE+酚类物质组的氧化诱导时间为49.78 d。IP0=14.72 d,IPA1=21.59 d,IPA2=31.42 d,IPA1+A2=49.78 d。求得S为48.75%,S大于0表示A1和A2呈协同作用,数值越大,代表协同作用越强。由此可知,在猪油恒温加速氧化过程中,VE与茶叶籽油酚类物质呈协同作用。
3 结 论
在室温条件下贮藏1 a,茶叶籽油酸值和过氧化值上升非常缓慢,表明茶叶籽油品质稳定,耐贮性强。在此过程中,茶叶籽油酚类物质和VE含量缓慢下降表明它们参与了抑制油脂自动氧化过程,但并未被大量消耗。在模拟茶叶籽油中酚类物质和VE在猪油氧化稳定性实验中发现,随着氧化时间的延长,各组猪油的过氧化值、酸值、茴香胺值都逐渐增加,同时,VE和总酚含量逐渐下降,在加速氧化前期,氧化指标上升缓慢,活性成分含量迅速下降,氧化后期氧化指标迅速上升,活性成分含量下降趋势变缓,各氧化指标的上升趋势与活性成分的下降趋势基本一致,二者呈现显著的负相关性。猪油添加VE后的氧化稳定性显著提高,加速氧化30 d后过氧化值、酸值、茴香胺值、丙二醛含量与空白组猪油相比分别下降了72.97%、3.83%、54.62%、47.83%;在添加酚类物质后,加速氧化30 d后过氧化值、酸值、茴香胺值、丙二醛含量与空白组猪油相比分别下降了80.54%、2.87%、72.26%、71.74%,不同组别的氧化指标上升趋势:猪油>猪油+VE>猪油+酚类物质>猪油+VE+酚类物质。结果表明,茶叶籽油酚类物质和VE都能大幅度延缓猪油的氧化酸败,表现出很强的抗氧化活性,且茶叶籽油酚类物质抗氧化效果优于VE。经相互作用分析,在猪油恒温加速氧化过程中,VE与茶叶籽油酚类物质呈协同作用。以猪油代替其他油脂模拟油脂自身活性成分对其氧化稳定性的影响及相互作用关系,尽可能避免油脂中其他活性成分的干扰,为油脂氧化稳定性的相关研究提供方法学参考。由于茶叶籽油中酚类物质种类复杂,其内在的抗氧化作用机制及相互作用关系还有待深入研究。

