湿热条件下大豆分离蛋白与葡萄糖、麦芽糖的美拉德反应
王鲁慧,肖军霞,徐同成,王 鹏,黄国清,*
大豆分离蛋白(soy protein isolate,SPI)主要由清蛋白和球蛋白组成,蛋白质含量在90%以上[1],含有多种必需氨基酸及丰富的不饱和脂肪酸、钙、磷、铁、膳食纤维等[2]。
作为少数几种可以与动物性蛋白相提并论的植物源蛋白之一,SPI在食品工业中占有重要地位,但由于其溶解性、乳化性和起泡性等功能性质较差,在一定程度上限制了应用,因此对其进行改性具有重要的实际应用价值。改性是指利用生化和/或物理因素使蛋白质的氨基酸残基和多肽链发生某种变化,引起蛋白大分子空间结构和理化性质改变,从而获得较好的功能特性和营养特性[3]。SPI的改性方法分为物理改性、化学改性、酶法改性和基因工程改性[4-7]。
糖基化能有效改善SPI的功能性质,美拉德反应是实现蛋白质糖基化的一种重要途径[8-9]。美拉德反应由于安全性高、条件温和及操作简单等特点,在SPI的改性中具有很大的应用潜力。例如,曾永昶等[10]通过对SPI的糖基化改性延长了其贮藏期;布冠好等[11]通过对SPI进行糖基化改性降低了抗原性和致敏性;于莉萍等[12]研究用美拉德反应提高SPI凝胶性的工艺条件,使得SPI的凝胶性显著提高;Hernández-García等[13]表明与葡萄糖(glucose,Glu)的美拉德反应可改善血浆蛋白和鸡蛋清的乳化性能;Chen Xiumin[14]和Morales[15]等通过对SPI进行糖基化改性提升了抗氧化性。在这些报导中多是有针对性的对某些性质如溶解性、乳化性和抗氧化性等进行研究,却未对SPI美拉德反应产物进行更加深入的表征。
本实验拟在湿热条件下使SPI与Glu、麦芽糖(maltose,Mal)发生美拉德反应,研究各条件对美拉德反应程度的影响,并对所得产物的部分性质进行表征。旨在为美拉德反应在SPI改性中的实际应用提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
SPI(食品级) 青岛天新食品添加剂有限公司;Glu(分析纯) 天津市鼎盛鑫化工有限公司;Mal(分析纯) 上海市笛柏化学品技术有限公司;金龙鱼精炼大豆油(食品级) 盛达食品有限公司;氢氧化钠、盐酸、乙酸、甲醇、95%乙醇溶液、磷酸、丙三醇(均为分析纯)莱阳市康德化工有限公司;磷酸氢二钠、磷酸二氢钠、考马斯亮蓝G250、双丙烯酰胺(均为分析纯),牛血清白蛋白(生化试剂) 天津市巴斯夫化工有限公司;丙烯酰胺(化学纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Mr-90恒温磁力搅拌器 上海泸西分析仪器厂有限公司;DL-5-B低速大容量离心机 上海安亭科学仪器厂;T18高速分散仪 德国IKA公司;ZEN3690 Nano ZS90纳米粒度及ζ电势仪 英国马尔文实验设备公司;MS104TS分析天平、Delta320 pH计、TGA 2-SF热重分析仪 瑞士梅特勒-托利多仪器公司;FDU-1200真空冷冻干燥机 上海爱朗仪器有限公司;UV-2000紫外分光光度计 上海尤尼科仪器有限公司;F-2700荧光分光光度计 日本日立公司;DYY-12电脑三恒多用电泳仪北京六一仪器厂;ST5凝胶成像仪 法国Vilber Lourmat公司;NicoletIR200傅里叶变换红外光谱仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 美拉德反应条件的优化
1.3.1.1 反应温度对美拉德反应的影响
准确称取8 g SPI,按质量比4∶1加入2 g Glu或Mal,用190 mL蒸馏水溶解,使SPI质量分数达到4%。用NaOH溶液调节反应体系pH值至9.0,分别置于40、50、60、70、80、90、100 ℃水浴条件下反应4 h后,冷却至25 ℃,3 000 r/min离心15 min,测定美拉德反应发生的程度。
1.3.1.2 反应时间对美拉德反应的影响
准确称取8 g SPI,按质量比4∶1加入2 g Glu或Mal,用190 mL蒸馏水溶解,使SPI质量分数达到4%。用NaOH溶液调节反应体系pH值至9.0,置于80 ℃水浴条件下分别反应2、4、6、8、10 h后,冷却至25 ℃,3 000 r/min离心15 min,测定美拉德反应发生的程度。
1.3.1.3 混合比例对美拉德反应的影响
准确称取4 g SPI,按质量比4∶4、4∶2、4∶1.5、4∶1、4∶0.5分别加入Glu或Mal,用蒸馏水溶解,使SPI质量分数达到4%。用NaOH溶液调节反应体系pH值至9.0,置于80 ℃水浴条件下反应4 h后,冷却至25 ℃,3 000 r/min离心15 min,测定美拉德反应发生的程度。
1.3.2 美拉德反应程度的检测
美拉德反应中间产物在波长290 nm处具有特征性吸收,最终产物在波长420 nm处具有特征性吸收[14],因此可用波长290 nm和420 nm处的吸光度表示美拉德反应的程度。取离心后的上清液分别在上述2 个波长处测定吸光度,以蒸馏水作为对照。
1.3.3 美拉德反应产物的表征
将天然SPI(SPI-N),加热后的SPI(SPI-H),还原糖(Glu、Mal)与SPI的简单混合物(SPI-Glu-Mix、SPIMal-Mix)以及它们在优化条件下制备的美拉德反应产物(SPI-Glu-MRPs、SPI-Mal-MRPs)放入-18 ℃条件下冷冻48 h,再将其放入真空冷冻干燥机中冻干,研磨成均匀的粉末待用。
1.3.3.1 溶解度测定
采用考马斯亮蓝G250染色法[16]。取6 支10 mL的带塞试管,分别加入1 000 μg/mL的牛血清白蛋白溶液0、0.1、0.2、0.3、0.4、0.5 mL后补足蒸馏水到1 mL,从而得到0~500 μg/mL的牛血清白蛋白稀释溶液,取各质量浓度的稀释液0.1 mL分别加入5 mL 100 μg/mL的考马斯亮蓝G250溶液,旋涡振荡混匀,静置2 min,于波长595 nm处测定吸光度,绘制标准曲线。
参照上述方法,测定溶液中可溶性蛋白的质量浓度,溶解度用每毫升水溶液中溶解蛋白质的微克数来表示[17]。分别取美拉德反应产物10 mL,3 000 r/min离心15 min,取1 mL上清液稀释10 倍,加入5 mL 100 μg/mL考马斯亮蓝G250溶液,旋涡振荡混匀,静置2 min。以考马斯亮蓝G250溶液调零,于波长595 nm处测定吸光度,根据标准曲线计算SPI溶解度。
1.3.3.2 乳化活性测定
分别取一定体积一定质量浓度的美拉德反应产物,加入1/3体积的大豆色拉油,10 000 r/min高速搅拌5 min后,取1 mL乳化液加入79 mL蒸馏水稀释,另取1 mL稀释液与9 mL 1 g/L的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液混合均匀,以1 g/L的SDS为空白,于波长500 nm处测定吸光度。SPI的乳化活性按下式计算[18]:

式中:T为2.303;A为波长500 nm处乳化液的吸光度;N为稀释倍数;C为乳化液形成前蛋白质水溶液中蛋白质量浓度/(g/mL);φ为乳化液中油相的体积分数/%。
1.3.3.3 ζ电势测定
取美拉德反应产物的上清液1 mL,用去离子水按1∶10稀释,涡旋振荡,利用ZEN3690 Nano ZS90纳米粒度及ζ电势仪测定ζ电势,测试温度25 ℃,平行测定3 次。
1.3.3.4 溶液pH值的测定
分别将美拉德反应产物在3 000 r/min离心15 min后,取上清液测定pH值。
1.3.3.5 热稳定性测定
取冻干后的样品粉末0.003 0 g左右,分别加入热重分析仪样品盒中,以空白作为对照,氮气为保护气,以10 ℃/min的速率从30 ℃加热到500 ℃,记录加热过程中的热曲线。
1.3.3.6 红外光谱分析
取少量冻干后的样品粉末于玛瑙研钵中,加入一定量KBr进行研磨,将研磨好的粉末压片。将压片置于红外光谱仪在4 000~400 cm-1进行扫描分析,空白KBr作为背景对照。
1.3.3.7 荧光光谱分析
取冻干后的样品粉末,根据所测得的溶解度用pH 7.0、50 mmol/L的磷酸盐缓冲液稀释至溶液中蛋白质量浓度达到1 mg/mL,激发波长为334 nm,狭缝宽度5 nm,在波长350~500 nm进行检测。
1.3.3.8 SDS-PAGE分析
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)检测美拉德反应对SPI组分的影响。
取冻干后的样品粉末0.015 g,加入超纯水,涡旋振荡使其完全溶解,10 000 r/min离心10 min。取上清液200 μL加入染色剂染色,在沸水中煮沸5 min,冷却至室温,10 000 r/min离心10 min。用进样针取10 μL依次加入到胶板的样品道中,设置电压200 V,电流50 mA。结束后将胶板取出,加入脱色液脱色至适宜颜色,凝胶成像系统拍照分析。
1.4 数据处理
每种样品每次均测定3 个平行,结果以 ±s表示,采用SPSS 17.0进行统计分析。组间差异显著性分析采用方差分析(ANOVA)中的Tukey HSD测试,P<0.05,差异显著。
2 结果与分析
2.1 美拉德反应条件的优化
2.1.1 反应温度对美拉德反应的影响

图1 反应温度对SPI-Glu-MRPs(A)和SPI-Mal-MRPs(B)吸光度的影响Fig. 1 Effect of reaction temperature on the absorbance of SPI-Glu-MRPs (A) and SPI-Mal-MRPs (B)
由图1A可知,随着温度的升高,SPI-Glu-MRPs的A290nm和A420nm都呈增加的趋势,且A290nm和A420nm均在100 ℃时达到最大值,表明Glu与SPI发生了美拉德反应。由图1B可知,随着温度的升高,SPI-Mal-MRPs的A290nm和A420nm也基本呈增大趋势,在100 ℃时A290nm达到最大,但A420nm在90 ℃时最大,100 ℃时显著降低(P<0.05),这可能是由于美拉德反应程度过高,形成了大量不溶性的高级反应产物所致[19]。综合比较,除100 ℃外,SPI-Glu-MRPs的A290nm和A420nm均高于SPI-Mal-MRPs,表明Glu比Mal更易于与SPI发生美拉德反应。这可能是由于Glu的分子质量要小于Mal,因此空间位阻更小,更易于与SPI中的反应位点接触[20-21]。考虑到当美拉德反应程度过高时会产生不溶性的聚合物,本实验选择80 ℃作为反应温度进行后续研究。
2.1.2 反应时间对美拉德反应的影响

图2 反应时间对SPI-Glu-MRPs(A)和SPI-Mal-MRPs(B)吸光度的影响Fig. 2 Effect of reaction time on the absorbance of SPI-Glu-MRPs (A)and SPI-Mal-MRPs (B)
由图2A可知,SPI-Glu-MRPs的A290nm随着反应时间的延长呈现先升高后降低的变化趋势,并在6 h时达到最大;相应SPI-Glu-MRPs的A420nm随着反应时间的延长而缓慢升高,6 h后差异不显著(P>0.05),表明美拉德反应逐渐进入到高级阶段,且在6 h时美拉德反应程度较完全。由图2B可知,反应时间对SPI和Mal美拉德反应的影响规律基本与Glu一致,即随着反应时间的延长,A290nm先升高后降低,A420nm缓慢增加。综合考虑美拉德反应发生的程度、反应产物的溶解性以及能耗问题,最终选取反应时间6 h进行后续研究。
2.1.3 混合比例对美拉德反应的影响
由图3A可知,在SPI比例保持不变的情况下,随着Glu比例的减少,SPI-Glu-MRPs的A290nm随之显著降低(P<0.05),A420nm也基本呈现出了类似的趋势。然而,混合质量比对SPI与Mal美拉德反应的影响要小很多。由图3B可知,随着反应体系中Mal含量的减少,虽然A290nm也随之降低,但是降低幅度远小于SPI-Glu-MRPs,这同样可能是由于Glu和Mal分子结构不同造成的。Glu分子更小,在溶液中的迁移速率更快,因此其比例的变化比SPI与Mal美拉德反应的影响更大。考虑到改性应当以SPI为主体,从经济的角度出发,选择SPI与Glu/Mal混合质量比4∶1继续进行研究。

图3 混合质量比对SPI-Glu-MRPs(A)和SPI-Mal-MRPs(B)吸光度的影响Fig. 3 Effect of mass ratio between SPI and sugar on the absorbance of SPI-Glu-MRPs (A) and SPI-Mal-MRPs (B)
2.2 美拉德反应产物的表征
2.2.1 溶解性测定结果

图4 与Glu和Mal的美拉德反应对SPI溶解性的影响Fig. 4 Effect of Maillard reaction with glucose and maltose on the solubility of SPI
当反应时间为2 h和6 h时,SPI-Mal-MRPs和SPI-Glu-MRPs的溶解性均随着反应时间的延长而增加,且前者的溶解性要高于后者,但是均高于在相同条件下加热的SPI-H;当反应时间进一步延长至10 h时,2 种美拉德反应产物的溶解性均显著降低(P<0.05),其中SPI-Glu-MRPs的溶解性甚至低于SPI-H,这表明当反应时间过长时形成了不溶于水的大分子聚合物,美拉德反应进入了高级阶段,且Glu更易于与SPI形成此类产物。这与图2中6 h后美拉德反应产物A290nm开始降低及A420nm开始升高的趋势一致。因此,与Glu和Mal适度的美拉德反应可以显著提高SPI的溶解性,在与羧甲基纤维素钠[22]和麦芽糊精[23]的美拉德反应产物中也观察到了相同的结果。
2.2.2 乳化活性测定结果
与多糖发生美拉德反应是提升蛋白质乳化活性的重要手段[24],干热法是最常用于提升SPI乳化活性的方法,已有文献表明干热条件下与羧甲基纤维素钠[22]、麦芽糊精[23,25]和Glu[26]的美拉德反应可以显著提升SPI的乳化活性,但是关于湿热条件下美拉德反应对SPI相关功能性质的影响还比较少见。

图5 与Glu和Mal的美拉德反应对SPI乳化性的影响Fig. 5 Effect of Maillard reaction with glucose and maltose on the emulsifying activity of SPI
由图5可知,相同条件下SPI-H的乳化活性最高,加入还原糖会降低SPI-H的乳化活性,这可能是SPI与大豆油形成的乳状液的稳定结构被加入的还原糖破坏所致[25]。湿热条件下加热6 h后,SPI-H及2 种美拉德反应产物的乳化活性均随之降低,且SPI-Glu-MRPs的乳化活性略高于SPI-Mal-MRPs,但是仍低于SPI-H,这与上述干热条件下得到的美拉德反应产物乳化活性的变化规律相反。表明湿热法和干热法对SPI功能性质具有不同的影响。这可能是由于在干热状态下,美拉德反应主要发生在SPI分子表面,而在湿热状态下,SPI、Glu和Mal均处于伸展状态,因此接触更加充分,反应更加充分,使得SPI的结构发生了改变,降低了其在油水两相界面的吸附作用,使得SPI的乳化活性降低[27];同时,美拉德反应产物溶解性增加意味着疏水性氨基酸含量降低[28-29],这进一步影响了美拉德反应产物在油水界面的吸附作用,导致SPI的乳化活性降低。
2.2.3 美拉德反应产物溶液的pH值测定结果
由图6可知,与Glu和Mal发生美拉德反应6 h使SPI溶液的pH值由8.9降低至7.2和7.6。研究表明,SPI中参与美拉德反应的氨基酸主要是赖氨酸和精氨酸[23],在湿热条件下,这2 种碱性氨基酸更容易参与美拉德反应;同时,美拉德反应会生成酸性物质,这导致了SPI溶液pH值的降低。

图6 与Glu和Mal的美拉德反应对SPI溶液pH值的影响Fig. 6 Effect of Maillard reaction with glucose and maltose on the pH of SPI solution
2.2.4 美拉德反应产物的ζ电势测定结果

图7 与Glu和Mal的美拉德反应对SPI溶液ζ电势的影响Fig. 7 Effect of Maillard reaction with glucose and maltose on the ζ potential of SPI solution
当反应时间为2 h时,SPI-Glu-MRPs和SPI-Mal-MRPs溶液的电势与SPI-H相比差异较小,但当反应时间延长至6 h时,2 种产物的ζ电势迅速降低,这可能是由于SPI中大量—NH2参与了美拉德反应,质子化程度降低,导致美拉德反应产物负电荷含量增加,由图6可知,在反应时间为6 h时美拉德反应产物溶液的pH值降低,这一溶液pH值与ζ电势的关系同张梦雪等[30]的测定结果一致;但是当反应时间进一步延长至10 h时,SPI-Glu-MRPs和SPIMal-MRPs溶液的ζ电势又开始增加,且高于SPI-H,这与Li Weiwei等[31]在SPI水解物与Glu和Mal美拉德反应产物中得到的结果一致。这些结果表明,在一定反应程度下Mal和Glu结合同样可以改变SPI表面电荷的分布且美拉德反应程度高会增强静电屏蔽作用[32];另外,在整个反应时间范围内,SPI-Glu-MRPs的ζ电势均高于SPI-Mal-MRPs。由于SPI的电荷特性对其在微囊化、溶液中的稳定性等性质有重要影响[23],因此可通过选择合适的还原糖种类或反应时间来获得具有所需电荷特性的改性SPI。
2.2.5 美拉德反应产物的热稳定性
如图8所示,变化速率明显分为3 个阶段,分别为第1阶段60~200 ℃、第2阶段200~300 ℃、第3阶段300~500 ℃。在60~200 ℃范围内,SPI-Glu-MRPs(图8A)和SPI-Mal-MRPs(图8B)的热量损失与SPI-N和SPI-H相比均较小。该温度范围内的热量损失通常是由于水分蒸发所致,水分蒸发减少表明美拉德反应可能导致了大分子质量产物的形成,使其持水能力增强[4];在200~300 ℃范围内,美拉德反应产物的质量损失率急剧增加,这表明美拉德反应产生了一些易于分解或易于挥发的物质,这些物质在该温度范围内发生了分解或挥发,从而导致质量急剧下降[24,33];在300~500 ℃范围内,美拉德反应产物进一步发生分解。这说明美拉德反应会适当降低SPI的热稳定性。
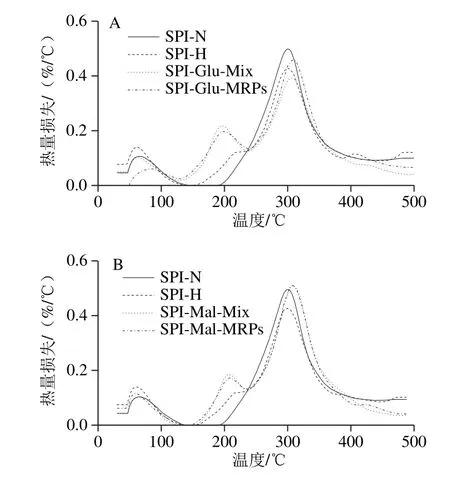
图8 SPI-Glu-MRPs(A)和SPI-Mal-MRPs(B)的热重分析图谱Fig. 8 DTG patterns of SPI-Glu-MRPs (A) and SPI-Mal-MRPs (B)
2.2.6 美拉德反应产物的傅里叶变换红外光谱分析

图9 SPI-Glu-MRPs(A)和SPI-Mal-MRPs(B)的红外光谱图Fig. 9 FTIR spectra of SPI-Glu-MRPs (A) and SPI-Mal-MRPs (B)
如图9所示,3 441 cm-1处的吸收峰为—NH2+的伸缩振动峰,在SPI-Glu-MRPs(图9A)和SPI-Mal-MRPs(图9B)均出现了该峰,表明该基团并未完全参与美拉德反应;但是在SPI-Glu-MRPs中与SPI-H相比峰变宽,表明发生的美拉德反应对该基团产生了一定的影响;1 650 cm-1对应乙酰胺基CH3—O=C—NH—中的—CO—的伸缩振动,与SPI-H相比,2 种反应产物的峰也变宽,表明SPI与2 种糖发生了美拉德反应。
2.2.7 美拉德反应产物的荧光强度分析

图10 SPI-Glu-MRPs(A)和SPI-Mal-MRPs(B)的荧光光谱图Fig. 10 Fluorescence spectra of SPI-Glu-MRPs (A) and SPI-Mal-MRPs (B)
荧光强度可以作为美拉德反应程度的一个指标,当美拉德反应进入到高级阶段时即会形成荧光物质[34]。由图10可知,2 种美拉德反应产物在400~425 nm波长处均具有特征吸收,且吸收均强于相应的单体及简单混合物,这与在酪蛋白和乳清蛋白同Mal或乳糖形成的美拉德反应产物中观察到的结果一致[35],表明SPI与还原糖发生了美拉德反应;通过比较还可以看出,SPI-Glu-MRPs的荧光强度比SPI-Mal-MRPs强,表明Glu更易于与SPI发生美拉德反应,这与图1中观察到的结果一致。
2.2.8 美拉德反应产物的SDS-PAGE分析

图11 SPI-Glu-MRPs和SPI-Mal-MRPs的SDS-PAGE图谱Fig. 11 SDS-PAGE patterns of SPI-Glu-MRPs and SPI-Mal-MRPs
由图11可以看出,SPI-H比SPI-N条带数少,具体表现为11S组分中对应于蛋白分子质量43 kDa的条带、7S组分中对应于22 kDa的条带消失,推断可能是加热使得SPI变性和聚集所致;与SPI-Mal-Mix(条带2)和SPI-Glu-Mix(条带4)相比,SPI与Mal(条带1)和Glu(条带3)发生美拉德反应后在高分子质量处出现了明显的条带,11S组分有2 个条带颜色变浅,同时与SPI-H相比66.2 kDa的条带消失,这证实了SPI与Mal和Glu发生了美拉德反应并形成了高分子聚合物。
3 结 论
分别对Glu、Mal与SPI的美拉德反应条件进行优化,研究发现,反应温度越高,时间越长,美拉德反应程度越高。综合考虑能源消耗问题,确定美拉德反应表征的研究条件为SPI与Glu/Mal混合质量比4∶1、反应温度80 ℃、反应时间6 h。
美拉德反应明显改善了SPI的溶解度,并且Mal比Glu对SPI的改性效果更佳;美拉德反应降低了SPI的乳化性,这与干热条件下的大部分报导结论相反,表明干热和湿热条件下SPI与糖的美拉德反应进程可能有所不同;美拉德反应对SPI的ζ电势有一定影响,随着美拉德反应程度的增加,SPI的负电荷明显减少;美拉德反应会使SPI溶液的pH值降低;热稳定性分析表明美拉德反应降低了SPI的热稳定性;傅里叶变换红外光谱分析表明美拉德反应在SPI中引入了新的化学键;荧光分析表明美拉德反应增强了SPI的荧光强度;SDS-PAGE表明美拉德反应导致了大分子的形成。
综上所述,SPI与还原糖在湿热条件下的美拉德反应对SPI的溶解性有一定的改善作用,并可通过反应程度来调节产物的ζ电势。SPI作为食品工业中最为重要的植物性蛋白源,其改性产物在实际应用中具有广泛的应用前景。

