心肌原位缓释胎盘生长因子纳米粒注射用于大鼠心肌梗死的效果评价
包华健,何 静
0 引言
心肌梗死(Myocardial infarction,MI)使疤痕形成,影响心脏的收缩功能,最终导致心力衰竭[1],其治疗方式包括药物治疗、心脏移植和植入式左心室辅助装置(LVADs)。然而器官供体供应有限,LVAD并发症发病率高[2]。理想的治疗方法是能够通过血管再生来促进新的心肌细胞生成并刺激缺血区的血管生成来保持心脏功能[1,3]。
胎盘生长因子(PLGF)可刺激新生血管形成,改善心脏功能。PLGF属于血管内皮生长因子(Vascular endothelial growth factor,VEGF)家族成员,与VEGF比较,PLGF不仅具有更强的促进血管新生作用,且很少有低血压、水肿、纤维素沉积以及刺激新生血管瘤等不良作用[4]。
尽管心肌梗死的药物治疗取得了进展,但递送生长因子仍然是一个具有挑战性的过程,因为大多数生物因子不留在指定的部位(即梗死组织)。原因可能包括递送方式、局部酶退化、动物样本的差异和收缩心肌“洗脱”机制[5-7],可通过纳米粒子来实现药物递送。以往的PLGF递药途径存在易分解代谢、分布不均等问题。壳聚糖和海藻酸钠具有较好的生物相容性和极小毒性,可用于制备微胶囊,在临床胰岛细胞移植研究中可选择壳聚糖/海藻酸钠作为胰岛细胞载体[8]。同时,海藻酸钠是第一种进入临床试验治疗心梗的材料,其缺点是亲水性过强,不易与细胞结合,壳聚糖结合可以改善海藻酸钠与细胞间的相互作用[9]。我们选择壳聚糖/海藻酸钠作为纳米递送材料,其主要优势在于:纳米粒性质稳定;一次给药后,药物可缓慢释放较长时间;良好的生物相容性;降解产物无毒性[6]。本研究中,我们首次在心肌内注射载PLGF壳聚糖-藻酸盐纳米粒,推测其可提供持续缓释保护效果,加速缺血性心肌病大鼠模型中的心肌恢复。
1 材料和方法
1.1 材料
1.1.1 实验动物 雌性Lewis大鼠(体重200~250 g;由上海斯莱克实验动物中心提供)。平衡饲养1周后,将大鼠分组。
1.1.2 主要试剂 来自棕藻的低黏度海藻酸钠盐(黏度:250 cP,2%水溶液),购自Sigma Chemicals(St Louis,MO)。壳聚糖(低黏度,73.5%脱乙酰),购自Wako BioProducts(Richmond,VA)。重组PLGF购自R&D Systems公司(Minneapolis,MN)。
1.1.3 仪器 微尖探头超声波超声仪(Branson 2510;克利夫兰,俄亥俄州);超速离心机(Optima MAX;美国Beckman公司);G1316A温控箱;CM-200 FEG透射电子显微镜(Philips,Markham,加拿大);Zeta电位分析仪电泳激光多普勒测速仪(Brookhaven Instruments Corp,Holtsville,NY);ZetaPlus粒度测定仪(v4.11;BrookhavenInstruments Corporation);7/0聚丙烯缝合线(Ethicon Inc,Somerville,NJ);胸超声心动图(飞利浦IE33,12 MHz探头)。
1.2 方法
1.2.1 壳聚糖-海藻酸钠纳米粒的制备 参考Rajaonarivony等[10]的方法。将氯化钙溶液(2 ml,0.67 mg/ml)滴加至浓度为1.0 mg/ml PLGF的10 ml海藻酸钠溶液(0.6 mg/ml),同时用微尖探头超声仪处理1 min(50 W)。将所得的藻酸钙预凝胶移至烧杯中,搅拌30 min,然后加入3% v/v乙酸的壳聚糖溶液(2 ml,0.3 mg/ml)搅拌30 min。将所得悬浮液放置24 h,4 ℃ 140 000 g超速离心60 min分离纳米粒;通过超声处理将所得沉淀物重新分散于蒸馏水中1 min,通过超速离心将纳米粒在水中洗涤2次。空白纳米粒采用相同的制备方法,制备过程中不加PLGF。
1.2.2 载PLGF壳聚糖-藻酸盐纳米粒的体外释放 载PLGF纳米粒悬浮于20 ml磷酸盐缓冲盐水(pH=7.4)中,置于37 ℃的恒温环境中水平摇动(100 r/min)。于适当时间间隔,分别取出1 ml培养基,并以等量磷酸盐缓冲盐水补充至释放介质。通过PLGF酶联免疫吸附测定法(ELISA)测定不同时间释放的PLGF浓度。
1.2.3 纳米粒子的形态及粒径 Zeta Plus粒度测定仪和透射电镜分别确定纳米粒子尺寸分布和形态,Zeta电位分析仪测量Zeta电位。测量3次,取平均值。
1.2.4 动物模型建立与分组 大鼠随机分为4组,除假手术组外,每组10只:对照组Ⅰ(空白壳聚糖-藻酸盐纳米粒),治疗组Ⅱ(1 μg重组PLGF与生理盐水稀释成300 μl),治疗组Ⅲ(1 μg重组PLGF壳聚糖-海藻酸盐纳米粒用生理盐水稀释成300 μl),组Ⅳ为假手术组(n=5)。大鼠心肌梗死模型建立步骤如下[5]:插管和机械通气80次/min,5%异氟烷麻醉。无菌操作下于左胸前区第四肋间行胸廓切开术,暴露心脏,撕开心包膜,于左心耳下缘2 mm处用7-0缝合线结扎左冠状动脉前降支。进针深度约2 mm(假手术组只穿线,不结扎)。导致游离左心室(LV)心肌梗死,随后心力衰竭。结扎动脉15 min后,27-G针管行3次心肌梗死内注射,将物质注射至梗塞周围区域。定期监测动物的体重和死亡率。PLGF壳聚糖-藻酸盐纳米粒经心肌内递送至梗塞大鼠心脏的示意图见图1。

图1PLGF壳聚糖-藻酸盐纳米粒经心尖原位注射递送至梗塞大鼠心脏的示意图
1.2.5 超声心动图 冠状动脉结扎术前及术后2 d、1周、4周及8周,异氟烷麻醉下进行超声心动图检查(2.5%氧气,500~700 ml/min),以胸骨旁短轴切面,M超测量左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)。LVEDD、LVESD以连续3个心动周期测量值的平均值作为监测数据。左心室缩短分数(LVFS)=(LVEDD-LVESD)/LVEDD×100。根据Teichholz公式[11]计算左室射血分数(LVEF)、左室舒张末期容积(LVEDV)和左心室收缩末期容积(LVESV)。
1.2.6 疤痕面积分析 术后8周,处死大鼠后迅速开胸切取心脏,生理盐水清洗并去除心腔内残余血液,于4%福尔马林中性缓冲液中固定。保存24 h后经石蜡包埋,取5 μm厚的切片行病理组织学检查,Masson染色定量测定疤痕组织(蓝色)。应用图像处理软件Image J测量梗死面积并取平均值[12],梗死面积=(瘢痕内弧长+瘢痕外弧长)/(外周长+内周长)×100%。
1.2.7 免疫组化检测梗死边缘区评估血管生成 采用免疫组化技术检测大鼠心肌梗死边缘区血小板-内皮细胞黏附分子(CD31)阳性的内皮细胞数量,评估新生毛细血管情况,检测抗α平滑肌肌动蛋白(α-SMA)阳性平滑肌细胞数量,评估新生小动脉情况。为测量毛细血管密度,5处梗死面积成像,对直径<10 μm的毛细血管平均数计数。将毛细血管密度定量为(总CD31阳性微血管平均数)/mm2,使用3个组织切片跨越每个动物的梗死周围组织区域。小动脉密度定量为(总平滑肌肉α-SMA阳性微血管平均数)/mm2。
1.2.8 可溶性细胞因子的血清浓度 8周后,通过直接心脏穿刺从每只大鼠的左心房收集心脏、血液样本,14 000 r/min离心10 min,之后将样品于-20 ℃条件下储存。按照大鼠钠尿肽ELISA检测试剂盒(CBS-E07972R,CUSABIO,中国)说明书提供的实验步骤进行检测[13]。

2 结果
2.1 样本量和死亡率 35只雌性Lewis大鼠,8只大鼠死亡,死亡率为23%,其中27只大鼠存活至2个月的实验终点,8只大鼠死亡发生在第1次冠状动脉结扎后48 h。不同群体死亡率差异不明显,48 h后大鼠无死亡情况。
2.2 纳米粒子的表征 透射电镜分析证实,PLGF壳聚糖-藻酸盐纳米粒的直径约100~200 nm(图2),球形,“毛绒”表面。粒子正极Zeta电位(7.2±0.5)mV,包封效率38.4%±3.4%。
2.3 体外释放动力学 体外释放研究中,在前24 h内,药物释放有限,但在48 h,由于纳米粒随着时间的推移逐渐降解,生长因子快速释放,120 h后无药物释放(图3)。

图2 PLGF壳聚糖-藻酸盐纳米粒的表征

图3 PlGF随时间变化的体外释放动力学
2.4 超声心动图测量
2.4.1 LVF测量 心肌梗死前,心肌梗死后注射空纳米粒、PLGF及PLGF纳米粒后2个月的大鼠心脏如图4所示。术前和心肌梗死后2 d组间LVFS比较差异无统计学意义(P>0.05);双向ANOVA分析显示,心肌梗死后1周,组间LVFS平均值差异有统计学意义,组Ⅱ与组Ⅲ比较差异无统计学意义(95%CI-4.3~3.9,P>0.05),组Ⅱ和组Ⅲ高于组Ⅰ;在心肌梗死后4周,组间LVFS平均值差异有统计学意义,组Ⅱ低于组Ⅲ(95%CI-0.3~7.9,P<0.05),组Ⅱ和组Ⅲ高于组Ⅰ;在梗死后8周,组间LVFS平均值差异有统计学意义,组Ⅱ低于组Ⅲ(95%CI-0.2~8,P<0.05),组Ⅱ和组Ⅲ高于组Ⅰ。
2.4.2 LVEF测量 术前和心肌梗死后2 d,LVEF比较差异无统计学意义(P>0.05)。双向ANOVA分析显示,心肌梗死后1周,组间LVEF平均值差异有统计学意义,组Ⅱ与组Ⅲ比较差异无统计学意义(95%CI-6.9~5.5,P>0.05),但是组Ⅱ和组Ⅲ高于组Ⅰ;心肌梗死后4周,组间LVEF平均值比较差异有统计学意义,组Ⅱ低于组Ⅲ(95%CI-4.3~16.7,P<0.01),组Ⅱ和组Ⅲ高于组Ⅰ;在心肌梗死后8周,组间LVEF平均值差异有统计学意义,组Ⅱ低于组Ⅲ(95%CI3.3~15.7,P<0.01),组Ⅱ和组Ⅲ高于组Ⅰ。见图4。
2.5 疤痕面积测量 单向ANOVA分析显示,心肌梗死8周后组间疤痕面积百分比差异有统计学意义,即组Ⅰ与组Ⅱ比较,95%CI0.61~8,P<0.01;组Ⅱ与组Ⅲ比较,95%CI0.2~7.6,P<0.01;组Ⅰ与组Ⅲ比较,95%CI4.5~11.9,P<0.01。见图5。
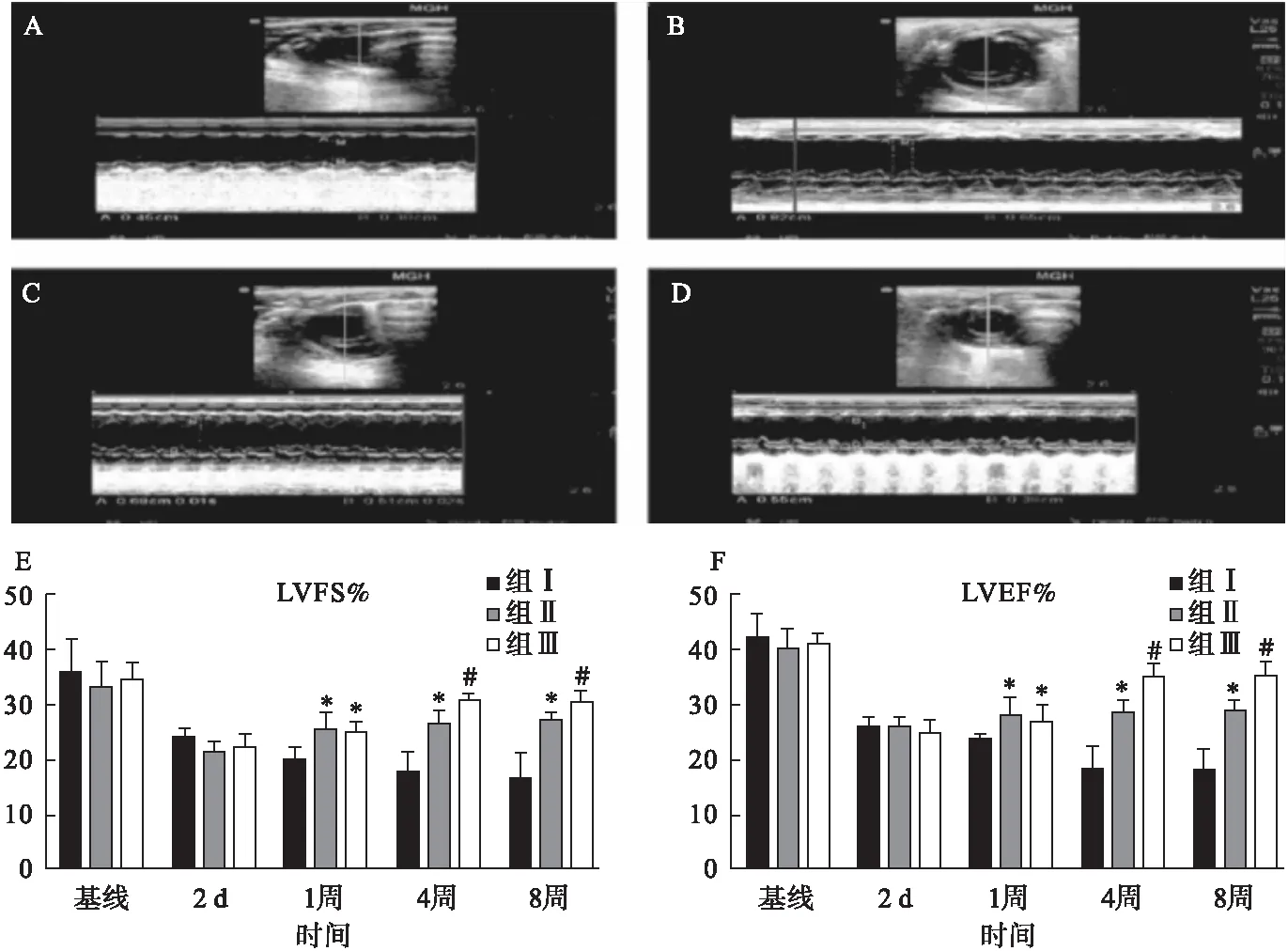
图4 超声心动图分析心脏功能

图5 各组急性心脏梗死程度比较
2.6 血管生成测量 单向ANOVA分析显示,梗死后8周,组间毛细血管密度平均值差异有统计学意义,组Ⅰ与组Ⅱ比较,95%CI-66.2~-28.8,P<0.01;组Ⅱ与组Ⅲ比较,95%CI-66.6~-29.2,P<0.01;组Ⅰ与组Ⅲ比较,95%CI-114.1~-76.7,P<0.01(图6A~图6C)。每组平均毛细血管密度如图6G所示。
在心肌梗死后8周,组间平均小动脉密度差异有统计学意义,组Ⅰ与组Ⅱ比较,95%CI-8.6~-2.3,P<0.01;组Ⅱ与组Ⅲ比较,95%CI-6.76~-0.3,P<0.01;组Ⅰ与组Ⅲ比较,95%CI-12.12~-5.8,P<0.01。见图6D~图6F。每组平均小动脉密度如图6H所示。
2.7 血清细胞因子测量 单向ANOVA分析显示,在心肌梗死8周后,组间平均细胞因子水平差异有统计学意义,见图7。组间血清TNF-α水平比较:组Ⅰ与组Ⅱ比较,95%CI1.2~7.8,P<0.01;组Ⅱ与组Ⅲ比较,95%CI0.7~7.3,P<0.022;组Ⅰ与组Ⅲ比较,95%CI5.2~11.8,P<0.01)。组间血清IL-6水平比较:组Ⅰ与组Ⅱ比较,95%CI10.3~59.3,P<0.01;组Ⅱ与组Ⅲ比较,95%CI5.8~54.8,P<0.01;组Ⅰ与组Ⅲ比较,95%CI40.6~89.6,P<0.01。组间IL-10比较:组Ⅰ与组Ⅱ比较,95%CI-1.4~-0.04,P<0.01;组Ⅱ与组Ⅲ比较,95%CI-1.5~-0.1,P<0.01;组Ⅰ与组Ⅲ比较,95%CI-2.2~-0.8,P<0.01。
3 讨论
心力衰竭最常出现的是缺血性心脏病[14],血管生成是一种治疗缺血性心脏病的新方法,PLGF已在临床应用了近20年。Kolakowski等[15]证明,PLGF直接心肌注射,对心肌梗死后的心脏有积极影响。本研究中,在比较组Ⅰ和组Ⅱ的LVEF、瘢痕面积和血管生成分析时得到类似的结果,本研究通过使用与先前研究相同的PLGF剂量来优化蛋白质递送。
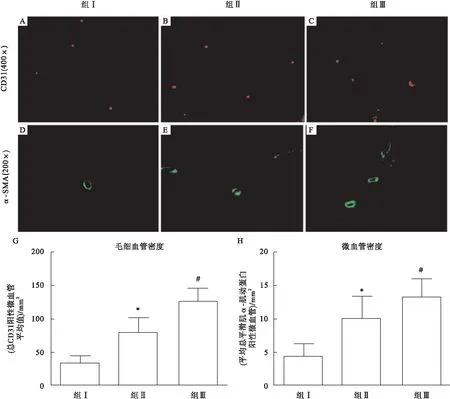
图6 梗死周围区域的血管生成和动脉生成比较

图7 梗死后8周各组的血清细胞因子水平比较
PLGF纳米粒的体外释放时间数据和在4周时改善的心脏功能情况差异较大,可能的原因是心肌的恢复时间。急性心肌梗死后,心肌进入冬眠状态或所谓的“心肌震颤”。这种异常可以持续几个星期或几个月,并有可能通过血运重建[16]。本研究中,血运重建通过PLGF注射完成。PLGF纳米粒的体外释放在第5天达到高峰,而在单独注射PLGF的组Ⅱ中,PLGF没有得到保护,大部分丢失,组Ⅲ中PLGF受到纳米粒保护持续释放5 d。与组Ⅱ比较,组Ⅲ血管生成更多。心肌需要一段时间才能恢复,因此,大部分心肌处于冬眠状态。结果表明,与注射空纳米粒子或单独PLGF比较,PLGF纳米粒子递送增加心脏功能。此外,心肌梗死后,壳聚糖-藻酸盐纳米粒为PLGF提供了持续一段时间的缓释保护机制。可以假设这些纳米粒使PLGF免受局部酶促降解,从而延长了生长因子的作用。
LVEF、瘢痕面积和小动脉密度的显著改变伴随着血清细胞因子水平的明显改变。以前的研究集中在MI后细胞因子的组织表达,而少数细胞因子研究实际上集中在血清水平的变化[17-18]。因此,我们的研究重点主要是TNF-α、IL-6和IL-10的血清水平。TNF-α和IL-6通过引起重构而对梗死心肌产生负面影响,而IL-10可以抵消这种影响。与其他组相比,组Ⅲ TNF-α和IL-6促炎细胞因子的血清水平明显较低。此外,组Ⅲ IL-10抗炎心脏保护性细胞因子的血清水平明显较高。与其他组比较,组Ⅲ左室重构更少,依据LVESD从基线变化最小,还有瘢痕形成的减少。MI后持续8周高水平的促炎细胞因子并不罕见,因为重塑过程可能会在MI后持续数周或者数月[18]。此外,研究表明,大鼠血浆TNF-α在MI后2周显著升高,在8周逐渐达到峰值[19]。同样,间充质干细胞通过减少炎症/抗炎细胞因子的比例治疗心肌重塑[20]。
与急性MI后直接应用生长因子比较,纳米粒作为PLGF递送载体的使用导致LV功能、血管密度和抗炎细胞因子IL-10显著增加,瘢痕面积形成和促炎性细胞因子TNF-α和IL-6显著减少。因此,可以使用纳米粒来提供持续的缓释保护性PLGF治疗,增强生长因子在急性心肌缺血情况下的积极作用。此外,这种纳米技术可以用作许多抗心力衰竭药物的药物递送系统。这样可以将大部分药物保留在指定区域,并使全身毒性最小化,但仍需要进一步优化的方法进行实验和研究,促进新的治疗方式产生。

