Cdc42小干扰RNA对肺癌A549细胞增殖及EGFR蛋白表达的影响
张庆龙
(锦州医科大学附属第一医院心内科,辽宁 锦州 121000)
肺癌是癌症相关死亡的主要原因之一,其中非小细胞肺癌5年生存率仅为15%(NSCLC)[1]。尽管目前化疗和放疗取得了巨大进步,但肺癌生存率并没有取得显著改善[2]。细胞分裂周期蛋白42(Cdc42蛋白)是Rho家族中的鸟嘌呤三核苷酸活化酶[3],在参与调节细胞骨架变化,囊泡运输以及其他的细胞生长和稳定性调节机制中发挥着重要作用[4]。相关研究提示,Cdc42在一系列癌细胞中存在高表达[5-6]。表皮生长因子受体(EGFR)是一种跨膜蛋白与其表达肺癌细胞生长速度呈正相关,在临床上与可作为肺癌患者预后指标之一[7]。有报道证实肺癌预后较差的患者中多见EGFR的高表达[8]。本研究针对Cdc42基因合成siRNA,观察其对肺癌A549细胞增殖能力以及EGFR蛋白表达水平的影响,进一步探讨Cdc42在肺癌的作用提供有力实验依据。
1 材料和方法
1.1 细胞株与试剂 肺癌细胞株A549购自中国科学院上海细胞所。胎牛血清(FBS)购自美国GIBCO公司,DMEM高糖培养基购自Hyclone公司。qRT-PCR 反应试剂盒、逆转录试剂盒均购自日本TaKaRa。Trizol购自美国Invitrogen公司。鼠抗人GAPDH、EGFR及Cdc42单克隆抗体均购自Santa Cruz公司。siRNA Transfection Reagent购自普飞生物公司。迁移小室购自美国millipore公司;Cdc42引物由生工生物技术公司完成,Cdc42上游引物:5,- ATGTCTTCGGAGATACGTCCTT-3,,下游引物5,- GACTCTGCGAACCTGTTGGA-3,。特异性干扰Cdc42基因的siRNA 序列购自广州瑞博生物技术有限公司。
1.2 方法
1.2.1 细胞培养及转染 用含10%胎牛血清的DMEM培养基培养A549细胞,置于37 ℃、5% CO2的无菌培养箱中培养。当细胞密度至满视野70%时,用胰酶进行消化用于传代培养。将处于对数生长时期的A549细胞用胰酶消化后以2×105每孔的密度接种于6孔板中,24 h当细胞生长融合至80%时进行转染。将特异性干扰Cdc42-siRNA和无意义小干扰RNA分别转染至A549细胞中。将细胞分为特异性干扰Cdc42-siRNA实验组,无意义小干扰RNA阴性对照组和空白对照组。
1.2.2 qPCR法检测A549细胞中Cdc42 的mRNA表达 转染24 h至48 h后,分别用 TRIzol 法提取实验组、阴性对照组、空白对照组各组细胞的总RNA,NanoDrop2000c测定其浓度和纯度,逆转录合成cDNA,并以此为模板进行qPCR扩增反应。实验反应体系为20 μL,设置3个复孔,以GAPDH为内参,重复3次检测Cdc42基因的mRNA表达水平。
1.2.3 Western-blot法检测Cdc42及EGFR蛋白的表达 转染48~72 h以后提取细胞总蛋白,采用BCA方法测定蛋白浓度。上样量为200 μg,电转到PVDF膜上、5%BSA封闭漂洗后,加入Cdc42抗体、EGFR抗体及抗内参照GAPDH抗体4 ℃过夜。次日用PBS在室温洗膜3次后室温孵育相应的二抗90 min,PBS洗膜3次后使用化学发光成像仪进行显影曝光。
1.2.4 CCK8方法检测A549细胞增殖能力 将A549细胞接种于6孔板中,转染特异性干扰Cdc42-siRNA和无意义siRNA 48 h细胞生长融合至80%,胰蛋白消化后以1×104/孔的密度接种于96孔板中,按照CCK8试剂盒要求检测各孔的吸光度。
1.2.5 统计学处理 用SPSS17.0及GraphPad软件对实验数据进行统计学分析,计量资料以均数±标准差(mean ±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA)及q检验。两组组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 特异性干扰Cdc42-siRNA抑制A549细胞中Cdc42 mRNA的表达 qPCR检测结果表明,Cdc42-siRNA组中Cdc42 mRNA的表达较对照组明显降低,实验组Cdc42 mRNA表达量显著下降72%,差异有统计学意义(P<0.01),结果见表1、图1。结果提示Cdc42-siRNA转染能有效地在转录水平上下调Cdc42 mRNA的表达。与阴性对照组相比:P=0.001t=8.142。

表1 各组A549细胞Cdc42 mRNA表达水平
2.2 Cdc42-siRNA抑制A549细胞中Cdc42 蛋白的表达 Western-blot结果显示Cdc42-siRNA组Cdc42 蛋白的表达水平与对照组相比明显降低,取Cdc42/GAPDH的灰度值比值Cdc42-siRNA组Cdc42 蛋白的表达水平下降了54%,具有显著差异(P<0.01),结果见表2、图2。结果表明Cdc42-siRNA能有效下调Cdc42的蛋白表达。

表2 各组A549细胞Cdc42蛋白表达水平
2.3 Cdc42表达下调可抑制A549细胞增殖能力 CCK-8实验结果表明,细胞生长速率在Cdc42基因低表达时显著减慢,在转染第4天具有统计学差异(P<0.05),转染第5天有显著差异(P<0.01)。说明Cdc42表达下调对A549细胞增殖能力起到抑制作用,结果见表3、图3。
2.4 Cdc42表达下调抑制A549细胞中EGFR蛋白的表达 Western-blot检测结果显示,Cdc42-siRNA转染后,Cdc42-siRNA组较对照组EGFR 蛋白的表达明显降低,灰度分析Cdc42-siRNA组EGFR 蛋白表达量显著下降78%,有显著差异(P<0.01),结果见表4、图4。以上结果说明Cdc42-siRNA能抑制A549细胞中EGFR蛋白的表达。

表3 各组A549细胞增殖数目的变化

表4 各组A549细胞EGFR蛋白表达水平
3 讨 论
肺癌是严重威胁人类健康的恶性肿瘤之一,发病率有逐年增长的态势。肺癌细胞通过恶性增殖迁移,脱离正常体内细胞生长调控,逐渐侵袭正常细胞。因此在肺癌的形成过程中,肿瘤细胞的恶性增殖迁移发挥着至关重要的作用[9]。
Cdc42在正常细胞中的基本生命过程中发挥着举足轻重的作用。同时Cdc42作为癌基因,Cdc42过度活化也会导致癌症的发生机率增加在细胞凋亡、细胞迁移以及肿瘤细胞的转移等调控过程中发挥作用[10-11]。EGFR在一系列癌细胞中均有表达,通过激活增殖相关的信号通路从而加速肿瘤细胞的恶性增殖。研究显示,在肺癌术后患者中,EGFR的表达水平与生存率呈现负相关[12]。因此我们推断通过药物降低EGFR表达水平可以在临床上增强抗肿瘤的疗效。
在目前临床上,随着EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的研发,肺癌分子靶向治疗让很多患者受益,但是单有效靶点突变率较低或未突变肺癌患者不能获益,因此寻找新的分子靶点有着非常重要的意义。mRNA对特定靶基因的抑制能够通过siRNA与其沉默相互补实现。目前小干扰RNA已成为肿瘤分子靶相治疗的研究热点[13]。相关研究中发现,Cdc42的表达在多种肿瘤细胞中均出现增强。通过靶向干扰Cdc42,能够抑制肿瘤细胞的增殖[14]。但是针对Cdc42的特异性siRNA在肺癌A549细胞中的增殖观察尚未见报道。本文的实验结果揭示A549肺癌细胞经过转染Cdc42-siRNA后,其增殖速度明显减弱,同时EGFR表达水平显著下降。由此我们推断A549细胞转染Cdc42-siRNA后可能通过EGFR表达水平下降抑制Ras信号通路,从而抑制肺癌细胞的恶性增殖。肺癌的形成是一个多基因参与的复杂过程,本文研究结果提示Cdc42在A549肺癌细胞增殖过程中发挥重要作用。
(此文图1-4见附页3-4)
文见第9-11页

1:空白对照组;2:阴性对照组;3:实验组
图1 RT-PCR检测Cdc42 mRNA表达水平(**P<0.01)

A:Western blot结果 B:统计分析定量图;1:阴性对照组;2:实验组
图2 Western blot检测Cdc42蛋白表达水平(**P<0.01)

图3 Cdc42-siRNA抑制A549细胞增殖(*P<0.05,**P<0.01)
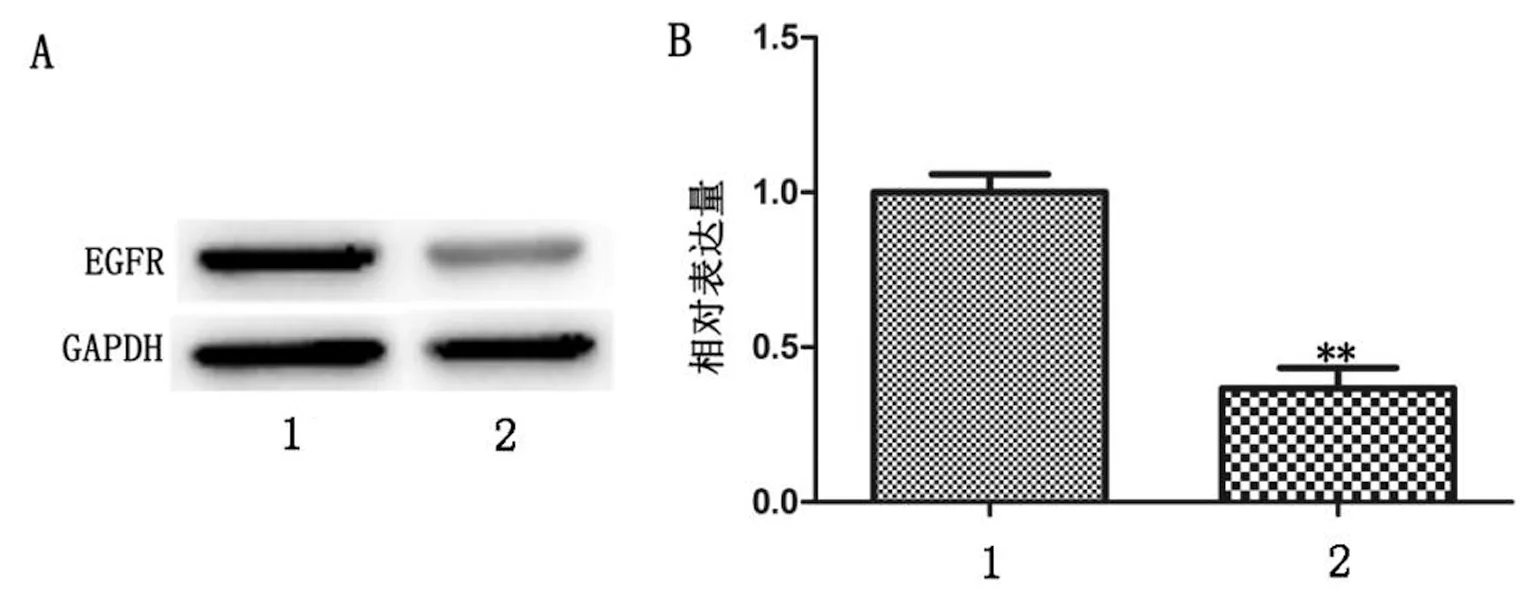
A:Western blot结果;B:统计分析定量图;1:阴性对照组;2:实验组
图4 Western blot检测EGFR蛋白表达水平(**P<0.01)

