BMP7蛋白对大鼠急性脊髓损伤后神经元修复作用的研究*
张玉玲 白广超 金宏亮 张文 李宽新*
脊髓损伤是一种高致残率的中枢神经系统疾病,其常由车祸伤、高处坠落伤等引起[1]。原发性机械损伤及继发性神经功能障碍可导致局部神经元死亡、炎性因子浸润、轴突脱髓鞘等一系列变化,使得脊髓损伤的治疗成为脊柱外科领域的难点[2]。由于神经元的不可再生性,脊髓损伤后神经元的修复及补充就成了脊髓损伤治疗的关键[3]。目前研究表明,属于转化生长因子-(TGF-)超家族的骨形态发生蛋白 7(bone morphogenetic protein 7, BMP7)具有神经保护功能[4],本研究使用BMP7蛋白治疗大鼠脊髓损伤模型,检测神经修复标志蛋白表达情况,探索BMP7蛋白脊髓损伤后神经细胞的修复作用。
1 材料与方法
1.1 实验动物
清洁级 Wistar大鼠70只,雄性,4周龄,体质量约110 g,由石河子大学医学院实验动物中心提供。所有实验操作均符合实验动物伦理学要求。
1.2 主要试剂
BMP7蛋白(美国R&D公司)、10%水合氯醛(上海联硕生物科技有限公司)、0.9%氯化钠注射液(新疆华世丹药业有限公司)、苏木素染液、伊红染液及中性树胶(上海榕柏生物技术有限公司)、大鼠神经丝蛋白200(neurofilament protein 200,NF200)单克隆抗体、大鼠胶质纤微酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体及大鼠突触素(Synaptophysin,SYP)单克隆抗体(abnova公司,美国)、羊抗大鼠 IgG-HRP(上海君瑞生物技术有限公司)、DAB显色试剂盒(武汉博士德生物工程有限公司)。
1.3 主要仪器
Allences's打击器(石河子大学医学院第一附属医院骨科中心提供)、0.1mm 聚乙烯导管(自制)、动物手术器械(深圳瑞沃德公司)、石蜡包埋机 SPCC-6D及切片机SPCC-335(东莞市谱标实验器材科技有限公司)、烘箱OGS60(美国ThermoFisher)、光学显微镜E100(日本Nikon)、生物安全柜(苏州安泰公司)、纯水器(成都超纯公司)。
1.4 大鼠急性脊髓损伤模型的建立
以简单随机抽样法把Wistar大鼠分为阴性对照组(NC组)及BMP7实验组(BMP7组),每组30只,10只备用。术前常规备皮、消毒,以每100 g体质量腹腔内注射30 mg 10%水合氯醛进行麻醉,背正中切口暴露出第10胸椎椎板,剪除椎板暴露硬脊膜,以Allences's打击器按照15g×20cm的能量大小打击大鼠第10胸椎段脊髓,把0.1mm聚乙烯导管一端植入损伤处蛛网膜下,另一端肝素帽封闭,逐层缝合硬脊膜、肌肉及皮肤。
大鼠急性脊髓损伤模型建立成功标准:局部可见损伤处脊髓组织出血、水肿,但硬脊膜保持完整,行为学可见大鼠出现痉挛性摆动,躯体回缩扑动,双后肢迟缓性瘫痪[5]。
术后处理:所有大鼠分笼饲养,自由进食、饮水,每天更换垫料,术后3d每天给予1次青霉素肌注(4万U/次),每天给予2次膀胱按压辅助排尿直至自主排尿功能恢复。BMP7组每天通过0.1 mm聚乙烯导管向脊髓损伤部位给予50ngBMP7蛋白(体积为100 L),NC组每天给予100 L的0.9%氯化钠注射液,术后30min第1次给药,随后每天给药1次,连续7天。
1.5 HE染色观察各组大鼠脊髓损伤节段组织形态学变化
NC组及BMP7组术后6 h、3 d、1、2、4及8周分别取5只大鼠,以每100 g体重腹腔内注射30 mg 10%水合氯醛进行麻醉,打开胸腔暴露心脏,左心室内灌注冰的0.9%氯化钠注射液(含肝素钠,15 U/mL)直至大鼠身体僵硬,随后以4%多聚甲醛灌注固定。背部原切口进入取出以损伤处为中心长约1 cm脊髓组织,置于4%多聚甲醛内固定24 h,石蜡包埋后以切片机制作厚度为6 m的组织切片,每只大鼠制作6张切片,3张用于HE染色,3张用于免疫组化实验。切片置于60℃烘箱内30 min以使蜡融化,随后置于二甲苯中脱蜡,乙醇梯度脱水,苏木素染液染5min,1%盐酸乙醇分化10 s,伊红染色3 min,乙醇梯度脱水,二甲苯透明,中性树胶封片,置于光学显微镜下观察。
1.6 免疫组化检测各组大鼠脊髓损伤节段NF200、GFAP及SYP的表达量
每只大鼠取上述制备的3张切片,切片置于60℃烘箱内30 min以使蜡融化,随后置于二甲苯中脱蜡,乙醇梯度脱水,含0.3%H2O2的甲醛室温浸泡10min以消除内源性过氧化物酶活性,切片置于0.01 mol/L枸橼酸溶液中煮沸10 min以修复抗原,切片冷却后置于山羊血清封闭液中20min,孵一抗(NF200、GFAP及SYP大鼠单克隆抗体稀释倍数均为1∶200),4℃过夜。切片置于37℃烘箱中复温45 min,PBS冲洗后室温孵二抗2 h(羊抗鼠 IgG,每张切片滴50 L),随后按照DAB显色试剂盒说明书进行显色,苏木素复染2min,1%盐酸乙醇分化10s,乙醇梯度脱水,二甲苯透明,随后进行封片,置于光学显微镜下观察,每张切片随机选取10个视野进行阳性细胞计数,取其平均值。
1.7 统计学方法
应用SPSS19.0统计软件对数据进行统计学分析,符合正态分布的计量数据用表示,组间比较采用独立样本 检 验,p<0.05为差异有统计学意义。
2 结果
2.1 大鼠脊髓损伤处HE染色结果
术后第3d可见两组大鼠脊髓损伤处神经元数量减少,神经元细胞核固缩,神经突触数量减少,尼式体淡染且数量减少,组织中出现许多空泡。1、2、4及8周时,BMP7组大鼠脊髓损伤处尼式体染色加深,空泡数量逐渐减少,神经突触数量增多,变化较NC组明显(见图1,彩图见插页)。
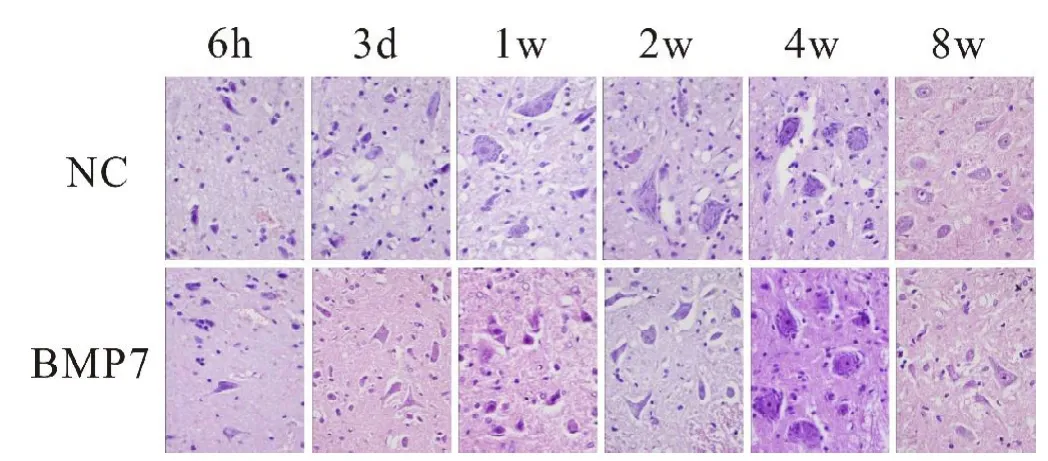
图1,不同时间点两组大鼠脊髓损伤处HE染色结果(×400)。
2.2 免疫组化检测各组大鼠不同时间点脊髓损伤处NF200、GFAP及SYP蛋白表达结果
NC组及BMP7组大鼠脊髓损伤节段均可见NF200、GFAP及SYP阳性表达的细胞,见图2(彩图见插页)。BMP7组大鼠NF200阳性表达细胞数术后3 d逐渐增多,至第4周时达到高峰,且在1、2、4及8周时均大于NC组,差异具有统计学意义;BMP7组及NC组术后GFAP阳性表达细胞数变化均不明显,且两组阳性细胞数差异不显著;BMP7组大鼠SYP阳性表达细胞数术后3 d逐渐增多,且在1、2、4及8周时均大于NC组,差异具有统计学意义(见表1-3,图3)。
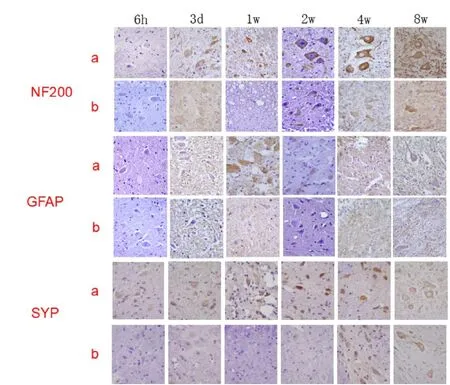
图2,免疫组化检测不同时间点各组大鼠脊髓损伤节段NF200、GFAP及SYP蛋白表达结果(×400)a:BMP7组b:NC组。
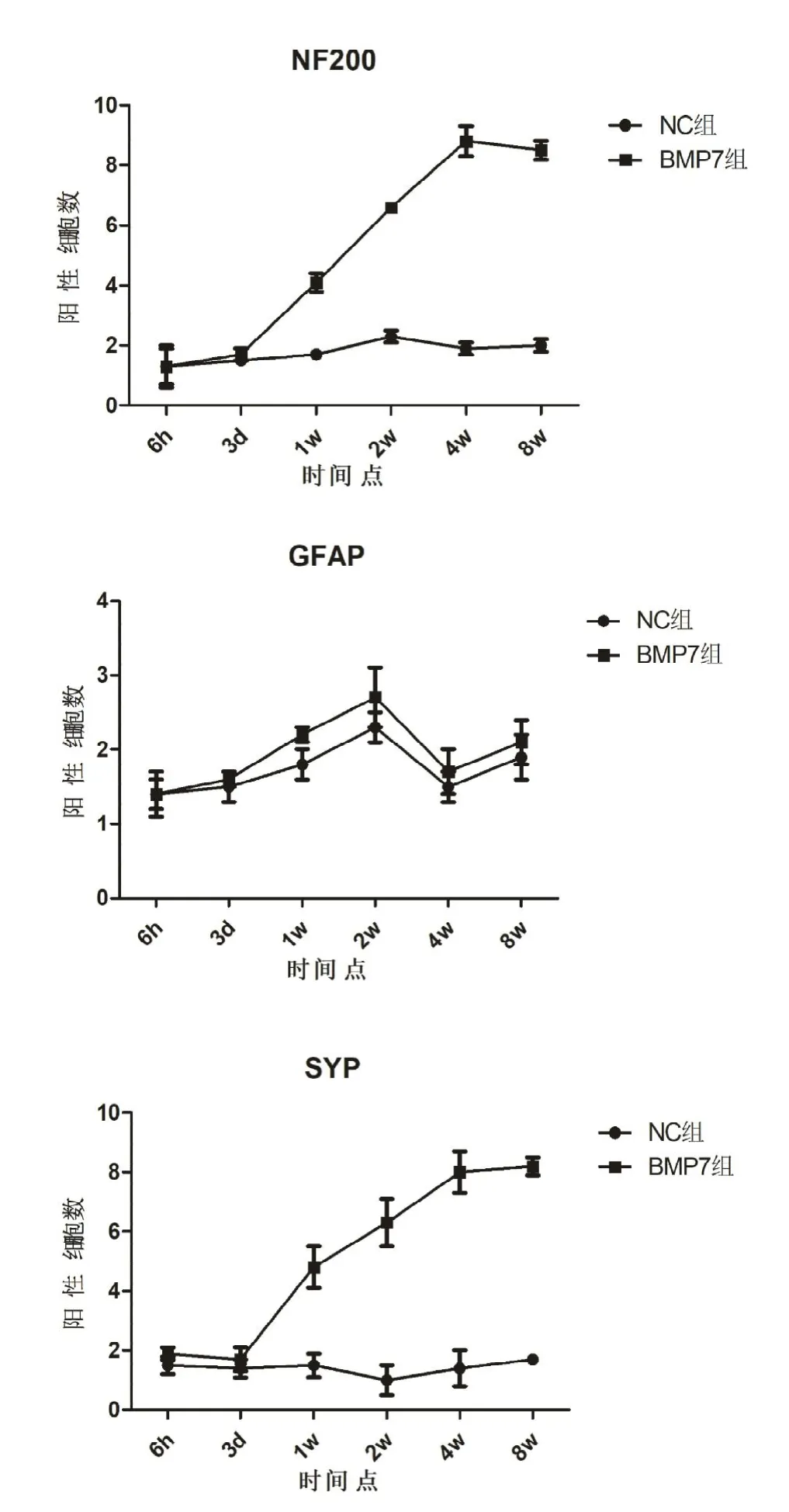
图3,免疫组化检测结果中各组大鼠脊髓损伤节段NF200、GFAP及SYP蛋白阳性表达细胞数量。
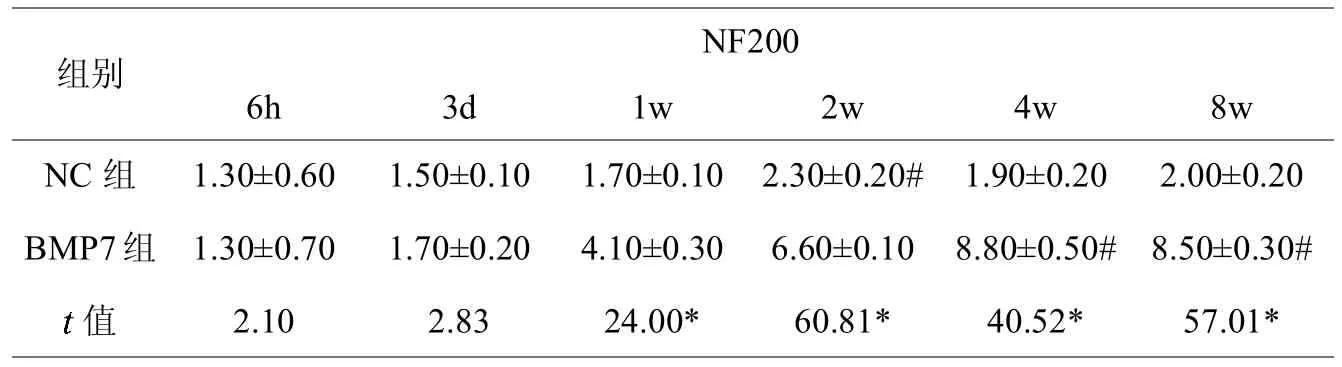
表1,不同时间点各组大鼠脊髓损伤处NF200阳性表达细胞数量
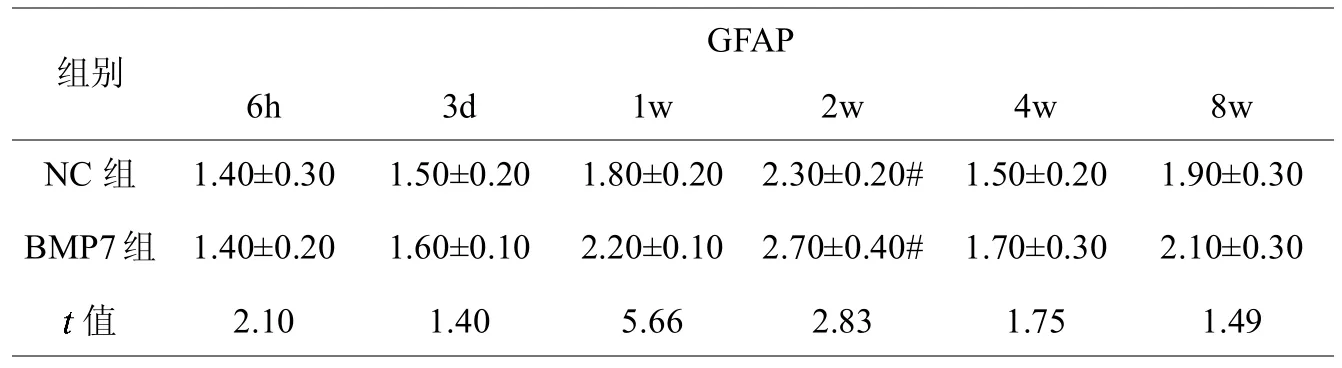
表2,不同时间点各组大鼠脊髓损伤处GFAP阳性表达细胞数量
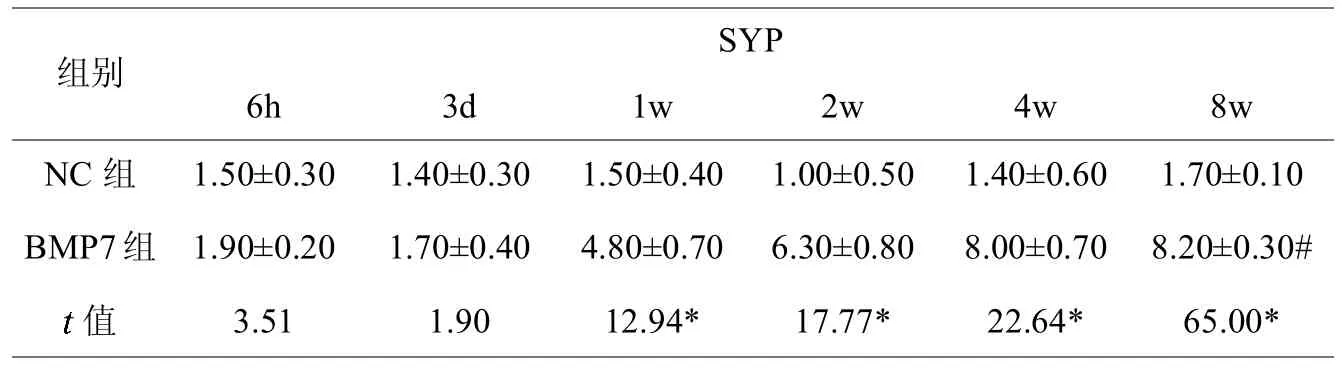
表3,不同时间点各组大鼠脊髓损伤处SYP阳性表达细胞数量
3 讨论
脊髓损伤病理过程分为原发性损伤和继发性损伤两个阶段。原发性损伤是指患者在车祸、高处坠落时由于机械原因导致脊柱骨折块的移位、椎间盘髓核脱入椎管等引起脊髓的压迫、冲击、撕裂等直接损伤;继发性损伤是由于原发性损伤引起了受损脊髓局部缺血、水肿、生长因子缺乏,从而导致脊髓受损处及相邻节段神经细胞死亡[6]。继发性损伤对脊髓功能造成的损害远高于原发性损害,因为局部环境的改变不利于神经细胞及轴突的修复,因此,早期使用营养因子抑制继发性损害、改善局部微环境及促进神经细胞修复是脊髓损伤治疗的关键[7]。
BMP是由Urist等在1965年的研究中发现的一类营养因子,是一种低分子糖蛋白,最早发现其具有成骨作用,因此命名为骨形态发生蛋白 (bone morphogenetic protein)[8]。越来越多的研究表明,BMP家族不仅与成骨有关系,也跟神经发育联系紧密,尤其是BMP7。De RiveroVaccariJP等[9]在研究中发现 BMP7可以增强中枢神经损伤后的功能恢复,利于树突的生长。因此,我们立项研究 BMP7蛋白在脊髓损伤后是否利于改善局部微环境,促进神经细胞的修复。我们以Allen's打击法建立大鼠脊髓损伤模型,随后对脊髓损伤处注射BMP7蛋白,HE染色观察脊髓损伤处病理学变化,结果表明 BMP7实验组大鼠脊髓损伤处神经元及神经突触数量较对照组高,提示 BMP7蛋白利于脊髓损伤后神经功能的修复。
为了进一步研究 BMP7蛋白促进脊髓损伤后神经功能恢复的具体机制,我们以免疫组化法检测不同时间点脊髓损伤处神经细胞的标志蛋白表达量。NF是神经元的标志蛋白之一,其主要存在于神经元的胞体及轴突中,在维护神经元的功能和轴浆转运中发挥着重要的作用。根据分子量的大小,NF可分为 NF68、NF140及 NF200,NF200正常情况下主要存在与神经元轴突中,胞体中几乎没有,但在脊髓损伤后神经元会大量合成NF200以修复神经元胞体及轴突,故NF200的表达量可反映神经元的数量及活性[10]。GFAP是星形胶质细胞的骨架蛋白,其表达量可以反应星形胶质细胞的功能状态,GFAP表达量升高可以促进脊髓损伤处胶质瘢痕的形成,不利于神经轴突的修复及神经通路的恢复[11]。SYP是一种钙离子结合蛋白,主要存在于神经元轴突及树突的突触泡膜上,其表达量可反应轴突的修复及突触的再生情况[12]。
本研究使用BMP7蛋白局部注射治疗大鼠脊髓损伤,并与对照组进行比较。结果表明:①BMP7组NF200表达量3d后明显升高,且高于对照组,提示BMP7蛋白可以提高脊髓损伤后神经元数量及活性,BMP7蛋白提高脊髓损伤处神经元的活性表明其具有神经营养功能;②BMP7组GFAP表达量与对照组相比差异不显著,表明 BMP7蛋白对脊髓损伤后星形胶质细胞数量及活性的影响不明显,这有利于减少局部胶质瘢痕形成及神经通路的修复;③BMP7组SYP表达量3d后明显升高,且高于对照组,提示BMP7蛋白具有促进脊髓损伤后神经元轴突修复的作用,有利于脊髓损伤后期运动及感觉神经传导的恢复。以上表明 B MP7蛋白可以促进脊髓损伤后神经功能的恢复,其机制是促进神经元及轴突修复而实现。
对NF200、GFAP、SYP三个标记物不同时间的纵向比较可以看出NF200和SYP的表达量3 d后逐渐升高,至第4周左右达到高峰,第8周时仍维持在较高水平。我们推测其原因可能有以下两点:①目前国内外的研究表明,BMP7具有促进干细胞跨胚层向神经元分化[13-15],我们在早期研究中也证实了这一点[16]。局部注射的 B MP7促进了髓腔膜干细胞/祖细胞向神经元细胞分化,使局部脊髓损伤处神经元数量持续增加,神经突触的数量也随之增加,神经元标志物NF200及突触标志物SYP表达量持续增高。② BMP7具有改善中枢神经系统损伤局部微环境的作用[17],Guan J在脑缺血大鼠模型的脑室内注射 B MP7蛋白,结果发现脑缺血处局部血液循环增加[18],但其具体机制尚未揭示,故我们推测同为中枢神经的脊髓,其损伤后注射 BMP7蛋白可以改善局部微环境,利于存活的神经元的生长,微环境的改善使得神经元细胞持续修复。以上两点只是我们的推测,其具体机制仍需我们在今后的试验中探索、验证。
本研究初步探索了 B MP7蛋白在脊髓损伤后促进神经细胞修复的作用,并进一步揭示其具体机制,为 B MP7蛋白用于脊髓损伤的临床治疗提供了基础依据。

