PCOS患者内分泌代谢异常与AMH水平的关系研究
梁光林 郑文玲 刘传勇 杨文滔
1. 广东省茂名市人民医院生殖医学中心,广东茂名 525000;2. 广东省茂名市人民医院产前诊断中心,广东茂名 525000
抗 苗 勒 氏 管 激 素(anti miillerian hormone,AMH)是一种在卵泡发育过程中发挥重要作用的转化生长因子β 超家族成员,主要由直径≤ 4mm的小窦卵泡的颗粒细胞及窦前卵泡分泌[1-2]。有研究发现,多囊卵巢综合征(PCOS)患者血清中AMH含量显著升高,且AMH 水平和机体激素水平异常及排卵功能障碍相关[3-4]。PCOS 是一种妇科常见内分泌紊乱综合征,育龄女性发病率为6% ~ 10%;临床表现主要有雄激素分泌过多、闭经、月经稀发或不孕、排卵障碍或卵巢持续无排卵、卵巢多囊改变、促性腺激素比例失调、肥胖、血脂异常、胰岛素抵抗;最主要的内分泌特征为雄激素水平升高[5]。研究表明,PCOS 患者无优势卵泡形成及过多小窦卵泡停滞相关[6-7]。本研究通过对PCOS 患者AMH 水平与内分泌代谢异常间的关系,为PCOS 疾病发病机制研究奠定基础,为疾病的临床治疗提供依据。
表1 观察组及对照组各指标比较结果(± s)
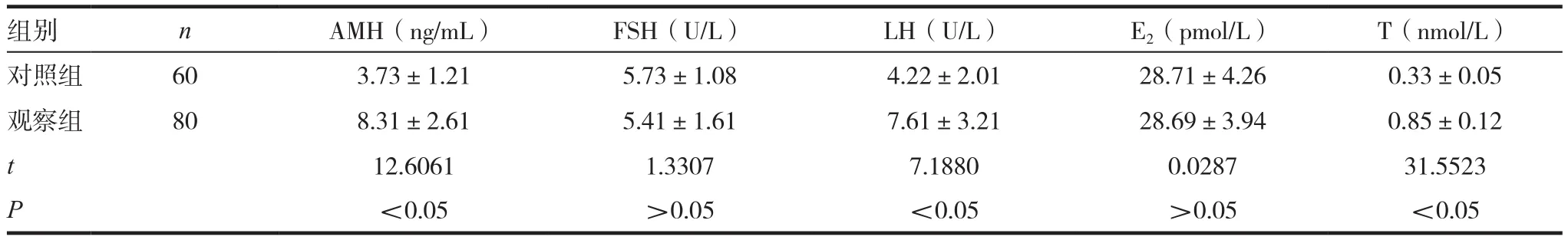
表1 观察组及对照组各指标比较结果(± s)
组别 n AMH(ng/mL) FSH(U/L) LH(U/L) E2(pmol/L) T(nmol/L)对照组 60 3.73±1.21 5.73±1.08 4.22±2.01 28.71±4.26 0.33±0.05观察组 80 8.31±2.61 5.41±1.61 7.61±3.21 28.69±3.94 0.85±0.12 t 12.6061 1.3307 7.1880 0.0287 31.5523 P<0.05 >0.05 <0.05 >0.05 <0.05
表2 不同AMH水平患者间各指标比较结果(± s)
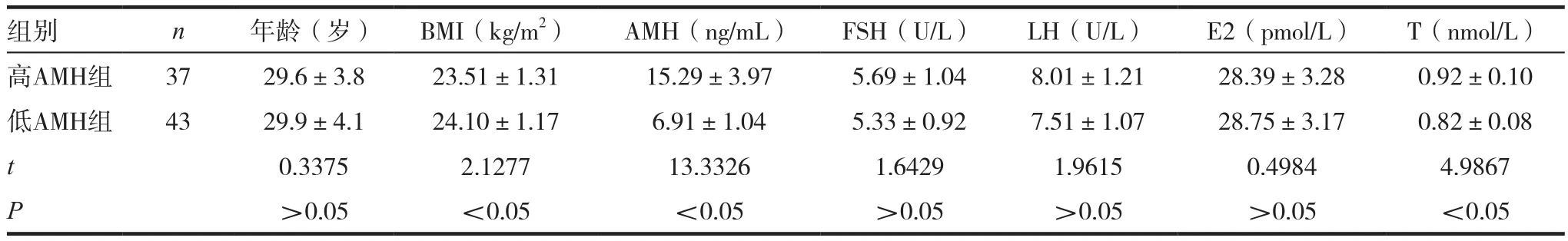
表2 不同AMH水平患者间各指标比较结果(± s)
组别 n 年龄(岁) BMI(kg/m2) AMH(ng/mL) FSH(U/L) LH(U/L) E2(pmol/L) T(nmol/L)高AMH组 37 29.6±3.8 23.51±1.31 15.29±3.97 5.69±1.04 8.01±1.21 28.39±3.28 0.92±0.10低AMH组 43 29.9±4.1 24.10±1.17 6.91±1.04 5.33±0.92 7.51±1.07 28.75±3.17 0.82±0.08 t 0.3375 2.1277 13.3326 1.6429 1.9615 0.4984 4.9867 P>0.05 <0.05 <0.05 >0.05 >0.05 >0.05 <0.05
1 资料与方法
1.1 一般资料
观察组患者选自2015 年1 月~ 2017 年8 月我院收治的PCOS 不孕症的80 例患者,疾病诊断标准参照2003 年鹿特丹标准进行,纳入标准:所有患者均确诊为PCOS 不孕症,军对本研究知情同意且自愿参与;年龄26 ~ 35 岁,平均(29.8±5.1)岁;病程3 ~ 8 年,平均(5.26±2.21)年。对照组选自同期我院收治的因输卵管因素导致不孕的60例患者,纳入标准:所有患者均为输卵管因素导致不孕,所有对照组患者均排除因雌二醇及促卵泡激素分泌紊乱引发的卵巢储备能力下降者;患者知情同意,自愿参与研究;年龄27 ~ 35 岁,平均(29.5±4.9)岁;病程 3 ~ 8 年,平均(5.31±1.62)年。入选所有患者既往均无盆腔手术史,治疗开始前3 个月均未接受任何药物治疗;排除甲状腺疾病、高催乳素血症、库欣氏综合征等可能导致排卵障碍的其它内分泌疾病患者及不能配合完成研究者。观察组患者按照AMH 水平不同分为高AMH组(≥ 10ng/mL,37 例)和低 AMH 组(< 10ng/mL,43 例)。对照组和观察组一般资料比较差异无统计学意义(P> 0.05),具有可比性。
1.2 方法(仪器为罗氏e411,方法为电化学发光)
月经周期的第2 ~ 3 天空腹采静脉血10mL,3000r/min 离心收集血清,立即测量血清各激素和AMH。血清各激素水平(卵泡刺激素(FSH),黄体生成素(LH),雌二醇(E2),睾丸素(T))及 AMH 均采用电化学发光法(ECL)测量;试剂和仪器均为一个公司配套产品;身体质量指数(BMI)依据身高、体重计算。
1.3 统计学处理
本研究数据采用Excel 进行整理,统计学分析应用SPSS22.0 软件,符合正态分布的计量资料以(x±s)表示,采用t检验,计数资料以百分数(%)表示,采用χ2检验;相关性分析采用Pearson相关分析进行。P< 0.05 为差异有统计学意义。
2 结果
2.1 观察组及对照组各指标结果比较
观察组患者AMH、LH 及T 均显著高于对照组(P< 0.05),FSH 和E2含量组间差异无统计学意义(P> 0.05),详见表1,提示AMH 升高可能与PCOS相关。
2.2 不同AMH水平患者间各指标结果比较
高AMH 组AMH 及T 均显著高于低AMH 组,BMI 显著低于低 AMH 组(P< 0.05);FSH 和 LH高AMH 组高于低AMH 组,但差异无统计学意义(P> 0.05),详见表 2。
2.3 PCOS患者AMH水平与T间的相关性分析
PCOS 患者AMH 水平与T 呈现正相关(r=0.624,P< 0.05);AMH 水平与 BMI 呈现负相关(r=-0.511,P< 0.05)。
3 讨论
早在20世纪80 年代,AMH 因其独特的生物学活性已经进入研究者视线,AMH 作为一种转化生长因子β 超家族成员,通过抑制机体卵巢中甾体类物质的合成、卵巢中原始卵泡的募集及窦前卵泡的小囊状卵泡的分泌来调节卵泡发育[7]。研究表明,与正常女性相比,PCOS 患者血清 AMH 水平显著升高,并且AMH 水平与PCOS 患者病情严重程度呈现正相关;体外培养的无排卵PCOS 患者颗粒细胞AMH 分泌量显著高于健康对照组;说明AMH的高水平表达可能与PCOS 患者卵泡生长、发育及排卵异常相关[6-9]。本研究结果显示,观察组患者AMH水平显著高于对照组,提示AMH 升高可能与PCOS相关。
高雄激素血症是PCOS 患者重要的内分泌特征,PCOS 患者中发病率约为50%;研究发现合并高雄激素血症的PCOS 患者血清AMH 浓度显著高于雄激素水平正常的PCOS 患者;PCOS 患者血清AMH 和雄激素水平呈正相关[10-12,7]。就其机制可能为AMH 作为转化因子抑制机体芳香化酶mRNA表达,阻碍雄激素向雌激素转化,导致雄激素在卵泡局部积累,当浓度达到一定程度后影响卵泡发育及优势化。本研究结果显示,观察组雄激素水平显著高于对照组,且高AMH 组雄激素水平高于低AMH 组,与以上研究相符。
流行病学调查显示,约有30% ~ 70% 的PCOS患者合并肥胖[13-15],但PCOS 患者中AMH 水平与BMI 是否相关,目前尚无定论,本研究显示,PCOS患者AMH 水平与BMI 呈现负相关;分析机制可能为肥胖对卵巢颗粒细胞功能产生负面影响,还会影响AMH,导致卵巢储备降低及卵巢功能紊乱等。
综上所述,PCOS 患者AMH 水平升高可能与患者内分泌代谢异常相关,AMH 水平升高可作为PCOS 疾病的辅助诊断标准,同时AMH 也可作为PCOS 患者治疗的潜在靶点。

