“人造精子”介导半克隆技术的建立与应用
晏萌,李劲松
①中国科学院上海生命科学研究院 生物化学与细胞生物学研究所,上海 200031;②中国科学院上海生命科学研究院GTP中心,上海 200031
“人造精子”是近些年来科学家利用先进的胚胎操作技术创造的一种可以替代精子,使卵细胞“受精”,并能产生出正常后代的单倍体胚胎干细胞。其背后凝结着科学家对干细胞技术和细胞显微操作技术的探索,以及动物胚胎发育和各种相关学科的理论完善,如胚胎发育学、蛋白质组学和表观遗传学。本文就来讲述 “人造精子”的来源、半克隆技术的发展,以及“人造精子”在生命科学和医学等领域中的应用。
1 什么是精子?
想要了解什么是“人造精子”,首先要知道什么是精子。按照定义上来说,精子是男性的生殖细胞,英文名称sperm来源于希腊文sperma,意思为种子。高等动物的有性生殖靠精子和卵细胞结合,从而形成合子,再由合子经过一系列有规律的细胞分裂与分化过程,最终发育成一个成熟的下一代个体,而精子所携带的父亲一方的基因也由此遗传至下一代[1]。成熟的小鼠精子分为4个部分:头部,包含被顶体包裹的致密化细胞核;颈部,主要包含精子的中心粒;中段,包含了轴丝和大量外围的线粒体,可以产生大量ATP,为精子在母体中的运动提供能量;尾部或者鞭毛,是精子的主要运动部位。
动物的精子形成过程叫作精子发生,这一过程主要是在雄性性腺(睾丸的曲细精管)中进行的,由精原干细胞(spermatogonial stem cells)经过减数分裂产生[2]。精原干细胞经过一次不对称的有丝分裂产生两种细胞:一种是A类型的细胞,实际上就是精原干细胞自身,用来维持精原干细胞的数量;另一种是B类型的细胞,可以分化为初级精母细胞。初级精母细胞经过减数分裂一期分裂为两个次级精母细胞,两个次级精母细胞随后经过减数分裂二期分裂为两个精细胞(图1)。高等动物体细胞中包含有两套完整的基因组信息,称作二倍体细胞(2N)。例如:人体细胞包含22对常染色体和一对性染色体XY,一共46条染色体;小鼠体细胞则包含19对常染色体和一对性染色体XY,一共40条染色体。包含两套完整的基因组信息就使得如果一条染色体上的基因发生突变另一条染色体上的基因可以弥补,从而保证生物体的正常生长发育。男性的体细胞中性染色体包括一条X染色体和一条Y染色体,而女性的体细胞中则是两条X染色体。从精子发生的过程看,精原干细胞和精母细胞都是二倍体细胞(2N),精母细胞在减数分裂前会进行DNA的复制,成为四倍体(4N);经过减数分裂一期和减数分裂二期两次细胞分裂过程,由四倍体分裂为只含有一套基因组信息的精细胞,并且只含有一条性染色体X或者Y,因此精细胞是单倍体细胞(1N)[3]。精细胞再经过一系列复杂的精子形成过程,变形成为可以游动的成熟精子(1N),储存在附睾中(图1)。卵细胞也是一种单倍体细胞(1N),因女性的性染色体含有两条X染色体,所以卵细胞中也只有一条X染色体,当精子与卵子结合后成为合子,又重新变成二倍体细胞(1N+1N=2N)。因此,由合子经过有丝分裂和生长发育产生的成熟个体还是二倍体个体(2N),保证了生物体的延续。

图1 精子发生过程和人造精子形态。精原干细胞(2N)经过一次有丝分裂形成一个初级精母细胞(2N),再经过减数分裂一期和二期,形成4个精细胞(1N),最终变形为成熟精子。“人造精子”在外观上类似于未成熟的球形精子,在结构上不具备成熟精子的复杂特化结构,但是保持了自我复制及受精的能力
2 什么是“人造精子”?
成熟的精子是单倍体细胞(1N),“人造精子”也是单倍体细胞(1N),更准确地说,“人造精子”的实质其实就是单倍体胚胎干细胞(1N)。单倍体胚胎干细胞也是胚胎干细胞的一种,相对于正常二倍体的胚胎干细胞(2N),其核内只包含一套完整的遗传物质,细胞也较二倍体干细胞小(小鼠单倍体细胞直径8 μm左右,二倍体细胞大约为10 μm)[4-5]。对单倍体来说,如果基因发生突变,没有备份基因来补偿其功能的缺失,因此会出现相应的生理缺陷,生物学家也就可以得知这个基因是与这一生理缺陷相关。相比于正常成熟的精子来说,“人造精子”不仅仅保持了精子的单倍体性,而且也可以作为另一半遗传物质的提供者,与卵细胞结合,产生健康的后代[6-8]。更重要的是,“人造精子”具有胚胎干细胞的全能性,保持了在体内或者体外的三胚层分化能力,也就是说具有在一定的条件下发育成完整的生物个体的能力,以及作为干细胞能够通过细胞分裂来扩增的能力,能够长期传代培养[9]。然而精子在成熟后,就再也不能进行分裂扩增了,只有当与卵细胞结合成为合子后,才能以二倍体的形式继续分裂发育下去。
目前,从“人造精子”建立的来源来说,主要分为两类:一类是父源的单倍体胚胎干细胞,主要使用精子的细胞核构建的单倍体胚胎干细胞系;一类是母源的单倍体干细胞,使用的是卵细胞的细胞核构建单倍体胚胎干细胞系[10]。无论是父源还是母源的单倍体干细胞系,目前构建成功的细胞系,其细胞核内包含的性染色体全部都是X染色体,而无包含Y染色体的单倍体干细胞系[6-7]。这也就说明,Y染色体本身可能无法支持单倍体干细胞的各种生理活动,使其无法成活,也可能是目前的技术有限,不能提供Y染色体单倍体干细胞的生存环境。所以,通过注射“人造精子”(X)到卵细胞(X)中得到的幼仔均是雌性(X+X=XX)。
单倍体胚胎干细胞的一个特点就是,在培养过程中会自发的二倍体化,也就是会有一部分单倍体细胞会成为二倍体细胞。小鼠细胞体外分化单倍性维持很不稳定,而人的相对稳定[11-12]。这对单倍体的应用带来极大的不便,因为我们必须不断地富集单倍体干细胞,才能保证其基因组的单倍体性。目前的研究表明,造成二倍体化的原因主要是由于单倍体干细胞的细胞分裂过程不能正常完成导致的,而不是两个单倍体细胞发生融合产生的。正常二倍体细胞的有丝分裂过程分为分裂间期和分裂期(M期);分裂间期又被分为G1期(合成细胞分裂所需要的蛋白,为DNA复制做准备)、S期(细胞核内染色体DNA的复制)和G2期(细胞生长,蛋白合成,为分裂期做准备)。然而,有一部分的单倍体细胞在分裂期时发生异常,如跳过M期和重新进入G1/S期,导致DNA含量加倍而未进行分裂。因此,使用一种含有Wee 1激酶小分子抑制剂的改良培养基,通过加速单倍体胚胎干细胞G2/M期转变和防止再进入额外的G1/S期,以此来调节单倍体胚胎干细胞的细胞分裂周期,发现该方法可用于单倍体胚胎干细胞的体外较长期维持[13]。浙江大学的沈立教授研究组也发现,通过在2i培养基中加入药物PD166285,用于加速S-G2/M期的转换,也可以使得单倍体胚胎干细胞维持其单倍体性5周以上[14]。这些结果支持了细胞周期异常是单倍体细胞自二倍体化的原因,说明单倍体细胞与二倍体细胞在细胞周期调控上存在差异。
目前来说,常规性的单倍体胚胎干细胞维持需要流式细胞仪来进行单倍体的分选和富集[4-5],也可以根据单倍体与二倍体细胞的大小,选择合适孔径的滤膜将单倍体细胞过滤出来[15-16]。流式细胞仪是用来分选细胞的大型仪器,其工作原理大致是靠其灵敏的光学探测器,来捕捉细胞被特定的激光照射后所散射的荧光,这些光信号又被转换成为电信号,进一步转换成数字信号才能进行分析。细胞内的DNA可以被一种蓝色荧光染料Hoechst 33342结合,使得细胞核在波长355 nm的激光照射下发出波长约461 nm的荧光[17-18]。当染色后的单倍体胚胎干细胞通过流式细胞仪时,其散发的荧光会被捕捉到。单倍体只含有二倍体一半的DNA,因此单倍体胚胎干细胞所发出的荧光强度也比二倍体细胞小。正因为如此,我们可以在流式细胞仪的分析统计界面看到细胞的荧光强度主要集中为3个峰:荧光强度最小的峰a是单倍体细胞所散发的,峰b是二倍体细胞及处于细胞周期G2期到M期的单倍体细胞,峰c是四倍体细胞,也即处于细胞周期G2期到M期的二倍体细胞[19]。选择峰a处的细胞,便可将单倍体胚胎干细胞分离出来(图2)。
3 “人造精子”的起源和建立
在早期的研究中,由于酵母可以产生单倍体的孢子,其为单一基因功能的阐释提供了很好的工具。同时,酵母的单倍体的孢子也可以被用来进行大规模的筛选某一信号相应通路中各种组分,极大地推动了对未知基因的研究[20]。相比于酵母孢子这种天然的单倍体,高等动物很难获得状态很好的单倍体细胞。自从1970年以来,生物学家投入了大量精力来获得小鼠的单倍体胚胎[21]。1981年,小鼠的二倍体胚胎干细胞系构建成功,因此,生物学家按照同样的思路来构建小鼠的单倍体胚胎干细胞系[22-23]。激活减数分裂II期的卵母细胞的确得到了单倍体的胚胎,但是利用这些胚胎构建的细胞系都是二倍体的细胞系。后来发现,这一过程是由于单倍体干细胞在培养过程中很快发生二倍体化。将近30年过去了,单倍体胚胎干细胞的建立一直没有突破,这也限制了单倍体胚胎干细胞在高等动物研究中的应用。最早报道的一株类单倍体的高等哺乳动物的细胞系为KBM7。它是从人的白血病细胞系中分离得到的,是一株癌症细胞系,除了8号染色体是两条外,其余的常染色体均为单倍体,但是由于其来源是肿瘤细胞,基因组的不稳定性也使其不能更广泛地被接受[24]。
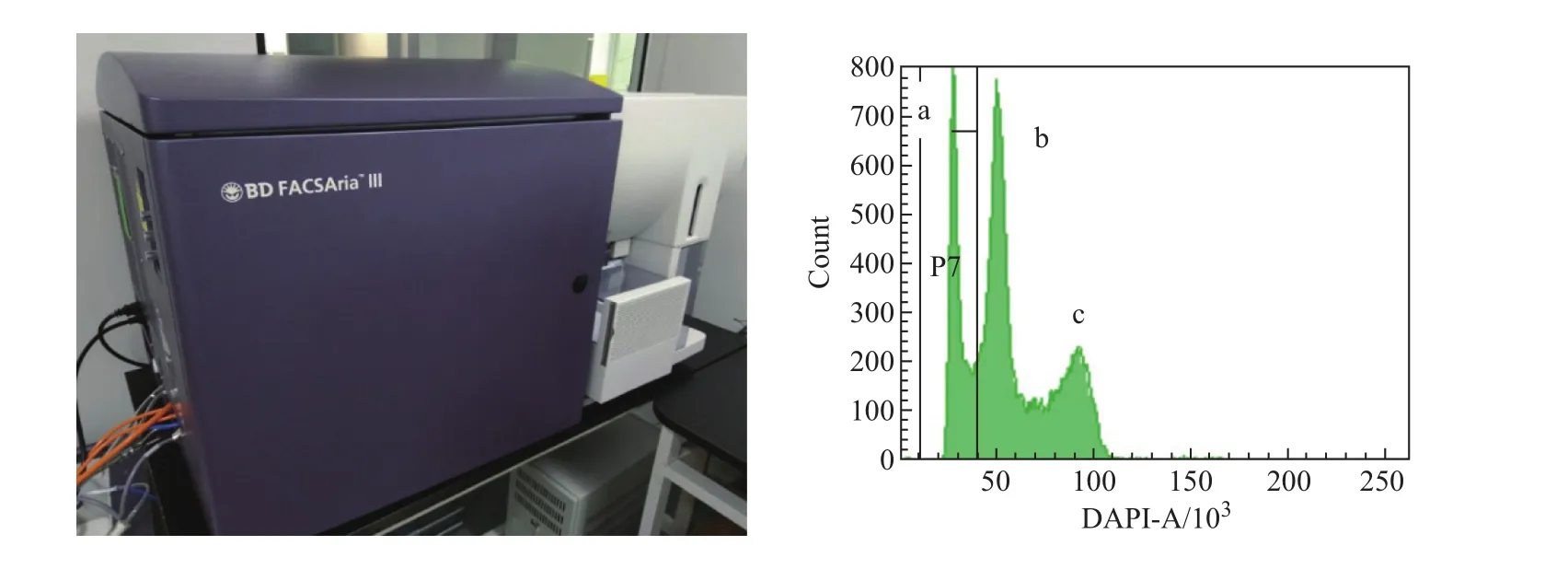
图2 流式细胞仪和单倍体的分选富集。左图是用于分选单倍体胚胎干细胞的大型流式细胞仪;右图是单倍体胚胎干细胞系经过流式细胞仪的统计数据,分为a、b和c三个峰,所要分选的单倍体胚胎干细胞为a峰
真正意义上的脊椎动物单倍体胚胎干细胞的建立是在2009年,新加坡国立大学Yi等人建立了青鳉鱼的雌核发育的单倍体胚胎,进而衍生出了三株单倍体胚胎干细胞系,在传代中十分稳定地存在,并且还能够代替青鳉鱼的精子,具有受精的能力[8](图3(a-d))。紧接着在2011年,英国科学家Wutz实验室和奥地利科学家Penniger实验室同时报道了高等哺乳动物小鼠孤雌单倍体胚胎干细胞系的建立,这是在体外首次建立的高等哺乳动物正常的单倍体细胞系[4-5]。2012年,中国科学院上海生命科学研究院生物化学与细胞生物学研究所李劲松实验室和中国科学院动物研究所周琪老师实验室,先后报道了小鼠孤雄单倍体胚胎干细胞系的建立[6-7](图3(e))。

图3 半克隆青鳉鱼和半克隆小鼠。(a)半克隆青鳉鱼表现出类似于母亲的色素积累,(b、c)与单倍体胚胎干细胞一样,也表达绿色荧光蛋白,(d)半克隆青鳉鱼可以正常地产出后代;(e)小鼠的单倍体胚胎干细胞通过胞浆内孤雄单倍体胚胎干细胞注射(ICAHCI)得到的半克隆小鼠
目前,小鼠孤雌单倍体胚胎干细胞系的建立主要是通过激活没有受精的卵母细胞,待其发育到囊胚期,分离内细胞团,并用2i ESCs培养体系的培基培养,一定时间后,用流式细胞仪进行单倍体细胞的分选,将分选得到的单倍体细胞继续生长,重复此过程,最终得到的单倍体稳定的孤雌单倍体胚胎干细胞系[4-5]。另一种方法是,在刚受精后的合子雄原核和雌原核融合前,把雄原核取出来,然后培养成囊胚来构建孤雌单倍体胚胎干细胞系。上述方法,如果将雌原核取出来,构建出来的就是孤雄单倍体胚胎干细胞系[25-26]。孤雄单倍体胚胎干细胞系还可以通过将精子的头部注入去掉细胞核的卵母细胞中,体外培养成囊胚来构建[6-7](图4)。
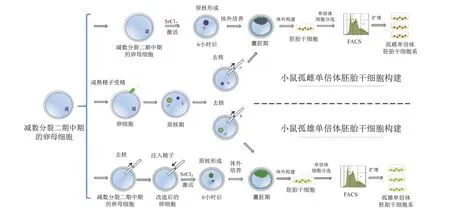
图4 小鼠孤雌和孤雄单倍体胚胎干细胞的构建方法。孤雌单倍体胚胎干细胞靠激活减数分裂二期中期的卵母细胞或者去除受精卵中的雄原核的方法获得;孤雄单倍体胚胎干细胞通过去除受精卵中的雌原核,或者激活注入精子头的去核卵细胞的方法获得。得到的孤雌和孤雄单倍体胚胎干细胞都要靠流式细胞仪来分选富集
这些构建好的小鼠孤雌单倍体胚胎干细胞系均没有受精能力,注射至成熟的卵细胞中,不能得到存活的后代,因此在个体水平上利用孤雌单倍体胚胎干细胞获得基因修饰的动物难度非常大,制约了其应用。相比之下,小鼠孤雄单倍体胚胎干细胞系具有一定的受精能力。李劲松实验室通过注射孤雄单倍体胚胎干细胞到卵母细胞后,激活并启动胚胎发育,成功得到了健康的小鼠(ICAHCI技术)[6]。因为这些小鼠只有一半遗传物质来自同样的父本,所以也称之为半克隆小鼠。但是,运用这种技术得到小鼠的效率很低,最好的也仅有5%,而且有一半是发育异常的小鼠;并且随着单倍体细胞生长的时间加长,有逐渐丢失这种“受精”能力的迹象,以至于最终不能获得存活的半克隆小鼠。
如何才能提高小鼠孤雄单倍体胚胎干细胞注射的成功率和获得健康小鼠的效率,是摆在生物学家面前的难题,也是技术能否进一步得到广泛应用的关键。经过努力,研究人员发现小鼠孤雄单倍体胚胎干细胞的表观基因组与正常的精细胞有很大差别,这可能是制约半克隆小鼠成功获得的关键之一。表观基因组学是对非DNA突变带来的可遗传性变化的研究,这些变化可来自外界环境因素或者生物体自身的发育过程。DNA的甲基化修饰是表观基因组学的一个重要修饰形式,细胞核内的DNA在某些条件下可以被DNA甲基化酶甲基化修饰,从而影响此处的基因发挥作用。小鼠单倍体胚胎干细胞在H19和IG两个基因的差异甲基化区域的DNA甲基化水平要低于精子的DNA甲基化水平,随着细胞培养时间增长,这两个区域甲基化逐渐变少,并且健康状态的小鼠DNA甲基化明显高于死亡小鼠。这些现象表明,小鼠单倍体胚胎干细胞的表观基因组对半克隆小鼠的状态有很大影响。依此原理,李劲松实验室通过改变H19和IG两个基因的差异甲基化区域,成功地提高了半克隆小鼠的成活率,从5%提高到20%[27]。而且,不仅仅是孤雄单倍体胚胎干细胞,修改过后的孤雌单倍体胚胎干细胞也可以有效地产生半克隆小鼠,效率约15%。这些研究极大地推动了单倍体干细胞的应用价值,使得单倍体的研究从细胞层面上升到个体层面,提高了研究的准确度和可靠度。
4 人造精子的应用价值
随着“人造精子”——单倍体胚胎干细胞近年来在技术上的不断突破,以及CRISPR基因定点编辑技术的兴起,二者可以完美融合在一起,使生命科学的研究发生了翻天覆地的变化。下面就来讲述一下“人造精子”在生命科学和医学研究中发挥的重要作用。
4.1 生命科学研究
“人造精子” 由于其基因组的单倍体性,且在体外几乎能够无限扩增和拥有多组织分化潜能的特性,被广泛地应用到各种基因的功能研究中[28],如干细胞的分裂与分化原理、性染色体相互作用、基因印记功能等。首先,“人造精子”本身就是一个很有科学意义的研究,包括其在生长发育过程中与二倍体之间的差异,其在培养过程中如何保持表观基因组,如何才能进一步地提高半克隆小鼠的生存率等。其次,近年来基因编辑技术的兴起,ZFN、TALEN和CRISPR的进步,使科研人员可以轻而易举地实现细胞水平的基因编辑,也可以通过在受精卵中注射所需要的组分直接得到基因编辑过的小鼠个体[29]。然而,在对受精卵编辑的过程中,一次性得到多个基因编辑的动物模型构建比较困难,且由于基因编辑效率的不同,出生的小鼠带有基因编辑的类型也各不相同。“人造精子”在细胞层面的可操作性强,可以支持任意的基因编辑方式,更可同时编辑多个目的基因,通过ICAHCI技术可以一步转化成小鼠模型,相比于在受精卵中进行编辑大大提高了效率,节省了构建时间和研究经费。
除了单个或多个基因的功能研究,单倍体胚胎干细胞更大的优势是在全基因组的大规模筛选上。CRISPR技术利用特定靶向基因组上某个特定位置进行编辑,其组分中的sgRNA决定着编辑的位置,通过构建靶向某一类基因家族,可以研究某一类基因家族的生理功能,更可以构建靶向基因组所有基因的sgRNA文库,进一步转入单倍体胚胎干细胞中,得到具有每一个基因都被编辑的单倍体胚胎干细胞突变体库[30-31]。再利用这一单倍体细胞突变库进行对药物的筛选,或其他条件性的筛选,得到的目标细胞可以用来进一步研究基因功能,也可以方便地建立模型小鼠库;再利用小鼠库进行动物水平的筛选或研究,使筛选和研究的结果更加方便和可靠。单倍体胚胎干细胞使得细胞水平的研究和动物个体水平的研究形成统一,为生命科学的各项研究提供了一个连续不间断的新体系,有望成为基因研究的新标准。
4.2 遗传病的控制
人类的基因组计划在2003年4月完成,一共46条染色体包含了近30亿对碱基。其中有大约20 500个蛋白编码基因,只占了碱基总数的5 %,剩余的碱基序列,除了部分已知的增强子、非编码RNA等,大部分的功能目前还不是很清楚。在细胞分裂的过程中,基因组也会发生复制。虽然有很严格的修复机制,使得复制的错误率很低,但还是会不可避免地发生某些错误,尤其是会导致基因组中重要基因突变的错误,进而产生了基因功能发生变化带来的生理缺陷病。如果生理缺陷病是可遗传的,则称为遗传性疾病,通常为患者的精子或卵细胞携带突变造成的。因此,要彻底解决这些遗传性疾病就必须修复患者的基因组信息,使得突变位点不会再遗传到子代中去。另外,利用“人造精子”可以成功修复个体的遗传性疾病,不仅对单基因的遗传病有效,对多基因遗传病的同时修复更是其他技术所不能达到的,在未来遗传病的控制中发挥着不可比拟的作用。
4.3 GTP计划和蛋白质云图
在完成了利用“人造精子”对单个或者几个基因的编辑,成功地彻底修复了遗传性疾病之后,研究人员并没有停止,而是把目光转向了“人造精子”在整个基因组基因研究中的应用。在基因组修复的过程中,研究人员使用了健康的序列,让DNA在复制的过程中按照健康的序列进行复制,因此在子代的细胞中就会出现带有健康序列的单倍体胚胎干细胞。如果在提供的序列上加上一些特定的标记,那么这些标记也会被加到基因组中。如果标记在一个可翻译蛋白质上,那么我们就可以通过检测这个标记来检测这个蛋白,就比如你的玻璃球用彩笔做个标记,然后再和别人的混起来,这样你就能很轻松地根据标记把你的玻璃球与别人的分开。同样的道理,可以在感兴趣的基因后面加一个标记,这样就可以检测该基因在细胞中的位置,表达量的多少,在某些条件下有没有发生变化等信息。这种检测的结果十分可靠,可以直接检测通过ICAHCI技术出生的健康子代中该基因的真实表达量,这一点是其他常规技术所不能办到的。如果采用一种标准的HA序列标记,就可以用一种HA的抗体来检测所有的目标蛋白,可避免传统方法中要制备各种不同抗体的困难和抗体的效价不稳定的弊端,节约大量研究成本和时间。因此,在2017年5月份,由李劲松研究员率先提出了基因组标签计划(Genome Tagging Project,GTP),计划对小鼠2万左右个基因全部完成标签加入,构建带有标签的细胞系及小鼠模型,并为中国和整个世界提供整个资源库。计划一提出便得到了来自各个研究者和研究机构的支持,分别表示了对该计划的设想。目前,该计划正在进行中,第一批的资源将会在2019年6月份开放给研究者。
在GTP计划的基础之上,李劲松研究员又提出了全基因组蛋白质云图(Protein Atlas)的设想。通过GTP产生的细胞系及小鼠模型,研究者来构建全方位、不同发育时期、不同生长条件下的蛋白质实时示踪和捕捉,为了解生命活动的各项调节过程提供最为准确的信息。通过将不同的示踪方法、不同的检测体系、不同的信号通路混合起来同在一个细胞中同时进行观察和研究,研究人员将会绘制一幅漂亮的蛋白全景云图。
5 展望
“人造精子”在不同研究层面都展现了优秀的品质,而且随着生命科学技术的更新,“人造精子”的应用也更加广泛。未来“人造精子”的研究将会主要围绕在其单倍体稳定性的研究、表观基因组的维持和改善、“人造精子”向成熟精子的转变、提高健康动物模型的出生效率及蛋白质云图等方面。“人造精子”技术的继续高速发展,需要生物学家不懈的努力。
(2018年6月8日收稿)■

