调节骨髓间充质干细胞的微环境因素研究进展
陈雪,邓子翔,牛云飞
(1.海军军医大学,上海 200433;2.长海医院创伤骨科,上海 200433)
19世纪六七十年代,Bianco等[1]发现骨髓中含有一种能自身繁殖的间质细胞群,简称成纤维细胞集落形成单位(colony forming unit of fibroblast,CFU-F)。研究发现,这是一类广泛存在于骨髓及间叶组织中的细胞,具有多向分化潜能,学者们将此类细胞称为间充质干细胞(mesenchymal stem cell,MSC)。MSC周围的细胞和微环境精确调节间充质干细胞的动态平衡。微环境因子失调会引起间充质干细胞功能增强或减弱。骨髓MSC功能减弱会导致组织再生的障碍,如骨质疏松;反之,MSC功能增强会导致间充质组织异位生长,如异位骨化。无论是获得性还是遗传性异位骨化,为通过模型研究MSC功能增强与疾病的关系提供了可能。
骨髓MSC常被作为细胞再生疗法的理想供体细胞,但只有少数研究关注活体微环境对骨髓MSC的作用。了解微环境因子失调如何导致骨髓间MSC下游的病理生理过程,将为最终明确骨髓MSC的分化及生理功能打下基础,下面对影响骨髓MSC分化的微环境因素进行综述。
1 影响骨髓间充质干细胞的微环境因素
1.1 炎症因子 肿瘤坏死因子α(tumor necrosis factor,TNF-α)是一种促炎性细胞因子,它可以抑制或促进骨髓MSC的成骨分化。研究表明[2],TNF-α可以抑制MSC的成骨分化和骨骼的形成。在雌激素缺乏致骨质疏松的小鼠模型[3]中,TNF-α可以通过β-蛋白信号通路抑制3B脑信号蛋白,进而抑制骨髓间充质干细胞的成骨分化。TNF-α通过减少miR-17的表达、上调泛素连接酶(Smadubiquitylation regulatory factor-1,Smurf-1)水平,抑制人牙周韧带组织来源的间充质干细胞成骨分化。Yang等[4]发现TNF-α在强直性脊柱炎细胞环境中促进人骨髓间充质干细胞增殖及成骨分化,因肽基精氨酸脱氨酶Ⅳ型(peptidyl arginine deiminase type Ⅳ,PADI4)的沉默而衰减。研究发现TNFα和白细胞介素-1β(Interleukin-1β,IL-1β)可以刺激骨外植体中培养的人间充质干细胞组织非特异性碱性磷酸酶(tissue non-specific alkaline phosphatase,TNAP)的活性和钙化。TNF-α和脂多糖(lipopolysaccharide,LPS)也可以刺激碱性磷酸酶(alkaline phosphatase,ALP)活性,在有或无骨形态发生蛋白(bone morphogenetic protein-2,BMP-2)成骨细胞培养基中培养的骨髓间充质干细胞都可使骨基质钙化[5]。同样,细胞因子激活的炎症中,人骨髓间充质干细胞促进成骨细胞的增殖、迁移、分化和钙化[6]。在烧伤诱导的异位骨化中,包括TNF-α在内的炎症因子对烧伤小鼠[7]脂肪来源的间充质干细胞有促进成骨的作用。
其他炎性因子对于MSC发挥了相似的作用。IL-1β对成骨细胞分化有抑制作用,但可以增强在体外培养的人骨髓间充质干细胞钙化。IL-17A和IL-17F可以增强人骨髓间充质干细胞的成骨分化[8]。炎症因子能影响间充质干细胞的干性。通过核因子κB(nuclear factor-κB,NF-κB)信号通路介导的卵巢切除的小鼠中转化生长因子β超家族抑制蛋白7(signaling pathway-mediated activation of mothersagainst decapentaplegic homolog 7,SMAD7)的活化,说明干扰素-γ(Interferon,IFN-γ)和TNF-α能协同地损害间充质干细胞的自我更新和分化。虽然IFN-γ调节人骨髓间充质干细胞的分化潜能,但它对人骨髓间充质干细胞的自我更新能力并没有发挥重要的影响作用。无论是人类还是小鼠,在异位骨化中IL-6血清浓度、神经炎症因子的水平以及物质P含量都有所增加,这是由于疾病过程中炎症的持续性作用。基质细胞衍生因子1(stromal cell derived factor,SDF-1)是一种趋化因子,它通过趋化因子受体(chemokine receptor 4,CXCR4)调节细胞交通和归巢,在向靶组织招募间充质干细胞中起着重要的作用。但在大鼠骨折模型[9]中,SDF-1对间充质干细胞增殖或成骨分化没有必要作用。SDF-1能够调节BMP-2诱导的人源和鼠源的骨髓间充质干细胞的成骨分化。
综上所述,炎性因子特别是促炎性细胞因子,对各种不同情境中的不同谱系间充质干细胞增殖或成骨分化起着至关重要的作用,部分细胞因子可以帮助调节间充质干细胞自我更新(见表1)。

表1 炎症因子对骨髓间充质干细胞分化的作用
1.2 细胞因子和多肽 许多细胞因子调节间充质干细胞的干性和成骨分化,包括生长因子、激素和一些小分子。在创伤引起的异位骨化患者中,许多细胞因子的水平增高,包括BMP-1、生长分化因子11(growth differentiation factor,GDF11)和转化生长因子β1(transforming growth factor,TGF-β1),而其他如BMP4,BMP5和生长分化因子10(growth differentiation factor 10,gdf10)则水平降低。BMP-2是一种骨诱导蛋白,在异位骨化中起着重要的作用。血小板衍生生长因子(platelet derived growth factor,PDGF)在组织损伤后作为间充质干细胞的趋化因子。分离的创伤或多发性创伤患者(与异位骨化相关)血清诱导人工培养的间充质干细胞的增殖,在一定程度上与PDGF浓度相关[10],并且骨髓中间充质干细胞数量与血清血小板衍生因子AA或BB(PDGF-AA/-BB)浓度也是相关的。富血小板纤维蛋白(platelet rich fibrin,PRF)缓慢持续释放多种自体生长因子,Wang等[11]发现在体外PRF刺激骨髓间充质干细胞增殖和成骨,并且与无PRF组相比,间充质干细胞与PRF共同注入严重联合免疫缺陷小鼠组,会导致更多、更致密的新异位骨。
雌激素通过维持成骨细胞介导的骨形成和破骨细胞介导的骨重吸收来维持骨量。Chen等[12]发现在雌激素治疗绝经后妇女骨质疏松时,雌激素受体和ALP的mRNA表达增加,但骨钙素和IL-6减少,说明雌激素可能对骨质疏松女性骨髓间充质干细胞的成骨细胞分化有显著的影响。研究发现雌激素受体基因多态性与脊柱后纵韧带骨化(ossification of posterior longitudinal ligament,OPLL)有关,并且3.17β-雌二醇刺激培养的患者脊柱后纵韧带骨化,可以促进骨钙素(osteocalcin,BGP)的形成,它是绝经后骨质疏松症患者骨形成的特异性标记。
细胞因子还可以帮助维持间充质干细胞干性。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)与维护更高程度的人骨髓间充质干细胞干性有关。在体外碱性成纤维细胞生长因子刺激小鼠骨髓来源的间充质干细胞,可以影响干性的程度。bFGF处理后的间充质干细胞植入体内时,招募宿主细胞,具有激活内源性再生机制的能力。血管内皮生长因子(vascular endothelial growth factor,VEGF)在人类间充质干细胞介导的心肌再生中起关键作用。C3H/10T1/2的间充质干细胞细胞系,其自身分泌细胞因子,如胰岛素样生长因子-1(Insulin-like growth factor,IGF-1),这有助于调节组织再生[9]。
也有研究认为,bFGF会降低精原干细胞/骨髓基质干细胞的干性(spermatogonialstemcells,SSCs/Bone MSCs),可能由于bFGF可以促进细胞增殖,而不是自我更新。bFGF刺激SSCs/Bone MSC在体内没有骨髓处扩展增殖形成骨,提示bFGF可能将干细胞推向成骨的状态。
总的来说,多种细胞因子都与间充质干细胞功能增强有关,即增强间充质干细胞自我更新和增殖能力,或增强成骨细胞的分化(见表2)。
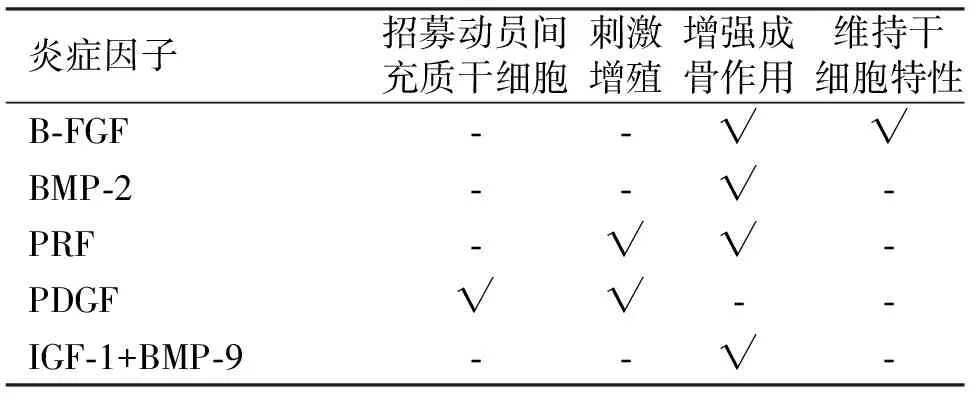
表2 细胞因子和多肽对骨髓间充质干细胞分化的作用
1.3 细胞外基质 细胞外基质(extracellular matrix,ECM)对保留间充质干细胞干性发挥重要作用。Xiong等[13]发现,脱细胞基质涂层能帮助维持小鼠脂肪来源培养的干细胞的干性。Rakian等[14]将人类原发性间充质干细胞培养在骨髓来源无血清的细胞外基质,比较集落形成和分化,发现骨髓来源细胞外基质提供了一个独立的微环境,它维持间充质干细胞集落形成的能力,同时维持干性。人类基质细胞衍生的细胞外基质能提高人骨髓间充质干细胞增殖能力,维持他们的分化能力[15]。
对于人类骨髓来源的间充质干细胞的分化,Hoch等[16]建立了一种细胞分泌的、脱细胞的细胞外基质,其中以糖蛋白为主,它提示以趋化因子和生长因子的形式支持细胞黏附分子。这个基质可能指示细胞的命运,通过展示了一个复杂的生理相关的环境可以更好的保护产生表型的间充质干细胞,并稳定成骨细胞的表型。Gawlitta等[17]发现,作为支架,未接种的脱细胞软骨基质本身很少引起软骨内成骨的再生。而预接种人骨髓来源软骨中的间充质干细胞在脱细胞水解乳蛋白培养基上,可以恢复其在异位骨化的潜能。富含半胱氨酸基质信号蛋白(cysteine-rich protein 61,Cyr61或CCN1)是一种在癌细胞中高表达的成分,也可以在骨髓来源的间充质干细胞分泌物中发现。CCN1能调解Wnt信号通路蛋白来源的间充质干细胞细胞系的成骨分化,并且可以促进体内外小鼠软骨初代间充质干细胞成软骨分化。
人造生物材料也可以高仿一些细胞外基质的微环境效应。例如,磷酸钙中的羟基磷灰石泡沫可以代替骨。Viti等[18]用基因表达芯片来研究磷酸钙诱导的体外人骨髓来源间充质干细胞分化中可能涉及的通路,以及与成骨分化相关的一些基因表达增多,包括骨桥蛋白抗体、唾液酸蛋白和一些骨形态发生蛋白。已经有许多关于构建人工生物材料的尝试,通过用重组细胞外基质蛋白和多肽涂覆材料表面或采用脱细胞同种异体或异种组织作为支架,以求更充分的模仿间充质干细胞生物学效应。在一般情况下,前者未能捕捉到天然细胞外基质的复杂组成和结构特征,后者则担心重复性、可用性和免疫反应。
1.4 力学因素 研究细胞外基质的力学因素或生物物理方面是有必要的,因为微环境的这一方面也对干细胞行为产生重要影响,特别是间充质干细胞的谱系特异性分化,对于开发组织工程和再生医学的生物材料也是必不可少的。
骨髓间充质干细胞的体内力学微环境是由内在刚度、组成、细胞外基质的位形和外在对基质施压负重(如流体流动、压缩、静水压力和张力)所确定的[19]。间充质干细胞有大量的膜蛋白和细胞骨架成分,可以感知和响应它们所处的力环境。但对体内确切的力机制仍知之甚少,目前尚无关于异位骨化背景下间充质干细胞力学机制的具体研究,也没有可以用来进行系统研究完善的体内系统。目前为止大多数研究探讨骨髓间充质干细胞力生物学时已经使用2D/3D体外试验。
体外实验均表明基质或基质刚度在调节骨髓间充质干细胞向特定谱系分化方面起到关键作用。接种到软基质骨髓的间充质干细胞更多的向脂肪细胞和软骨细胞分化,而接种在刚度基质的骨髓的间充质干细胞有较强的肌性分化潜能,这种差别不依赖于化学和生物化学诱导剂。牵引力和刚度基质介导与整合素结合,直接作用于间充质干细胞谱系改变。相比于刚度,尽管细胞形状已经被证明可以影响细胞分化方向,但在文献中仍无法确定。
流体剪切力、静水压、周期性压力和其他外在的机械力学因素,也可以影响细胞的行为。振荡流体流动可以调节干细胞,灌注系统有促进间充质干细胞成骨的作用。静水压是一种不变形的机械性刺激,可以增加人类骨髓基质细胞软骨形成基因的表达,而对成骨基因无明显影响。它可以减少骨髓钙化和长期琼脂培养的髌下脂肪来源的间充质干细胞[20]。兔骨髓来源间充质干细胞受压是对软骨预形成非常强大的刺激。在无外源性生长因子刺激的间充质干细胞中,压力可以增加软骨形成基因的表达,提示单纯压力也可以诱导软骨形成。
总体来说,即使有一些初步证据,仍需要进一步的研究来清晰地解释间充质干细胞是如何对体内复杂的机械刺激感知和做出反应。
1.5 其他微环境因子 许多其他因子也涉及了间充质干细胞种群的维护和分化。例如,瘦素是一种维持能量平衡的脂联素,在小鼠骨髓间充质干细胞中至少表达一个亚群,在间充质干细胞成骨分化的外周调控中起着重要的作用。胎球蛋白A主要在肝脏合成,可以降低割腱大鼠发生异位骨化的可能[21]。Tuylu等[22]在钙化组织中发现了丰富的胎球蛋白A。这些数据提示,胎球蛋白A可能是强直性脊柱炎异位骨化过程中反馈回路的一部分。1,25-二羟维生素D(1,25-dihydroxyvitamin D,1,25-OHD)是维生素D最活跃的代谢产物,被认为是成骨细胞分化的活化剂,因为它协同肝细胞生长因子(hepatocyte growth factor,HGF),诱导h间充质干细胞分化。神经类表皮生长因子样蛋白1(neural epidermal growth factor like protein 1,NELL-1)对软骨细胞具有高度特异性,在体外通过调节Runt相关转录因子2(runt-related transcription factor 2,Runx2),诱导间充质干细胞向成骨细胞分化。在人体多能干细胞(Human pluripotent stem cells,hPSCs)中,Nell-1增加软骨细胞基因的表达,并在加快人类多能干细胞软骨细胞分化过程中大大增强TGF-β3和BMP-6的作用[23]。Nell-1已成为治疗骨质流失的一种可行治疗方法[24]。
抑制环氧化酶-2(cyclooxygenase,COX-2),会导致前列腺素E2(prostaglandin,PGE2)合成减少,从而抑制小鼠间充质干细胞软骨细胞分化。研究猜测改变n-3/n-6多不饱和脂肪酸的比例会减少PGE2的合成,预防异位骨化或作为异位骨化的替代治疗。缺氧诱导因子(hypoxia inducible factor,HIF-1α)是一种对低氧做出反应的主要调节因子,在小鼠骨髓间充质干细胞的成骨软骨分化中起关键作用。研究发现缺氧诱导因子可以抑制外伤造成的(烧伤/割伤)或遗传性的异位骨化。药理抑制剂缺氧诱导因子可以在不同的异位骨化模型中有效减少异位骨的形成[25]。Zhou等[26]还发现,HIF-1α联合BMP2可以增加间充质干细胞细胞系(C3H/10T1/2)的软骨细胞分化。这为软骨组织工程中增强维持软骨表型提供了一种方法。
2 靶向微环境对骨髓间充质干细胞作用
骨髓间充质干细胞功能增强会导致间充质组织异位生长,如异位骨化。临床上间充质干细胞病理性增殖和成骨分化常见于骨科创伤、烧伤、中枢神经系统的创伤、进行性骨化纤维发育不良及进行性骨发育异常。在病理条件下骨髓间充质干细胞诱导分化为成骨细胞的过程受到多条信号通路的调控,包括BMPs/Smad通路、Wnt通路、丝裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)通路和钙离子通路等。在BMPs/Smad通路,其中BMP-2具有促进间充质干细胞增殖及成骨分化的作用。研究发现[27],当骨形态发生蛋白mRNA表达量增加时,碱性磷酸酶、骨钙素、Smad及l型胶原(collagen I,Col-Ⅰ)等表达显著增高,骨髓间充质干细胞发生明显的成骨分化。BMPs有两种受体,当BMPs激活Ⅱ型受体后,I型受体磷酸化,随后激活下游Smad1/5/8蛋白。Smad1/5/8同受体结合在配体上,磷酸化后与smad4形成异二聚体,然后转入细胞核后结合到目标启动子序列,诱导成骨特异性转录因子Runx2等[28]。
Wnt通路是调节骨髓间充质干细胞自我更新和分化的关键途径。当Wnt通路被激活后,Wnt蛋白首先与细胞表面低密度脂蛋白相关受体蛋白(Low density lipoprotein related proteins 5/6,LRP 5/6)和卷曲蛋白复合物结合,促进β联蛋白聚合,激活T细胞因子、淋巴增强因子介导的基因表达。
MAPK通路是调控骨髓间充质干细胞成骨分化的重要途径之一。该通路中细胞外信号调节激酶(extracellular signal regulated kinase,ERK)、c-Jun氨基端激酶(c-Jun amino terminal kinase,JNK)和p38通路参与了骨髓间充质干细胞的成骨分化[29]。MAPK通路激活后,诱导转录因子Runx2磷酸化及转录因子Osterix表达,同时调控BMPs和纤维生成因子2,促使骨髓间充质干细胞分化为成骨细胞[30]。
钙通路是以钙离子为信号调节骨重建的关键通路。成骨细胞和破骨细胞表面有可以感受细胞内外钙离子浓度的变化的钙敏感受体。研究发现细胞外钙离子浓度升高时,可以提高成骨分化标志物水平,促进骨髓间充质干细胞向成骨细胞分化。
BMPs/Smad通路、Wnt通路、MAPK通路和钙离子通路等多种通路协同调节间充质干细胞的增殖和成骨分化,维持机体的骨的新陈代谢。有多种因素影响间充质干细胞的增殖和分化,基于目前的数据,可以得出这样的结论:并不是所有的微环境因素都是平等的,一些因素可以增加间充质干细胞向成骨细胞分化的能力,另一些可以促进间充质干细胞的自我更新,还有的可以同时发挥这两项作用;许多微环境因子的生化效应是依赖背景条件的。这些因素可能相互交叉,并形成一个最小的结构性的功能单位,从而调节间充质干细胞和下游分化的稳态。目前微环境因素在间充质干细胞分化中的作用大部分仍是未知的,许多备选微环境因素可能涉及到调节生理或病理生理中间充质干细胞功能,所以很难分析其中的相互作用关系。为了解决这个问题,将微环境因子作为一种局部功能性调节单位进行研究是比较有潜力的方法,它与干细胞最小结构单位的概念相似,可以协调间充质干细胞稳态和下游分化。

