促红素及其氨甲酰化衍生物对孕鼠血液流变学的影响*
马玉姗 刁敏 林雪梅 屈艺 李浩 柳慧
( 四川大学华西第二医院 1.麻醉科;2. 出生缺陷与相关妇儿疾病教育部重点实验室,四川 成都 610041;3. 四川大学华西医院麻醉科,四川 成都 610041)
促红细胞生成素(Erythropoietin, EPO)是一种多效性细胞因子,其主要活性是通过抑制骨髓中红系祖细胞的凋亡而达到促进红细胞生成的作用[1]。利用重组DNA技术人工合成的重组人促红细胞生成素(Recombiant Human Erythropoietin, rhEPO)已广泛用于临床治疗包括癌症[2]、早产[3]及慢性肾病[4]等多种原因引起的贫血。EPO除了具有造血活性外,还具有广泛的组织保护活性,尤其是对神经系统的保护作用引起了学者们的广泛关注。我们在前期研究中发现,在胎鼠宫内缺氧缺血模型中,EPO能够很好地通过胎盘和血脑屏障,对胎鼠宫内缺氧缺血性脑损伤产生保护作用[5-6]。然而EPO发挥组织保护作用的剂量(1000U/Kg )远远大于促进红细胞生成的剂量(50-100U/Kg )[7-9]。大剂量或长期使用EPO可造成对骨髓造血系统的过度刺激,从而导致红细胞增多症、高血压及血栓形成等不良反应[10]。尤其是妊娠期妇女血液处于高凝状态[11],EPO的使用不可避免地会导致围产期发生血栓性疾病的风险增加,这就限制了EPO在产科的进一步应用。
氨甲酰化促红细胞生成素 (Carbamylated Erythropoietin, CEPO) 是EPO的衍生物。在EPO中加入氰酸盐,将EPO中的赖氨酸残基变成高瓜氨酸残基,使其丧失促进红细胞生成的作用[10],却保留了组织保护作用。CEPO功能上的优势使其在组织保护方面具有取代EPO的趋势,并已进入二期临床研究阶段[12]。目前有关EPO作用于孕鼠的研究较少,罕见关于EPO或CEPO对孕鼠血液流变学影响的相关报道。本研究拟通过孕鼠腹腔给予大剂量EPO和CEPO,观察孕鼠红细胞生成及血液粘滞度相关指标的变化,明确EPO和CEPO对孕鼠血液流变学的影响,为将来应用于产科临床提供实验依据。
1 材料与方法
1.1 设备与材料 EPO(成都地奥集团),氰酸钾(Sigma 公司),硼酸钠(成都市科龙化工试剂厂),戊巴比妥钠,医用石蜡、中性树胶(上海懿洋),伊红(Merck),苏木精(Amresco),TO透明剂(上海源叶),超滤管(Millipore),透析袋(Viskase),真空采血管(美国 BD),静脉留置针(泰尔茂日本),XE-2100全自动血液分析仪,SA-6000全自动血液流变仪(北京赛科希德)
1.2 实验动物 育龄期无交配史SD大鼠购至成都达硕动物有限公司, 体重240~260g。孕鼠以繁殖颗粒饲料喂养,饲养条件为室温22℃,相对湿度85 %。
1.3 CEPO制备 根据Leist等[13]的方法制备CEPO。0.5mg(1mg/ml) EPO 与0.5ml 1mol/L 硼酸钠(PH 8.8)和81.11mg氰酸钾(KOCN 分子量81.11)混匀, 使KOCN最终浓度为1mol/L, 放入37℃恒温水浴仪,温浴23h后移至透析袋中, 夹紧袋口, 在1000ml Milli-Q water中4℃透析过夜。再放入1000ml 20 mmol/L 柠檬酸钠0.1 mol/L NaCl (PH 6.0)中4℃透析过夜。再置于0.02mol/L柠檬酸钠1000ml及0.1mol/L NaCl(pH6.0)中4℃过夜。获得的CEPO采用考马斯亮蓝G250法测定浓度。
1.4 确定妊娠 将发情期且既往无交配史的雌、雄SD大鼠按2:1比例合笼。从次日晨起用棉签作阴道涂片,在显微镜下查看分泌物中是否含有精子, 并检查笼中是否有阴道栓。如发现有其中一项即初步判断为受孕,并将当日定为受孕第1天, 提出单笼饲养至孕17天。记录每日体重增加情况,并作为是否怀孕的另一依据。如期间体重不随受孕天数增长,则排除受孕。
1.5 实验分组及方法 将15只孕17天SD大鼠随机分为生理盐水对照组(NS组)、EPO处理组( EPO组)及CEPO处理组(CEPO组),每组5只。各组分别经腹腔注射0.9%NS (1mL/次)、EPO(5000 U /Kg)及CEPO(50 μg/Kg),连续3天。其中,EPO及CEPO用0.9% NS稀释至1ml。给药未满4天的孕鼠如发生自然分娩,则不纳入实验。
1.6 检测指标 连续给药3天,于第4天将孕鼠用1%戊巴比妥钠(40mg/kg腹腔内注射)麻醉后经下腔静脉采血,检测红细胞生成相关指标:网织红细胞计数(Reticulocyte Count, RET#)、网织红细胞百分比(RET%)、红细胞计数(Red Blood Cell, RBC)及血红蛋白(Hemoglobin, HGB)等,以及血液流变学相关指标:低切变率1全血粘度、低切变率5全血粘度、中切变率50全血粘度及高切变率200全血粘度、红细胞聚集指数(Erythrocyte Aggregation Index, EAI)及红细胞压积(Hematocrit, HCT)。
1.7 统计学分析 采用SPSS18.0统计软件进行分析,计量数据以均数±标准误(Mean±SEM)表示,多组间比较使用单因素方差分析(ANOVA),若方差齐性,则两两比较使用LSD法;若方差不齐,则两两比较使用Dunnett's T3法。采用Pearson相关分析对计量数据进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 红细胞生成相关指标的比较
2.1.1 EPO导致孕鼠网织红细胞绝对值及百分比(RET#及RET%)升高,且主要引起幼稚RET比例的增加,提示EPO能刺激孕鼠骨髓的造血功能 EPO组的RET#及RET %均高于NS组及CEPO组(P<0.05),NS组及CEPO组组间比较无差异(P>0.05),见图1~2。

图1 CEPO (50 μg/Kg) 及EPO (5,000 U/Kg) 对 RET#的影响
Figure1EffectsofCEPO(50μg/Kg)andEPO(5000U/Kg)onRET#
注:与NS组,①P<0.05;与EPO组,②P<0.05
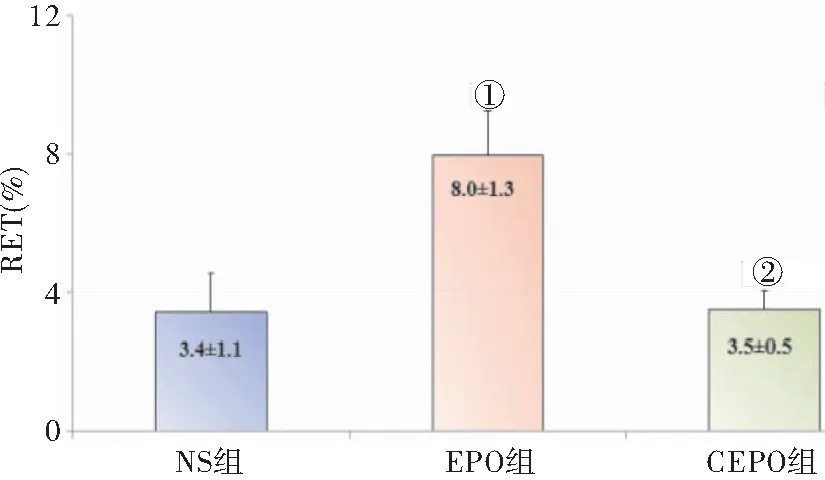
图2 CEPO (50 μg/Kg) 及EPO (5000 U/Kg) 对RET%的影响
Figure2EffectsofCEPO(50μg/Kg)andEPO(5000U/Kg)onRET%
注:与NS组,①P<0.05;与EPO组,②P<0.05
本研究的结果显示:MFR%各组间比较无明显差异(P>0.05);EPO组的IRF及HFR%均高于NS组及CEPO组(P<0.05),而LFR%低于NS组及CEPO组(P<0.05);CEPO组的IRF、LFR%、MFR%及HFR%与NS组比较均无明显差异(P>0.05),见图3。以上结果提示EPO 组幼稚RET增加,骨髓造血功能活跃。
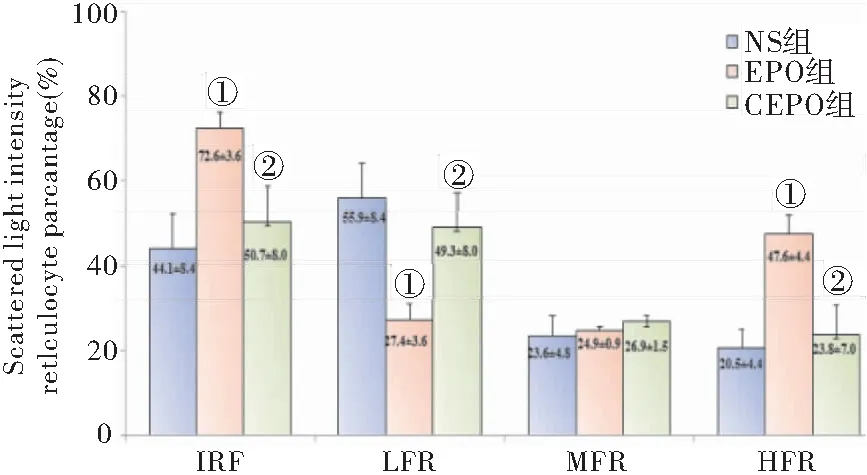
图3 CEPO (50 μg/Kg)及EPO (5000 U/Kg) 对RET分类的影响
Figure3EffectsofCEPO(50μg/Kg)andEPO(5000U/Kg)onRETclassification
注:与NS组,①P<0.05;与EPO组,②P<0.05
2.1.2 EPO导致孕鼠红细胞计数(RBC)及血红蛋白(HGB)升高 EPO组的RBC及HGB均高于NS组及CEPO组(P<0.05),NS组及CEPO组组间比较无明显差异(P>0.05),见图4、5。提示EPO组外周血中红细胞生成增加。
2.2 血液流变学相关指标比较显示:EPO导致全血粘滞度升高的风险增加
2.2.1 EPO导致孕鼠全血粘滞度增加 低切变率全血粘度能反映红细胞的聚集性。低切变率全血粘度越高,红细胞聚集性越高。EPO 组低切变率1(1/s)全血粘度、低切变率5(1/s)全血粘度及中切变率50(1/s)全血粘度均高于NS组及CEPO 组,差异具有统计学意义(P<0.05); NS组与CEPO 组比较差异均无统计学意义(P>0.05);各组间高切变率200(1/s)全血粘度比较差异无统计学意义(P>0.05),见图6。EPO组的红细胞聚集指数(EAI)高于NS组和CEPO组,但各组间比较差异无统计学意义(P>0.05),见图7。
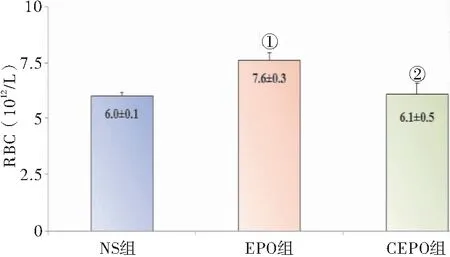
图4 CEPO (50 μg/Kg) 及EPO (5000 U/Kg) 对 RBC的影响
Figure4EffectsofCEPO(50μg/Kg)andEPO(5,000U/Kg)onRBC
注:与NS组,①P<0.05;与EPO组,②P<0.05

图5 CEPO (50 μg/Kg) 及EPO (5000 U/Kg) 对HGB的影响
Figure5EffectsofCEPO(50μg/Kg)andEPO(5000U/Kg)onHGB
注:与NS组,①P<0.05;与EPO组,②P<0.05

图6 CEPO (50 μg/Kg) 及EPO (5000 U/Kg) 对全血粘度的影响
Figure6EffectsofCEPO(50μg/Kg)andEPO(5000U/Kg)onbloodviscosity
注:与NS组,①P<0.05;与EPO组,②P<0.05
2.2.2 EPO导致红细胞压积(HCT)的增加 HCT是反映血液浓度的指标,在影响血液粘度的诸因素中,HCT对不同切变率下的全血粘度影响最大。EPO组的HCT高于NS组及CEPO组(P<0.05),其余各组间比较无差异(P>0.05),见图8。
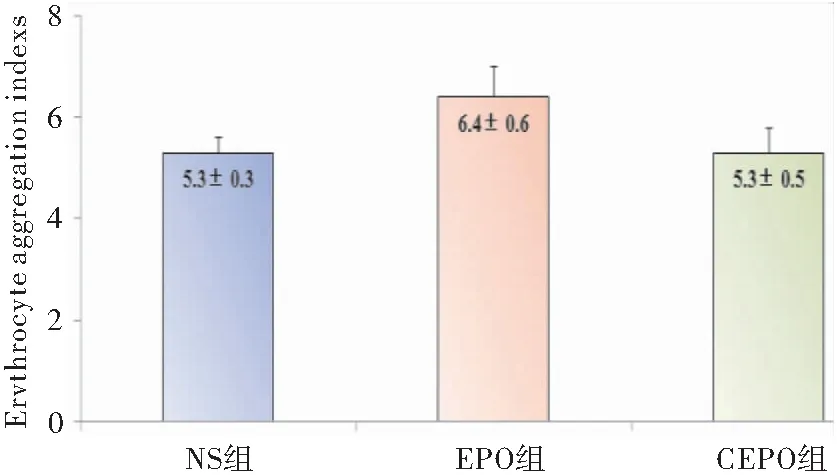
图7 CEPO (50 μg/Kg) 及EPO (5000 U/Kg) 对EAI的影响
Figure7EffectsofCEPO(50μg/Kg)andEPO(5000U/Kg)onErythrocyteAggregationIndex

图8 CEPO (50 μg/Kg)及EPO (5000 U/Kg) 对 HCT的影响Figure 8 Effects of CEPO (50 μg/Kg) and EPO (5000 U/Kg) on HCT注:与NS组,①P<0.05;与EPO组,②P<0.05
2.3 部分检测指标间相关性分析 红细胞压积(HCT)与RBC、HGB、RET # 呈正相关关系,即RBC、HGB、RET # 数值越多,HCT越高。切变率1(1/s)、5(1/s)全血粘度与红细胞聚集指数(EAI)成正相关,即切变率1(1/s)、5(1/s)全血粘度越高,EAI越高,见表1。
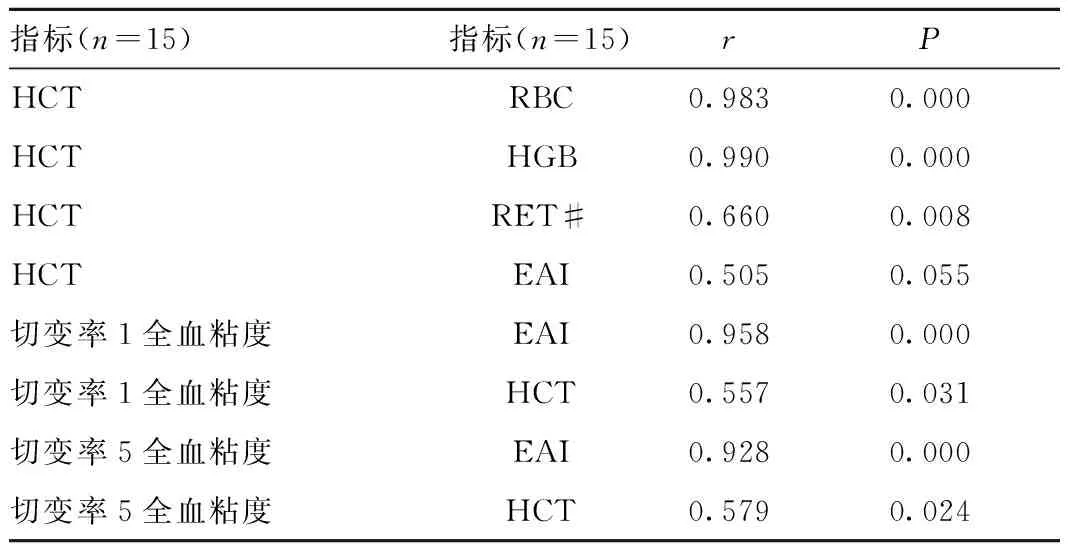
表1 参数相关分析Table1 Analysis of correlations among some parameters
3 讨论
网织红细胞根据RNA含量的多少分为低荧光网织红细胞(Low Fluorescence Reticulocyte, LFR,成熟网织红细胞)、中荧光网织红细胞(Middle Fluorescence Reticulocyte, MFR,中间网织红细胞)和高荧光网织红细胞(High Fluorescence Reticulocyte, HFR,未成熟网织红细胞)。荧光强度越高,提示网织红细胞含RNA越多,细胞也就越幼稚;反之,荧光强度越低,表示网织红细胞含RNA越少,细胞也就越成熟。因此,MFR和HFR比RET更早反映红细胞生成的开始。未成熟网织红细胞指数(Immature Reticulocyte Fraction, IRF )为MFR%与HFR%之和,反应了幼稚RET占总RET的百分比[14],能更早、更灵敏地反应骨髓造血功能的开始,是评价抗贫血药物疗效的敏感指标。
造血功能增加时,网织红细胞发生变化的顺序为MFR、HFR、IRF及RET#[15],其中HFR的增加反应了红细胞生成的开始,HFR对EPO功能而言比RET#更实用[16]。本研究说明EPO会刺激骨髓造血功能,使大量不成熟RET从骨髓释放到外周血中,导致HFR、IRF及RET的增高。有研究报道,给与小鼠连续3天皮下注射EPO后48小时会导致RBC增加,和我们的结果相似[17]。 多项研究表明HCT、RBC及HGB的增加是导致血栓发生的危险因素[18-21]。主要原因可能是红细胞增加与凝血功能的增加有关:血红蛋白过低的患者出血风险增加,但进行输血治疗后能纠正出血;血小板减少的病人即使不输血小板,只输入红细胞也会改善其凝血功能[22]。而凝血功能是血栓形成的三要素之一,凝血功能的增加会使血栓形成的风险增加。除了凝血功能改变外,血流改变是血栓形成的三要素中的另一重要因素。血液流变学的异常可能导致血液粘滞度增加,血流缓慢,血管阻力增加,血流淤滞容易使凝血物质聚集,导致血栓形成,是公认的血栓性疾病的预见性指标。
我们检测了全血粘度、EAI及HCT等血液流变学指标,发现给予EPO能导致血液低切变率1(1/s) 全血粘度、低切变率5(1/s) 全血粘度、中切变率50(1/s)全血粘度、EAI及HCT的增加,而CEPO则没有该作用。全血粘度反映了血液在流动过程中产生的流动摩擦力,主要影响因素有红细胞压积(HCT)、红细胞的流变性(包括红细胞聚集性和红细胞变形性)以及切变率,其中低切变率全血粘度主要反映红细胞聚集性,具有较大的意义。我们的结果显示红细胞聚集性增高和低切全血粘度增高呈正相关(r=0.958,P=0.000),说明低切变率下血流缓慢,血液粘滞度越高,红细胞越容易聚集。因此红细胞聚集性增高可能是导致低切变率下血液粘度增高的原因。
我们还发现注射EPO后会导致孕鼠HCT增加,而CEPO则没有该作用。在影响血液粘度的多个因素中,HCT对不同切变率下的全血粘度影响最大[23]。血液粘度随HCT的增加而增加,当HCT 在25.32%到60.16%之间时,HCT增加10.99%会导致血液粘滞度增加20%,根据泊箫叶公式,粘滞度增加20%会减缓血流16.67%。生理上为了代偿20%血液粘滞度增加,血压会增加20%,或血管半径会扩张4.66%,当冠心病患者血管扩张受限时,就会导致心肌缺血[24]。因此,EPO的药品说明书中的不良反应防范中明确指出,用药过程中需要监测HCT,当HCT高于40%,应停用,当下降到36%后,再继续给予EPO,以免血栓的发生。而我们的结果表明,注射CEPO不会导致孕鼠HCT增加,即不会增加孕鼠血液粘滞度,不会增加血栓形成的风险。
4 结论
本研究结果表明,与EPO相比, CEPO不会促进母鼠骨髓造血功能增加、红细胞生成,不会改变低切全血粘度及HCT等血液流变学指标,不会导致血液粘滞度的增加,具有更好的产科应用前景。

