外周血内皮祖细胞及血清AngⅡ、Ang1-7与血管性痴呆的相关性研究*
陆冰 刘洲 林智君 陈煜森 陈秋萍
(广东医科大学附属医院老年医学中心, 广东 湛江524001)
目前亚洲高龄人群中血管性痴呆(Vascular dementia,VaD)的发病率高于老年性痴呆(Alzheimer's disease, AD)居第一位[1],成为老年患者痴呆的首发原因[2]。研究表明,血管内皮损伤所引起的脑缺血性损害是VaD形成的重要因素之一[3-4];因此,血管内皮功能在VaD发病机制中的作用开始引起学者关注。内皮祖细胞(Endothelium progenitor cells, EPCs)是一种来源于骨髓的前体细胞,具有修复血管内皮的能力,EPCs不足以代偿血管内皮损伤及修复之间的失衡可致血管内皮功能失调[5]。本研究通过观察VaD患者与同龄认知功能正常人群外周血EPCs数目的差异及比较血管内皮功能指标:血清血管紧张素(AngⅡ)及血管紧张素1-7(Ang1-7)的水平,为VaD的临床防治提供依据。
1 对象与方法
1.1 一般资料 选取2015年~2017年于广东医科大学附属医院就诊的患者100例。采用国际神经科学研究会诊断标准和国内学者对VaD的诊断共识,将受试者分为两组:VaD组(55例),认知正常组(45例)。患者自愿配合,取得医学伦理委员会同意。VaD组纳入标准:①有明确脑血管病史(经过核磁影像检查和诊断确认),发病3个月后逐渐出现认知功能障碍,此前无认知障碍史;②Hachinski缺血指数大于7分;③目前脑血管病稳定,3个月内无新发卒中事件(头颅CT/MRI证实)。受试者排除标准:①入组前3个月内新发脑卒中、外伤、颅脑手术;②脑血管病以外的因素所致的认知功能障碍;③意识障碍、严重的视听力障碍、失语及不能配合进行神经心理测试的患者;④患有严重器质性疾病;⑤服用其它可能影响认知功能的药物;⑥目前服用影响EPCs水平的药物(如他汀类、胆碱酯酶抑制剂等)
1.2 临床资料 详细获取患者病史、年龄、文化程度、体重指数(BMI)、血压、血脂、空腹血糖、颈动脉内膜厚度(IMT)等基本信息。采用全自动生化分析仪测定生化指标;采用颈动脉彩色多普勒超声测定受试者双侧IMT,取平均值进行分析。
1.3 认知功能评定 应用简易智能精神量表(MMSE)评定所有受试者的认知功能,MMSE最高得分为30分。认知障碍的判断根据文化程度分为:文盲≤17分,初中<21分,高中<22分,大学≤23分。
1.4 流式细胞仪检测外周血EPCs水平 受试者清晨空腹2ml静脉血,置于EDTA管抗凝分离单个核细胞,加入膜抗体CD34+、CD133+单克隆抗体,以同型抗体作为对照,室温避光放置5min。应用流式细胞仪设定单个核细胞门来检测外周血EPCs水平。
1.5 ELIAS检测血清AngⅡ、Ang1-7水平 静脉血离心后取血浆,采用ELISA试剂盒检查,酶标仪在波长450mm处测定各样本的吸光度值,检测血清中AngⅡ及Ang1-7的水平。
2 结果
2.1 两组临床资料比较 两组受试者的年龄、性别、文化程度、BMI、血压、血脂、空腹血糖、IMT比较差异均无统计学意义(P>0.05)。VaD组MMSE评分低于认知正常组,两组间差异有统计学意义(P<0.05),见表1。

表1 两组临床基线资料的比较Table 1 Comparison of baseline clinical data between the two groups
注:与认知正常组比较,①P<0.05;TC:总胆固醇;LDL-C:低密度脂蛋白;TG:甘油三指;HDL-C:高密度脂蛋白;FPG:空腹血糖
2.2 两组外周血EPCs水平及血管紧张素水平的比较 通过流式细胞仪标记,根据表面标记为CD34+/CD133+的细胞来确认EPCs数目(图1)。VaD组外周血EPCs数目明显低于认知正常组(P<0.05);VaD患者血清AngⅡ水平较认知正常组增加,Ang1-7水平较认知正常组减少,差异有统计学意义(P<0.05),见表2。
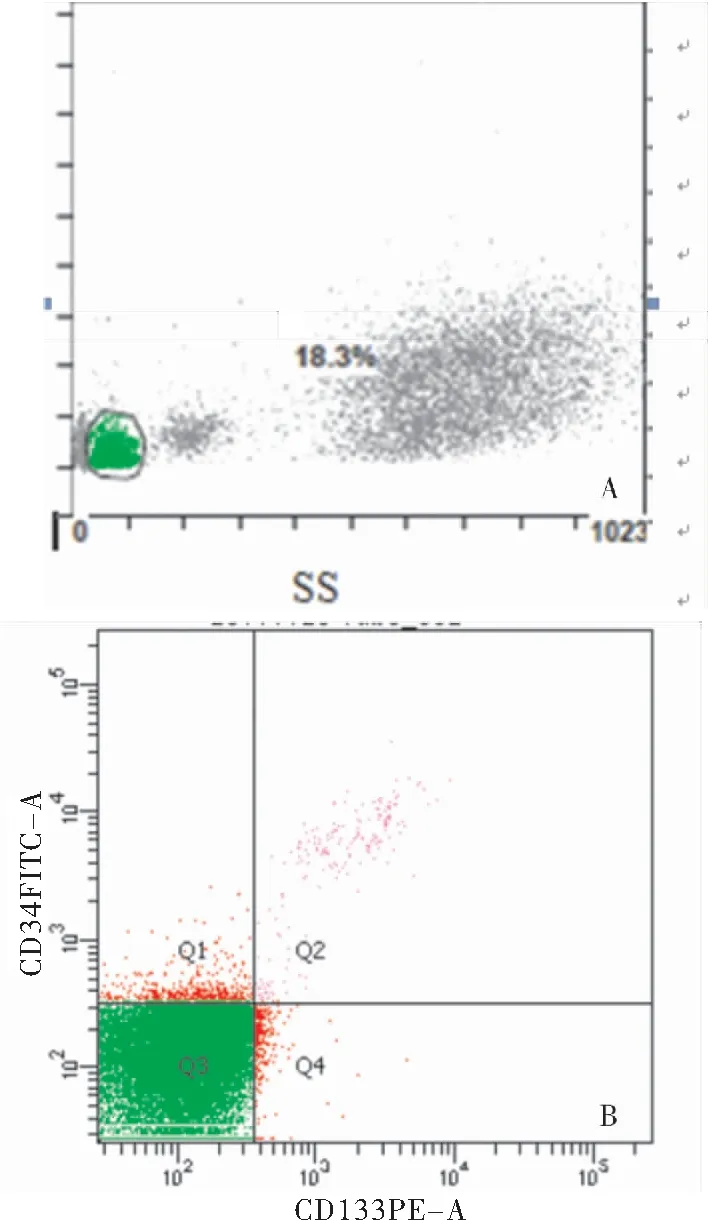
图1 流式细胞仪标定测定外周循环EPCs水平
Figure1CirculatingEPCscontentsweredeterminedbyflowcytometry
注:A.绿色画圈对淋巴细胞群设窗;B.Q2区域代表CD133+/CD34+双阳性细胞

Table2ComparisonofEPCsnumbersandangiotensinlevelsbetweenthetwogroups
注:与认知正常组比较,①P<0.05
2.3 VaD组外周血EPCs数目与血管紧张素水平的相关性分析 VaD组外周血EPCs数目与血清AngⅡ含量呈负相关(r=-0.44,P<0.05);与血清Ang1-7含量呈正相关(r=0.51,P<0.05)。
2.4 VaD组MMSE评分与外周血EPCs数目、血管紧张素水平的相关性分析 VaD组MMSE评分与外周血EPCs数目呈正相关(r=0.679,P=0.000)。排除年龄、性别、体重指数、血压、血糖、血脂、IMT的影响后,此关系仍存在(r=0.545,P=0.000);VaD组MMSE评分与血清Ang1-7水平呈正相关(r=0.461,P=0.007);与血清AngⅡ水平呈负相关(r=-0.359,P=0.004),见表3。
表3VaD组MMSE评分与循环EPCs数目及血管紧张素水平的相关性分析
Table3CorrelationanalysisbetweenMMSEscoreandthenumbersofcirculatingEPCs,angiotensinlevelsinVaDgroup

变量rPEPCs0.5450.000Ang1-70.4610.007 AngII-0.3590.004
3 讨论
近年来,VaD发病机制的研究仅集中在神经元方面,对缺血区域脑灌注及血管内皮的关注甚少。低灌注状态下的脑细胞氧代谢受到抑制,继而使主导认知的脑组织内部环路传递中断是VaD重要的病理机制[6]。如何有效修复血管内皮为缺血区域提供良好的微循环是VaD认知功能得以改善的基础及关键。EPCs是血管内皮细胞的前体细胞,在组织缺血的刺激下,骨髓源性EPCs被大量动员归巢至缺血区域,通过修复损伤的血管内皮[7]及血管新生[8],建立侧支循环,以改善缺血局部血流灌注[9]。缺血是EPCs动员的一个明确的刺激因素,EPCs作为一种血管保护机制为缺血区域的血供提高有利环境[10]。动员外周血EPCs是改善VaD缺血损伤区域血流灌注及修复神经功能的重要环节,对主导学习记忆的海马区域的意义重大。目前已有研究表明,EPCs-血管新生机制在改善大鼠局灶性缺血再灌注后认知功能障碍中发挥积极作用[11]。本研究显示,VaD患者外周血EPCs数目较认知正常组明显减少,且与MMSE评分呈正相关。推测外周血EPCs参与脑卒中后认知功能障碍的发生及进展,外周血EPCs的减少可能在VaD发病及发展中起着重要的作用。
目前已证实肾素-血管紧张素系统(RAS)广泛分布于与认知功能密切联系的区域,参与调节与认知相关的复杂功能,如感觉信息、学习记忆等。因此,RAS成为目前研究卒中后痴呆的候选因素之一。中枢AngⅡ可以抑制皮质中乙酰胆碱的释放,影响脑高级神经功能[12]。AngⅡ的受体AT1R不仅存在于脑组织,还分布于血管内皮细胞[13],参与体内神经炎症反应及氧化应激[14-15]。脑缺血病理状态下,脑细胞氧化-还原稳态失衡所引起的氧化应激是循环及脑内的RAS过度激活的重要机制[16],可引起AngⅡ显著增加;AngⅡ作为RAS的重要效应因子,是RAS直接作用于血管床使血管收缩的血管活性肽。此外,高水平AngⅡ还可以通过抗衡凋亡调控因子Bcl-2的活性,诱导神经细胞的凋亡,产生认知功能障碍。因此,有必要探讨卒中后痴呆与血清中AngⅡ水平的相关性。本研究发现,VaD患者血清AngⅡ水平较认知正常组显著增高,且与MMSE评分呈负相关。可见,血清AngⅡ参与了卒中后认知功能障碍的发生,其表达水平与VaD的病情发展密切相关。AngⅡ通过抑制内皮细胞释放一氧化氮(NO)及血管活性物质的表达[17],促进EPCs的衰老及减少EPCs向外周迁移,降低外周血中EPCs的数目,从而削弱EPCs的内皮修复能力[18]。本研究显示,VaD患者循环血EPCs数目与血清AngⅡ水平呈负相关。可见,血清AngⅡ水平可直接影响着EPCs向外周血的动员。然而,脑缺血后机体内AngⅡ对EPCs动员的影响及对认知功能的作用机制仍需进一步研究。
ACE2-Ang1-7-mas是RAS系统另一个重要分支,Ang1-7是AngⅡ生物学效应的内源性据抗因子。Ang1-7既可抗衡AngⅡ介导的血管内皮细胞钙超载而扩张血管,也可以直接作用于内皮细胞促进NO的释放,通过NO内皮依赖机制产生舒血管作用改善脑血流量[19]。Ang1-7不仅通过增强内皮细胞在缺氧后氧化应激损伤过程中的抗氧化能力而发挥血管内皮保护作用[20],还可通过释放的NO介导多种信号转导途径为促进EPCs的动员及血管内皮的修复提高有利的环境。由此可见,RAS成分主要通过调节脑灌注量而影响VaD的发病过程。本研究结果显示,VaD的发病与Ang1-7表达有关,低水平Ang1-7的舒血管效应受抑制,脑灌注得不到充足改善而引起认知功能障碍。本研究显示,VaD患者血清Ang1-7水平与MMSE评分呈正相关,提示了血清Ang1-7参与着认知功能的调节,其表达水平与VaD的病情密切相关。慢性脑缺血的病理状态下所引起的氧化应激可破坏EPCs正常结构及功能活性,导致血管内皮不可逆性损伤。我们试验发现,VaD患者EPCs数目与血清Ang1-7表达水平呈正相关,推测脑缺血后EPCs动员的调节可能与Ang1-7保护血管内皮的作用机制有关。后续工作我们将针对EPCs及RAS对认知功能的作用通路进一步的设计和研究,更好地了解VaD发病机制,为VaD的防治提供新思路。
4 结论
本研究结果显示,VaD患者的认知功能与外周血EPCs数目及血清AngII、Ang1-7水平存在一定的相关性。

