丹参注射液对哮喘大鼠气道重塑及肺泡灌洗液中TGF-β1的影响*
魏海龙 李秀珍 鲍春英 李利琼 刘涛
(1.乐山市人民医院呼吸内科, 四川 乐山614000;2.贵州医科大学附属医院呼吸内科, 贵州 贵阳 550004;3.沈阳积水潭医院呼吸内科, 辽宁 沈阳110016;4.延安大学医学院药理学教研室, 陕西 延安 716000)
1 实验与方法
1.1 实验材料
1.1.1 实验动物 健康清洁级SD大鼠24只,体重160~200g,雌雄各半,由贵州医科大学实验动物繁育中心提供。
1.1.2 主要试剂和器材 卵清白蛋白(美国Sigma公司,进口分装,GradeII);氢氧化铝干粉(贵阳医学院免疫教研室提供);大鼠TGF-β1成套定量ELISA试剂盒(大连泛邦生物工程公司,产品编号:DR803647);丹参注射液(江苏安格药业有限公司生产,生药含量1.5g/ml);吸附百日咳、白喉、破伤风联合疫苗(由贵州省疾病防治控制中心提供,产品批号:2004.06.09-2);Elx-800型酶标仪(美国Bio-TEK生产);402型超声雾化器(上海合力医疗器械厂生产);光学显微镜附照相系统由Olympus公司生产;图像采集软件为Motic Images Advanced 3.2。
1.1.3 用药剂量 参照中华人民共和国药典规定人用剂量,按照实验动物与人体表面积比等效剂量换算比率表中体表折算系数(人与大鼠用量的折算系数是56)进行换算后选择剂量[5]。
1.2 实验方法
1.2.1 大鼠支气管哮喘气道重塑模型的建立 参照文献[6]方法,第1、8天以10%OVA 1ml、氢氧化铝干粉100mg、百白破疫苗1ml腹腔注射致敏,第14天将大鼠置于自制的透明密闭雾化箱内(60cm×40cm×30cm)给予1%的OVA(OVA300mg+NS30ml)30ml雾化吸入激发, 中等雾量,每次约30min, 每天激发1次,直至大鼠出现明显呼吸加深加快,口唇发绀,腹肌痉挛,点头呼吸,站立不稳等哮喘样发作,共4周。
对照组57.14%的依从性,较比观察组90.48%,偏低些;对照组85.71%的副反应发生率,较比观察组52.38%,偏高些,组间比较,差异有统计学意义(P<0.05)。见表1。
1.2.2 实验分组 24只大鼠购回后饲养3天以适应环境。随机分成3组:空白对照组(简称空白组)以生理盐水代替OVA腹腔注射(2ml)及雾化吸入(30min)。哮喘组第1、8天每只大鼠以10%OVA 1ml、氢氧化铝干粉100mg、百白破疫苗1ml腹腔注射致敏,2周后给予1%的OVA溶液30ml雾化吸入激发,激发前1h腹腔注射生理盐水2ml。丹参注射液干预组(简称干预组)于每次激发前1h腹腔注射丹参注射液10ml/(kg.d),相当于生药15g,其余均同哮喘组。以上动物均于末次激发后24h内处死、取材并作相应测定。
1.2.3 支气管肺泡灌洗液(BALF)中炎性细胞总数及分类计数 大鼠末次激发后股动脉放血处死并开胸,分离气管,夹闭右主支气管,剥离左肺,用生理盐水灌洗左肺,每次3.0ml,重复4次,回收BALF,回收率为70%以上。取灌洗液约50μl置于细胞计数板上作细胞总数计数。其余以3000r/min,离心10min,将上清液收集于无菌离心管中,置于-70℃冻存,待测TGF-β1。将离心沉渣涂片,行Wright-Giemsa染色,在油镜下进行嗜酸粒细胞、中性粒细胞、巨噬细胞、淋巴细胞分类计数[7]。
1.2.4 BALF中TGF-β1浓度测定 用ELISA法测定BALF中TGF-β1的表达浓度,严格按试剂盒操作说明进行。在450nm 波长读取光密度值,计算TGF-β1浓度。
1.2.5 肺组织病理组织学染色 取各组大鼠右肺中叶,经10%福尔马林液固定48小时后,于右肺中叶矢状面最大局径处横贯取材,组织厚约3mm,常规酒精脱水、石蜡包埋。将石蜡块切成4μm厚切片,行HE染色,以备病理学观察。
1.2.6 肺组织病理学观察及病理学计分 光镜下双盲法观察各组大鼠肺组织病理切片,参照文献[8]的方法,将支气管粘膜水肿、变性、坏死脱落、上皮增生等多项指标进行病理学观察并评分,具体方法如下:以“0、2、4、6分”分别表示光镜下“-、+、++、+++”对每个视野观察到的肺组织进行评分,将所有分值相加即为该项得分。
1.2.7 气道重塑指标分析 参照文献[9]关于气道各层的定义,采用计算机图像分析软件,在显微镜下(放大100~400倍)找到最长直径<200μm尽量完整的气管横断面(最小直径/最大直径>0.5,否则认为是斜切), 测量以下参数:支气管基底膜周径(Pbm),在小气道,基底膜为穿过黏液腺的光滑连线,基底膜周径内面积即为基底膜周径下面积(Abm);外膜周径(Po),外膜为气道与肺泡相连的边界,若气道外膜毗邻血管,则外膜定义为血管内膜与气道上皮连线的中点,外膜内面积即是外膜周径下面积(Ao);平滑肌外周径(Pmo),若平滑肌不连续,则用光滑连线连接两侧平滑肌的内壁及外壁, 平滑肌外周径所围成的面积即是平滑肌外周径下面积(Amo);平滑肌内周径(Pmi),其围成了平滑肌内周径下面积(Ami)。
将以上参数在测量值上进行计算:总管壁面积(WAt=Ao-Abm),气道内壁面积(WAi=Amo-Abm),气道平滑肌面积(WAm=Amo-Ami),结果均用基底膜周径(Pbm)进行标化[10],分别用WAt/Pbm ,WAi/Pbm ,WAm/Pbm表示。
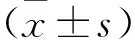
2 结果
2.1 各组BALF中炎性细胞总数及分类计数比较 哮喘组BALF中炎性细胞总数(Tot),巨噬细胞(Mon),嗜酸细胞(Eos),淋巴细胞,(Lym),嗜中性粒细胞(Neu)数均较空白组显著升高,其中嗜酸性粒细胞增高最明显(P<0.01)。干预组炎性细胞总数及细胞分类计数较哮喘组明显下降(P<0.01),但仍高于空白组(P<0.05),见表1。

表1 各组大鼠BALF中白细胞数及分类计数变化Table 1 Total white blood cell number and cellular composition in BALF
注:与空白组比较,①P<0.01,②P<0.05;与哮喘组比较,②P<0.01
2.2 各组大鼠BALF中TGF-β1的表达比较 空白组大鼠BALF中有微量TGF-β1表达,哮喘组BALF中TGF-β1表达浓度与空白组比较明显增高,差异有显著统计学意义(P<0.01) ;干预组BALF中TGF-β1浓度较哮喘组明显下降(P<0.01), 但仍高于空白组(P<0.05),见表2。

表2 BALF中TGF-β1浓度Table 2 Comparison of TGF-β1content in BALF
注:与空白组比较,①P<0.01,②P<0.05;与干预组,①P<0.01;
2.3 肺组织病理组织学变化及气道重塑指标分析结果
2.3.1 肺组织病理组织学改变
2.3.1.1 空白组 空白对照组支气管黏膜上皮完整、无纤毛变性、坏死、脱落,黏膜肌层无增厚,支气管管腔规整,管壁及周围仅有极少量炎性细胞浸润,见图1。
2.3.1.2 哮喘组 哮喘组支气管黏膜可见部分上皮变性、坏死、脱落,平滑肌层增厚,平滑肌收缩使管腔狭窄、皱褶明显,细支气管和小血管的管壁增厚,其周围可见大量嗜酸性粒细胞,淋巴细胞及少量中性粒细胞浸润,见图2。
2.3.1.3 干预组 干预组大鼠支气管炎症明显减轻,支气管黏膜上皮基本完整,气道平滑肌层增厚不明显,支气管腔明显增大,光整,气管壁、肺泡隔及肺泡腔炎性细胞浸润显著减少,见图3。

图1空白对照组
Figure1Controlgroup
注:A.肺泡组织结构正常,肺泡腔可见个别炎性细胞浸润,支气管壁及周围有极少量炎性细胞渗出(HE×100); B.支气管管腔规整,无黏膜上皮变性、坏死、脱落,支气管平滑肌层未见明显增厚,管壁周围及肺泡腔可见极少量炎性细胞浸润(HE×400); C.细支气管管壁光滑、规整,未见黏膜上皮变性、坏死、脱落及炎性细胞浸润(HE×1000)

图2 哮喘组Figure 2 Asthmatic group
注:A.肺组织结构轻度破坏,支气管上皮变性、坏死、脱落明显, 肺泡腔及支气管周围可见大量炎性细胞浸润(HE×100);B.细支气管可见部分黏膜上皮变性、坏死、脱落;管壁周围,肺泡腔及肺泡间隔见大量炎性细胞浸润(HE×400);C.大支气管可见平滑肌细胞肥大、增生,平滑肌层 显著增厚,管壁及周围炎性细胞浸润明显(HE×400); D.细支气管黏膜变性、坏死、脱落明显,管壁及管腔周围可见巨嗜细胞,淋巴细胞等炎性细胞浸润(HE×1000)

图3 干预组Figure 3 Treatment group
注:A.肺泡组织结构基本正常,肺泡腔清晰,肺泡间隔轻度水肿、增厚,间隔及细支气管周围可见少量炎性细胞渗出(HE×100); B.细支气管黏膜上皮基本完好,管腔规整,管壁周围有少量炎性细胞浸润(HE×400); C.较大支气管仅见少量炎性细胞浸润,未见气道平滑肌层增厚(HE×400); D. 支气管管壁光滑,未见明显粘膜上皮变性、坏死、脱落(HE×1000)
2.3.2 肺组织病理形态学积分 肺组织病理形态学积分比较,见表3~表4。

表3 各组大鼠气道病理形态学积分比较(分,Table 3 Comparision of rat lungs pathological scores among every group
注:与空白组比较①P<0.01,②P<0.05;与哮喘组比较,②P<0.01
2.3.3 气道重塑指标结果 哮喘组大鼠支气管总管壁面积(WAt/Pbm)、内壁面积(WAi/Pbm)、平滑肌面积(WAm/ Pbm)与空白组比较均明显增厚(P<0.01);干预组WAt 、WAi 、WAm较哮喘组显著减少(P<0.01),见表5。
2.4 相关性分析
2.4.1 嗜酸性粒细胞数与BALF中TGF-β1浓度的相关性分析 哮喘组大鼠BALF中TGF-β1浓度与Eos数呈正相关(r=0.85,P<0.01),见图4。
表4各组大鼠肺组织病理学改变(n=8)
Table4Comparisionofratlungsmorphologicalparametersamongeverygroup

组别病理形态改变n-++++++空白组支气管黏膜变性88000支气管黏膜脱落88000管腔内渗出86200哮喘组支气管黏膜高精尖性80350支气管黏膜脱落80440管腔内渗出82420干预组支气管黏膜变性85300支气管黏膜脱落87100管腔内渗出82510
表5各组大鼠气道总管壁面积、内壁面积及平滑肌面积厚度比较(μm2/μm)
Table5ComparisionofWAt/Pbm,WAi/PbmandWAm/Pbmamongeverygroup

组别nWAt/PbmWAi/PbmWAm/ Pbm空白组819.3±1.815.5±1.92.8±0.9哮喘组827.5±2①24.4±2.1①5.8±1.5①干预组822.6±1.6②18.8±1.4②3.8±1.5②
注:与空白组比较,①P<0.01,②P<0.05;与哮喘组比较,③P<0.01

图4 哮喘组大鼠职Eos与TGF-β表达相关关系Figure 4 The relationship between the expression of Eos and TGF-β1
2.4.2 BALF中TGF-β1浓度与气道平滑肌面积的相关性分析 哮喘组大鼠BALF中TGF-β1表达浓度与气道平滑肌面积呈正相关(r=0.81,P<0.01),见图5。
3 讨论
本研究采用卵白蛋白腹腔致敏,腹腔注射免疫佐剂氢氧化铝和白百破疫苗,2周后雾化吸入卵白蛋白进行激发的方法复制哮喘大鼠气道重塑模型,模型制作时间为4周。哮喘组实验动物有明显口唇发绀、腹肌痉挛、点头呼吸、站立不稳等表现,其BALF中炎性

图5 哮喘组大鼠BALF中TGF-β1表达与气道平滑肌面积相关关系
Figure5TherelationshipbetweentheexpressionofTGF-β1andWam/Pbm
细胞总数、EOS、嗜中性粒细胞数明显升高;病理切片中气道内可见大量炎性细胞浸润,杯状细胞增生,气道平滑肌(ASMC)肥大增生等改变,即气道重塑,这些改变与文献报道相一致[11-12],表明本实验哮喘气道重塑模型复制成功。
尽管目前哮喘气道重塑的机制尚未明确,但近年大量研究表明气道重塑是气道炎症产生气道壁损伤后,在多种生长因子、细胞因子、炎症介质的参与下出现的不完全或过度修复。其中TGF-β1在修复过程中发挥了重要作用,也被认为是促纤维化的关键因子,其促进气道平滑肌细胞和杯状细胞肥大增生,增加胶原和纤连蛋白合成并促进气道胶原沉积和基底膜增厚,促进结缔组织蛋白合成,从而导致气管腔狭窄、气道重塑的形成和不可逆的肺功能改变[13-14]。因此,抑制TGF-β1的表达可减轻哮喘气道重塑[15]。
在过敏性哮喘患者BALF中TGF-β1水平明显升高。Minshall等[16]也通过实验证明嗜酸性粒细胞分泌的TGF-β1mRNA能转录成有生物活性的蛋白质,而且嗜酸性粒细胞是TGF-β1的主要分泌细胞。有研究表明能表达TGF-β1mRNA的细胞65%为有活性的嗜酸性粒细胞,所以可以通过减少嗜酸性粒细胞的募集而间接减少TGF-β1mRNA在肺内的生成[17]。在我们的实验中正常组大鼠模型BALF 中TGF-β1微量表达;哮喘组大鼠BALF中TGF-β1浓度明显升高且与嗜酸性粒细胞数呈正相关(r=0.85,P<0.01);丹参注射液干预组大鼠BALF 中嗜酸性粒细胞数、TGF-β1浓度均较哮喘组明显下降(P<0.05),亦提示丹参注射液可通过降低哮喘大鼠嗜酸性粒细胞数从而使TGF-β1的浓度明显下降。
对气道的舒张与收缩状态进行研究发现,气道在不同收缩程度下基底膜周径(Pbm)保持不变。因此,我们利用这一特点就可以对不同个体及不同部位来源的支气管进行比较以消除由于气道处于不同收缩程度对测量结果的影响。本实验中,丹参注射液干预组大鼠支气管总管壁面积(WAt),内壁面积(WAi)及平滑肌面积(WAm),用Pbm将测量值标化后,增加值远不如哮喘模型组明显,提示丹参注射液早期干预可部分抑制实验哮喘大鼠气道重塑改变。丹参具有降低毛细血管通透性、改善微循环、抗氧自由基等作用[18]。近年来随着临床应用的深入发现,其对呼吸系统疾病也有良好的疗效。丹参注射液中的有效成份主要是丹参的水溶性物质。经体内外实验证明,水溶性丹酚酸类物质是天然有效的抗氧化剂,有的甚至优于超氧化物歧化酶(SOD),其中以含量最高的丹酚酸A和丹酚酸B的活性最强,对脂质过氧化引起的生物膜损伤有明显的保护作用[19-20]。本实验中丹参注射液干预组大鼠BALF中炎性细胞总数、巨噬细胞(Mon) 、嗜酸性粒细胞(Eos) 、淋巴细胞,(Lym) 、嗜中性粒细胞(Neu)数及TGF-β1表达浓度均较哮喘组明显下降 (P<0.01),也提示丹参注射液可以显著抑制哮喘大鼠气道炎症和气道重塑的发生。因此,丹参注射液与其他抗炎治疗手段的联合干预有望成为今后抑制哮喘气道炎症与气道重塑的有效治疗手段,对于丹参注射液能否逆转已经形成的气道重塑尚有待于进一步深入研究。
4 结论
本实验证明,哮喘早期给予丹参注射液干预能明显减轻气道炎性细胞浸润,抑制杯状细胞增生,ASMC增生肥大,从而预防气道重塑产生,推测丹参注射液对气道炎症及气道重塑抑制作用的部分机制是通过抑制EOS的产生及激活,从而减少TGF-β1的表达而发挥作用的。

