灯盏花素对低氧诱导的大鼠肺泡炎症及细胞外基质沉积的作用*
张旭 魏华华 谢敏 王永生
(1.成都市第一人民医院呼吸内科,四川 成都610041;2.成都市第三人民医院呼吸内科,四川 成都610031;3.四川大学华西医院呼吸与危重症医学科,四川 成都610041)
氧气是机体生长发育过程中不可或缺的因子,在物质代谢、能量转化及机体内环境稳定方面起着重要作用;氧气浓度可严重影响组织细胞增殖、分化及功能维持。大量研究表明,低氧可以诱导肺泡上皮损伤[1-2],肺泡炎症反应[3],促进肺成纤维细胞增殖[4]及向肌成纤维细胞转化[5],并通过诱导低氧诱导因子-1α(HIF-1α)[6-7]、转化生长因子-β1(TGF-β1)[8-9]、结缔组织生长因子(CTGF)[10]等致纤维化因子的表达量增高,促进细胞外基质的合成及沉积[11],甚至肺间质纤维化的形成[8,12-13]。灯盏花素具有舒张血管、抗凝、抗炎、降脂、清除氧自由基等作用,并可减轻博莱霉素诱导的肺纤维化[14]。本实验主要观察间断性低氧对大鼠肺泡结构的影响及灯盏花素对其干预作用。
1 材料与方法
1.1 材料 健康雄性SPF级SD大鼠80只,体重200~250g,由湖南斯莱克景达实验动物有限公司提供。兔抗大鼠TGF-β1及兔抗大鼠Ⅰ型胶原多克隆抗体购于美国 Santa Cruz,兔抗大鼠Smad4(CST公司),羊抗兔β-actin抗体(北京博奥森),发光显迹液(美国Milipore),鼠TNF-a Elisa试剂盒(深圳达科为),TaKaRa RNA RT-PCR试剂盒(宝生物有限公司),引物设计合成(Invitrogen公司)。
1.2 方法
1.2.1 动物分组及标本采集 采用随机数字表法将SD大鼠80只平均分为对照组:清洁环境中常规饲养,未予任何处理;单纯低氧组:每天置于低压氧舱8h,用氮气维持氧舱内压力为101kPa,O2浓度为10%,其余时间饲养环境同对照组;低氧+低剂量灯盏花素组:每天低氧处理前半小时按10mg/kg腹腔注射灯盏花素,余处理同单纯低氧组;低氧+高剂量灯盏花素组:每天低氧处理前半小时按40mg/kg腹腔注射灯盏花素,余处理同单纯低氧组。分别于第3、7、14、21d,每组随机抽取5只大鼠,予3 % 戊巴比妥钠(50/mg/kg)腹腔注射麻醉后,股动脉放血处死,解剖分离主支气管及双肺,止血钳夹闭右侧支气管,向左肺注入4℃预冷生理盐水1ml,后缓慢回抽,共行三次,回收率约90%,后于4℃,3000r/min离心5min后取上清,取右肺中叶固定于10%的中性甲醛48h后石蜡包埋,并行HE及免疫组化染色,剩余双肺肺叶均投入液氮迅速冻存,后将肺泡灌洗液(BALF)上清液及肺组织标本均保存于-80℃冰箱。
1.2.2 免疫组化法(SABC法)检测肺组织中TGF-β1、I型胶原的表达 将肺组织标本常规脱蜡、水化、阻断内源性过氧化物酶;抗原修复;5% BSA封闭; 一抗 (兔抗大鼠TGF-β1多克隆抗体1∶300;兔抗大鼠 I 型胶原多克隆抗体1∶150;二抗:试剂 SABC;DAB显色;常规苏木素复染、盐酸酒精分化、返蓝、脱水、透明、封片。免疫组化染色结果采用电脑图像采图软件 NIKON& Spot 彩色病理图文分析系统进行图像采集, 以图文分析软件Image-Pro plus 5.0(美国)分析肺组织免疫组化图像, 将肺组织各时点切片每张随机取染色区域 5个高倍视野(×400) , 测量并记录每个视野阳性染色的平均积分光密度值(IOD值)。
1.2.3 Western blot 法检测肺组织中通道蛋白Smad4的表达 取适量右肺组织于液氮中研磨成粉后收集于1.5 ml EP管中,加入1ml含有蛋白酶抑制剂的细胞裂解液,振动器充分混匀静置30min后超声破碎组织,4℃,12000r/min离心30min,提取上清液BCA法测蛋白浓度。加上样缓冲液并于沸水中煮10min,后以120g/L SDS-聚丙烯酰胺凝胶电泳,半干法电转膜至PVDF膜,10% BSA封闭2h,加一抗(1:800)4℃过夜,TBST洗膜5min/次×3次,加二抗(1:10000)室温放置2h,再洗膜三次,加入ECL荧光剂,压片显影。ScanDrv6软件扫描胶片,使用Quntity One图像分析软件对Western blot结果进行分析。以Smad4与内参β-actin的比值代表目的蛋白表达的相对含量。
1.2.4 RT-PCR 检测TGF-β1、I型胶原蛋白的表达 液氮研磨组织成粉,加入1ml Trizol,并以Trizol法提取组织中总RNA,按TaKaRa试剂盒说明操作,完成逆转录及PCR扩增。总反应体系为25μl,反应条件:94℃预变性2min,94℃变性0.5min,54℃退火0.5min,72℃延伸1.5min,反应30个循环。15g/L琼脂糖凝胶电泳检测PCR产物并用凝胶成像仪行凝胶摄像及图像分析。TGF-β1上游引物: 5'-GGC CAG ATC CTG TCC AAA CT-3' ,下游引物:5'-CAC GAT TAC CAC CTG GCG TT-3';I型胶原上游引物: 5’-GAC TGG TGA GAC CTG CGT GTA-3’,下游引物:5’-GCC TCT TGT CCT TGG GGT T-3’;β-actin上游引物:5’-CCT CAT GAA GAT CCT GAC CG-3’,下游引物:5’-ACC GCT CAT TGC CGA TAG TG-3’。 以TGF-β1 与β-actin电泳条带积分光密度(IOD)值的比值表示TGF-β1、I型胶原的相对表达量。
1.2.5 ELISA测定BALF中TNF-α的表达 取适量肺泡灌洗液上清,震荡混匀后,按ELISA试剂盒说明分别测定TNF-α水平。
2 结果
2.1 肺组织病理学改变
2.1.1 肉眼观察 对照组大鼠肺组织呈均匀的粉红色,表面光滑亮泽,质地柔软,弹性良好;单纯低氧组大鼠肺组织颜色暗红,组织肿胀,弹性降低,质韧,随时间的推移,双肺颜色加深,体积增大;低氧+高剂量灯盏花素组大鼠肺组织颜色及肿胀程度均较单纯低氧组轻。
2.1.2 组织形态学改变 HE染色结果显示,对照组肺组织结构未见明显充血水肿及炎症反应,单纯低氧组大鼠第3d即出现轻度的组织水肿及炎症细胞浸润,7d时肺组织血管充血、水肿明显,肺间质出现大量炎症细胞浸润,14、21d炎症状逐渐加重,肺泡间隔明显增宽;与低氧组相比,各药物干预组在第21天肺组织水肿、炎症反应及肺泡间隔增厚程度均较轻,见图1、2。
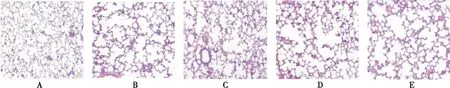
图1 对照组与各时点单纯低氧组肺组织病理学改变(HE×100)Figure 1 The pulmonary pathological changes of group A and group B at different time points注:A.对照组;B~E:单纯低氧组第3、7、14、21d
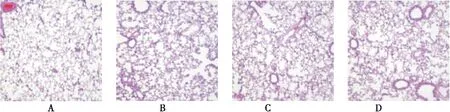
图2 第21天各组肺组织病理学改变(HE×100)Figure 2 The pulmonary pathological changes in each group at the 21st d注:A~D 分别为对照、单纯低氧、低氧+低剂量灯盏花素、低氧+高剂量灯盏花素组
2.2 不同时间低氧对肺组织中TGF-β1、I型胶原的表达的影响 TGF-β1、I 型胶原在常氧情况下大鼠肺组织中有基础量表达(黄染区为目的蛋白阳性表达区),TGF-β1为胞浆染色, I 型胶原为间质及胞浆染色。低氧组TGF-β1、I 型胶原表达都明显增加,低氧处理第3d后TGF-β1、I型胶原的表达量即开始升高(P<0.01),并随低氧时间的延长而升高,见图3~6,表1。
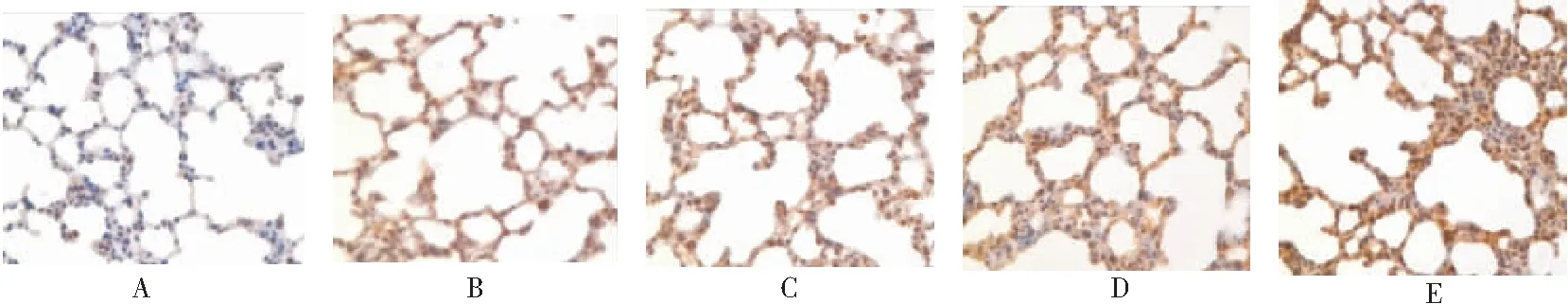
图3 对照组与单纯低氧组各时点肺组织中TGF-β1的表达(SABC ×400)Figure 3 The expression of TGF-β1 in group A at different time points注:A.对照组;B~E 分别为单纯低氧组第3、7、14、21d
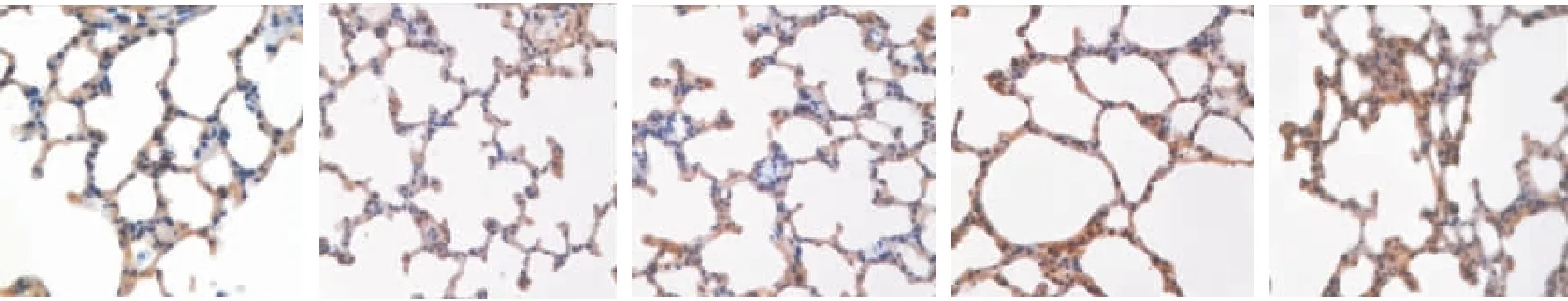
图4 对照组与单纯低氧组各时点肺组织中I型胶原的表达(SABC ×400)Figure 4 The expression of TGF-β1 in group A at different time points注:A:对照组;B~E 分别为单纯低氧组第3、7、14、21d
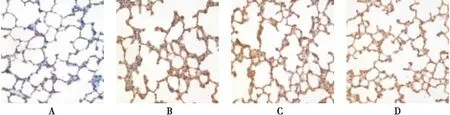
图5 第21天各组肺组织中TGF-β1的表达(SABC ×400)Figure 5 The expression of TGF-β1 in each group at the 21st day注:A~D 分别为对照、单纯低氧、低氧+低剂量灯盏花素、低氧+高剂量灯盏花素组
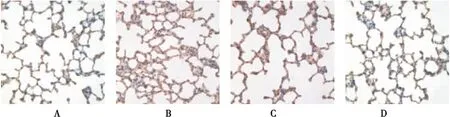
图6 第21天各组肺组织中I型胶原的表达(SABC ×400)Figure 6 The expression of COL I in each group at the 21st day注:A~D 分别为对照、单纯低氧、低氧+低剂量灯盏花素、低氧+高剂量灯盏花素组

时间Collagen ITGF-β1对照组单纯低氧组对照组单纯低氧组3d14.32±0.8625.35±1.21①10.53±1.4117.63±1.048①7d14.98±0.9232.52±2.54①②9.92±1.0620.07±1.77①②14d15.32±1.6836.55±2.75 ①②③10.25±1.4625.96±1.46①②③21d15.67±1.7242.96±6.25①②③④10.09±1.1330.80±1.22①②③④
注: 与对照组比较,①P<0.01;与低氧组3d比较,②P<0.05;与低氧组7d比较,③P<0.01;与低氧组14d比较,④P<0.01
2.3 低氧对肺组织中Smad4蛋白表达及BALF中TNF-α含量的影响 Western blot结果显示,与对照组比较,低氧组各时点Smad4蛋白表达均较常氧组升高,且随低氧时间的延长Smad4的表达进行性升高,相关性分析显示Smad4蛋白的表达水平与TGF-β1的表达呈正相关(r=0.944,P<0.01)。ELISA法结果显示大鼠BALF中含有微量TNF-α表达,低氧处理3d后TNF-α开始升高(P<0.05),并于第7d达高峰,此后TNF-α浓度稍有降低并趋于稳定,但较第3d仍升高(P<0.01),见图7,表2。
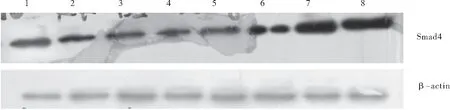
图 7 Western blot检测各组各时点Smad4的表达Figure 7 Western blot analysis of expression of Smad4 at different time points of hypoxia注:1~4分别为对照组第3、7、14、21d Smad4表达量;5~8分别为单纯低氧组第3、7、14、21d Smad4 表达量

时间Smad4TNF-α对照组单纯低氧组对照组单纯低氧组3d8.81±0.4712.27±0.84①34.32±2.3062.18±6.86①7d8.91±0.6515.24±0.57①②40.55±4.64108.72±11.84①②14d9.43±1.7319.46±1.79①②③46.90±8.3287.34±7.94①②21d9.41±0.7823.24±1.25①②③④53.40±8.5285.04±3.33①②
注:与对照组比较,①P<0.01;与低氧组3d比较,②P<0.05;与低氧组7d比较,③P<0.01;与低氧组14d比较,④P<0.01
2.4 低氧对各时点肺组织中TGF-β1、I型胶原mRNA表达的影响 低氧组各时点TGF-β1及I型胶原的mRNA表达量较空白对照组均有所上调(P<0.05),以第21d最为显著,见图8,表3。
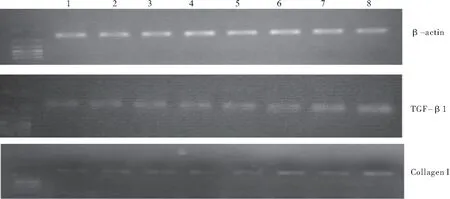
图8 RT-PCR检测单纯低氧组各时点TGF-β1及I型胶原的表达Figure 8 Detection of TGF-β1 and collagen I mRNA with RT-PCR 注: 1~4分别为对照组第3、7、14、21d;5~8分别为单纯低氧组第3、7、14、21d

时间TGF-β1Collagen I对照组单纯低氧组对照组单纯低氧组3d0.81±0.0881.208±0.100①0.681±0.0490.997±0.087①7d0.793±0.191.433±0.085①②0.686±0.0521.202±0.124①②14d0.933±0.0671.781±0.071①②③0.705±0.0331.423±0.068①②③21d0.840±0.0561.882±0.053①②③0.738±0.0351.708±0.062①②③④
注:与对照组比较,①P<0.05;与低氧3 d比较,②P<0.05;与低氧7d比较,③P<0.05;与低氧14d比较,④P<0.05
2.5 第21天各组大鼠肺组织中TGF-β1及Col I蛋白及mRNA的表达 试验第21天单纯低氧组大鼠肺组织中TGF-β1及Col I蛋白及mRNA表达量较对照组均显著增加(P<0.01);给予灯盏花素处理后,各组间TGF-β1 mRNA的表达量无统计学差异,但在蛋白水平,药物干预组较单纯低氧组TGF-β1的表达量下调(P<0.05),且不同药物浓度组间差异无统计学意义。与TGF-β1相比,药物干预组Col I蛋白及其mRNA表达水平均较单纯低氧组低(P<0.05),且高浓度抑制作用明显(P<0.01), 见表4,图5、6、9。

表4 第21天各组肺组织中TGF-β1及Col I蛋白及mRNA的表达Table 4 The protein and mRNA expression of TGF-β1 and COL I in each group at the 21st day
注:与对照组比较,①P<0.01;与低氧+高剂量灯盏花素组比较,②P<0.05;与低氧+低剂量灯盏花素组比较,③P<0.05

图9 RT-PCR检测第21天各组TGF-β1及I型胶原mRNA的表达Figure 9 Detection of TGF-β1 and collagen I mRNA with RT-PCR at 21st day in each group注:1~4为第21天对照、单纯低氧、低氧+高剂量灯盏花素、低氧+高剂量灯盏花素组
2.6 第21天各组大鼠肺组织中Smad4蛋白及BALF中TNF-α的表达 单纯低氧、低氧+低剂量灯盏花素、低氧+高剂量灯盏花素三组Smad4蛋白的表达量均较对照组增加(P<0.01);但经药物干预后,低氧+低剂量灯盏花素、低氧+高剂量灯盏花素组较单纯低氧组Smad4的表达水平有所降低(P<0.05),且低氧+高剂量灯盏花素组较低氧+低剂量灯盏花素组降低(P<0.05),见图10,表5。
表5第21天各组肺组织中Smad4及BALF中TNF-α的表达
Table5TheexpressionofSmad4inlungtissue,andTNF-αinBALFatthe21stdineachgroup

组别Smad4TNF-α对照组12.74±3.5553.32±2.34单纯低氧组26.92±2.75①②③84.89±1.86①②③低氧+低剂量灯盏花素组21.35±2.53①80.57±2.80①②低氧+高剂量灯盏花素组19.44±1.60①76.98±2.20①
注:与对照组比较,①P<0.01;与低氧+高剂量灯盏花素组比较,②P<0.05;与低氧+低剂量灯盏花素组比较,③P<0.05
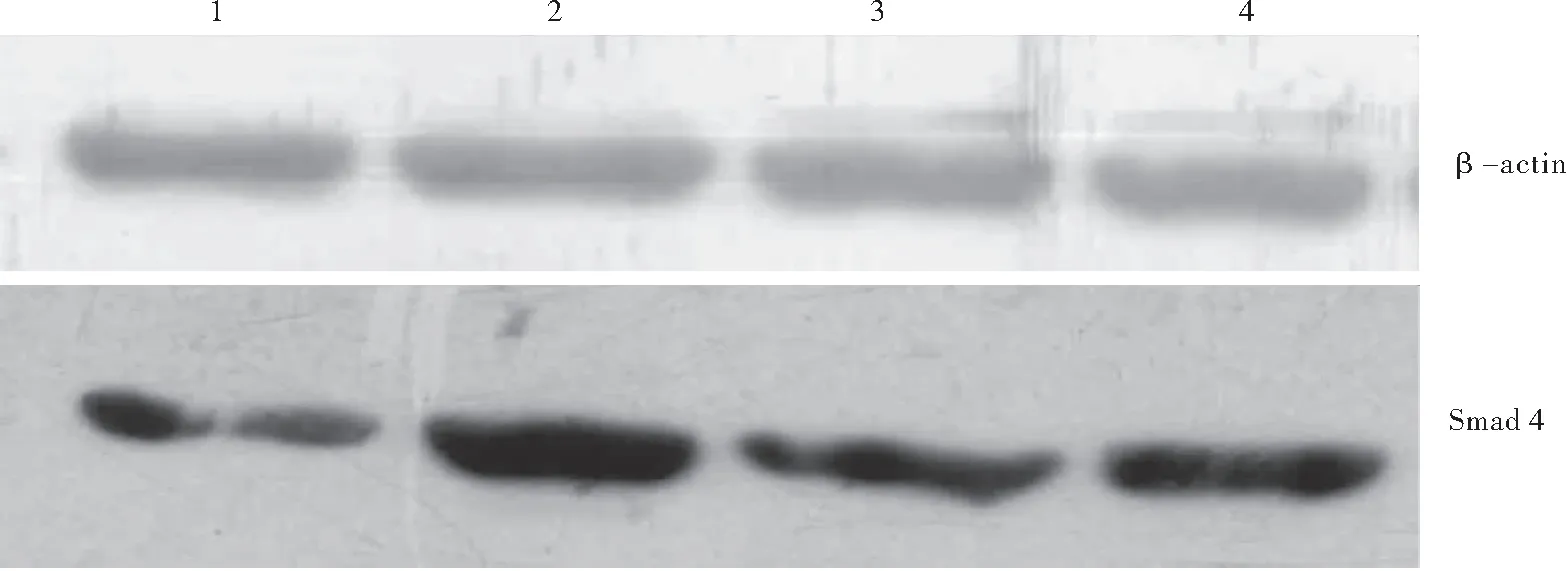
图10 Western blot检测第21天各组Smad4蛋白表达Figure 10 Western blot analysis of expression of Smad4 at 21st day of hypoxia in each group.注:1~ 4分别为第21天对照、单纯低氧、低氧+低剂量灯盏花素、低氧+高剂量灯盏花素组
3 讨论
低氧可致组织水肿、炎性细胞浸润、上调致纤维化相关细胞因子表达、促进上皮细胞向间质细胞转化并增加细胞外基质沉积 ,具有致纤维化作用。我们课题组前期体外试验也证实低氧可以促进人胚肺成纤维细胞增殖,并通过激活三磷酸肌醇激酶/蛋白激酶(PI3K/ATK)、p38丝裂原激活蛋白激酶(p38MAPK)信号通路促进细胞外基质的合成[4]。研究表明其具有舒张血管、抗凝、抗炎、降脂、清除氧自由基[15]等作用,并可减轻博莱霉素诱导的肺纤维化,在心血管疾病中已得到广泛应用。本实验主要观察间断性低氧对大鼠肺组织结构的影响及灯盏花素对其干预作用,并探讨其可能机制。
Madjdpour等[3]研究表明降低肺泡中氧浓度将导致大鼠肺组织明显炎症反应,并使肺泡灌洗液中TNF-α的表达量上调。 Rassler 等[8]的研究也表明,持续性低氧可引起肺组织水肿、炎症细胞浸润及肺泡间隔增厚,甚至出现轻度间质纤维化表现。本实验结果表明,间断低氧处理第3d起,大鼠肺组织即出现轻度水肿,随低氧时间的延长逐渐出现炎症细胞浸润、肺泡间隔的增厚。ELISA法检测BALF中TNF-α也显示低氧处理后TNF-α的表达量逐渐升高,至第7d时达高峰,后稍有降低并趋于稳定,但仍明显高于对照组(P<0.01);给予灯盏花素干预后,大鼠肺泡水肿、炎症反应、间隔增厚程度均较低氧组减轻,且BALF中TNF-α的表达量也降低。可能因低氧的方式不同及低氧时间不足,本试验各组大鼠肺组织均未出现明显纤维化改变。
TGF-β1具有趋化炎症细胞、促进成纤维细胞增殖分化及细胞外基质生成等生物学活性。而Smads通路是TGF-β1信号转导的主要通路[16],Smad4是 TGF-β1信号转导中必需的中转分子。Rassler等[8]及Jiang 等[17]试验均表明低氧可上调大鼠肺组织中TGF-β1的表达。本实验结果说明低氧可以在蛋白及基因水平上调TGF-β1表达,并激活TGF-β1/Smads信号通路。药物干预组结果显示,TGF-β1及Smad4的蛋白表达较单纯低氧组降低,但TGF-β1mRNA的量差异无统计学意义。我们推测灯盏花素可能通过翻译后调节影响TGF-β1蛋白的合成,进而抑制TGF-β1下游信号通路。
Col I是细胞外基质的主要成分,受TGF-β1/Smads信号通路的调节[18-19]。Sysa 等[20]通过siRNA干扰人肝脏星型细胞(LX-2)中SP1及Smad4基因的表达试验也提示,TGF-β1可通过调节SP1及Smads信号转导因子的作用上调Col I蛋白的表达。本试验结果表明,单纯组大鼠肺组织中TGF-β1及Col I在蛋白及mRNA表达水平均上调,且TGF-β1的下游信号通路蛋白Smad4的表达水平也升高。故推论低氧通过TGF-β1/Smads信号通路上调 Col I的表达,增加细胞外基质的合成。药物干预组Col I蛋白及mRNA,TGF-β1蛋白、Smad4蛋白的表达量均较单纯低氧组降低,且具有浓度依赖性,浓度越高,抑制作用越强。故灯盏花素可能通过抑制TGF-β1/Smads信号通路抑制Col I的合成,预防肺间质重构。
4 结论
间歇性低氧可诱发大鼠肺组织炎症反应,上调TNF-α、TGF-β1及Smad4的表达,促进Col I的合成及细胞外基质的沉积,导致肺泡间隔增宽甚至组织重构。而灯盏花素则可能通过抑制炎症反应,并通过翻译后调节降低TGF-β1蛋白及Smad4蛋白的表达,抑制TGF-β1/Smads信号通路,从而抑制Col I的合成及细胞外基质的沉积,保护肺功能。

