多氯联苯暴露促进HepG2细胞脂质的生成
,,,
(济南大学 生物科学与技术学院,山东 济南 250022)
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是指由非酒精性因素引起的,以肝细胞内脂质过量蓄积为主要特征的临床病理综合征[1],包括单纯性脂肪肝、非酒精性脂肪性肝炎及肝硬化,至今其发病机制尚未完全阐明[2-4]。据报道,肝脂肪蓄积是由肝内甘油三酯(triglycerides, TG)的消除和合成机制发生改变引起的,这一过程涉及众多分子,如过氧化物酶体增殖物激活受体(PPARα)、固醇调节元件结合蛋白(SREBP-1c)等。PPARα可通过β-氧化参与脂质的消除,而SREBP-1c则参与其合成途径。
多氯联苯(polychlorinated biphenyls,PCBs)属于持久性有机污染物,是由氯化联苯的异构体组成的一类含氯有机化合物,被应用于各生产领域[5],由于其物化性质稳定,因此对全球造成了污染。 PCB156作为一种多氯联苯单体(2, 3, 3′, 4, 4′, 5-多氯联苯),广泛存在于人类生态环境中。如刘耕耘等[6]检测北京土壤中PCBs组成时,发现土壤中存在PCB156;韩景超等[7]研究浙江温州不同城市功能区径流中PCBs的污染特性时,检测到不同径流中含有多种PCBs,其中包括PCB156。近年来,多项研究[8-9]显示PCBs暴露能增加部分人患NAFLD的风险。本课题组前期研究[10]发现,2, 3, 7, 8-四氯二苯并二口恶英(TCDD)与多氯联苯混合物Aroclor1254联合暴露可使小鼠肝脏积累大量脂肪颗粒,且肝脏病理切片显示有大量的空泡形成和炎性细胞的浸润等病理特征,然而,PCB156的毒性作用及其作用机制尚不明确[11]。
HepG2细胞作为体外实验模型,其病变过程仅局限于单纯脂肪变性,是研究NAFLD脂肪变性的良好模型[12]。本文中以HepG2细胞作为体外实验模型,考察PCB156暴露与NAFLD的关系,并探讨其潜在分子作用机制,希望对有效减缓PCBs暴露导致人体健康危害具有指导的意义。
1 材料与方法
1.1 实验材料
主要材料包括:HepG2细胞株,中国科学院上海生命科学研究院细胞资源中心提供;多氯联苯单体PCB156,北京百灵威科技有限公司;胎牛血清(FBS)、胰蛋白酶及最小必需培养基(MEM),美国赛默飞世尔科技(中国)有限公司;磷酸缓冲液(PBS)、细胞级二甲亚砜(DMSO),北京索莱宝科技有限公司;核糖核酸(RNA)提取试剂盒、反转录试剂盒及荧光定量试剂盒,宝生物工程(大连)有限公司;多聚甲醛(分析纯)及油红O,上海和序生物科技有限公司;甘油三酯(TG)测试盒、总蛋白测试盒,江苏省南京建成生物工程研究所。
1.2 实验方法
1.2.1 细胞培养及处理
HepG2细胞用体积分数为10%的FBS的MEM,于37 ℃、CO2体积分数为5%的培养箱中进行培养。 待细胞长至直径为60 mm的培养皿容积的85%时,加胰蛋白酶(625个酶单位)进行消化,按细胞数密度5×104mL-1接种至24孔板,每个孔接种700 μL。待铺板细胞贴壁约60%,分别用浓度为3.4、34 μmol/L的PCB156加入到生长状态良好的HepG2细胞中进行暴露,以DMSO暴露作为对照组,每组设置3个平行试样,均暴露72 h。
1.2.2 油红O染色
取0.5 g油红O溶于100 mL异丙醇中制成储存液,实验时取6 mL加蒸馏水至10 mL,静置过滤配成工作液。 暴露实验完成后,24孔板HepG2细胞用PBS(浓度为10 mmol/L)洗涤3遍,甲醛固定30 min,油红O工作液染色20 min,用异丙醇体积分数为60%的溶液洗涤3遍,分色至背景无色,蒸馏水洗至脱去浮色后于倒置相差显微镜下观察。
1.2.3 甘油三酯及总蛋白测定
按照试剂盒说明书进行操作。
1.2.4 基因表达量实时荧光定量测试
PCB156暴露72 h后,收集各组细胞,按试剂盒说明书分别提取各实验组细胞总RNA,并将总RNA逆转录成互补脱氧核糖核酸(cDNA)。参考文献并用Primer 5软件设计β-肌动蛋白(β-actin,内参)、PPARα、SREBP-1c引物序列(见表1),进行荧光定量聚合酶链式反应(Q-PCR),反应条件如下: 95 ℃,3 min预变性;95 ℃,30 s变性;56 ℃,30 s退火;72 ℃,30 s延伸;72 ℃,10 min终延伸;4 ℃保温;共35个循环,使用2-ΔΔCt法计算基因表达量。

表1 β-actin、PPARα、SREBP-1c引物序列
1.2.5 统计学分析
采用GraphPad Prism统计软件进行数据处理,多个样本均数的比较采用单因素方差分析,2个样本均数的比较采用t检验(显著性水平p≤0.05为显著性差异)。
2 实验结果
2.1 PCB156暴露促进HepG2细胞脂质的生成
油红O作为一种强染脂剂,能够指示细胞中脂质的含量,因此本文中对PCB156暴露72 h后的HepG2细胞进行油红O染色。 实验结果表明,浓度为3.4 μmol/L的PCB156暴露组相对于DMSO对照组,其HepG2细胞内脂滴数量明显多于对照组(见图1(a)(b)。 当暴露浓度为34 μmol/L时,HepG2细胞内脂滴数量显著多于对照组(见图1(c)(d))。

(a)对照组CT-0.1(放大倍数400×)(b)实验组PCB156-3.4(放大倍数400×)(c)对照组CT-1(放大倍数400×)(d)实验组PCB156-34(放大倍数400×)CT-0.1—对照组二甲亚砜的浓度为 0.1 μmol/L; PCB156-3.4—PCB156暴露浓度为3.4 μmol/L;CT-1—对照组二甲亚砜的浓度为1 μmol/L; PCB156-34—PCB156暴露浓度为34 μmol/L。图1 多氯联苯PCB156暴露后HepG2细胞内脂质蓄积
2.2 PCB156暴露增加HepG2细胞内甘油三酯的浓度
PCB156暴露增加HepG2细胞甘油三酯浓度的实验结果如图2所示。 与对照组相比,浓度分别为3.4、34 μmol/L的PCB156暴露均能增加HepG2细胞中TG的浓度(3.4 μmol/L时为1.18倍,34 μmol/L时为1.23倍),但是显著性水平p>0.05,不具有统计学差异。
2.3 PCB156暴露诱导HepG2细胞PPARα与SREBP-1c基因的表达
为了进一步探讨PCB156促进HepG2细胞脂质生成的潜在分子机制,考察了PCB156暴露对HepG2细胞中参与脂质生成过程中重要调控基因PPARα与SREBP-1c的表达水平的影响,结果如图3所示。 从实验结果可以看出,相对于对照组,浓度为 3.4 μmol/L 的 PCB156 暴露 HepG2 细胞,能显著上调PPARα(2.2倍,p<0.05)与SREBP-1c(2.4倍,p<0.05)基因的表达水平。

CT-0.1—对照组二甲亚砜的浓度为 0.1 μmol/L;PCB156-3.4—PCB156暴露浓度为3.4 μmol/L;CT-1—对照组二甲亚砜的浓度为1 μmol/L;PCB156-34—PCB156暴露浓度为34 μmol/L。图2 多氯联苯PCB156暴露增加HepG2细胞甘油三酯浓度的实验结果
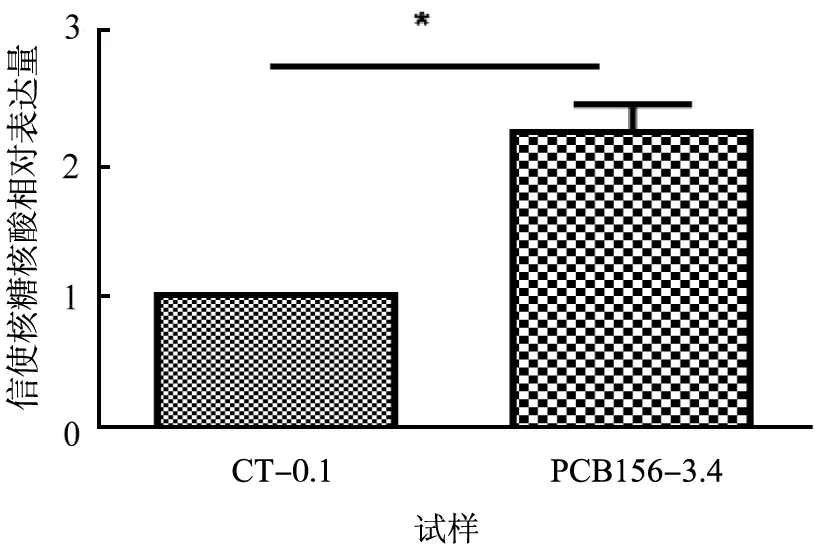
(a)PPARα
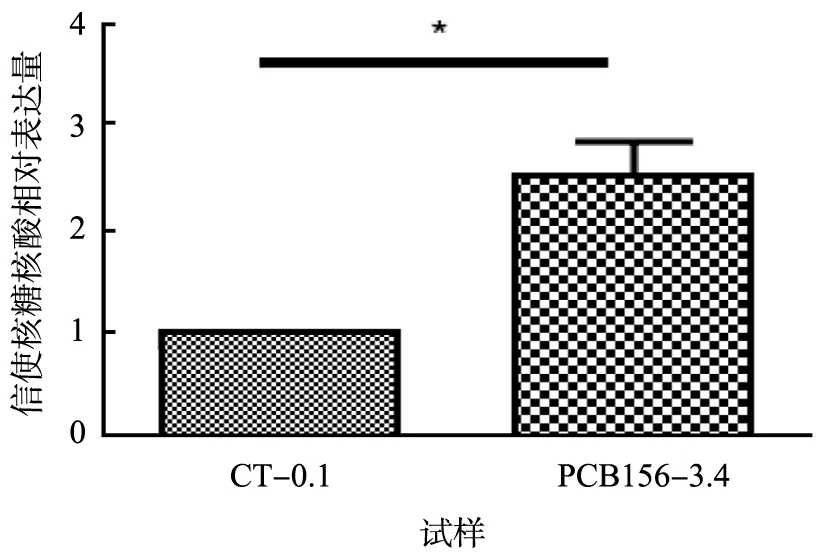
(b)SREBP-1cCT-0.1—对照组二甲亚砜的浓度为 0.1 μmol/L;PCB156-3.4—PCB156暴露浓度为3.4 μmol/L。图3 过氧化物酶体增殖物激活受体(PPARα)与固醇调节元件结合蛋白(SREBP-1c)基因表达量
3 分析与讨论
NAFLD是一种主要受遗传与环境相互作用调节的多因素疾病[12]。 本文中探讨了环境中持久性有机污染物PCB156与NAFLD的关系。 实验结果发现,PCB156暴露能够促进HepG2细胞脂质的生成。
PCB156作为一种类二口恶英多氯联苯,其结构与二口恶英的平面结构相似,具有与二口恶英比较相近的毒平面结构,因此具有与二口恶英比较相近的毒性作用。Duval等[13]研究发现,长期低剂量二口恶英暴露C57BL6小鼠能够加剧小鼠NAFLD病变。Boucher等[14]研究证明,类二口恶英多氯联苯PCB126暴露同样能够促进高脂喂养的C57/BL6小鼠NAFLD的发病进程。在本文的研究中,PCB156暴露能够增加HepG2细胞内脂滴的数量和甘油三酯的浓度,具有导致NAFLD的风险,进一步验证了类二口恶英多氯联苯与NAFLD的相关性。
PCB156促进肝细胞脂质生成的作用机制通常与肝细胞脂质代谢紊乱有关。文献[15]中的研究结果表明,脂质代谢紊乱与PPARα分子信号通路激活密切相关,且经过体内外实验证实,PPARα的活化[16]可以促进肝脏甘油三酯的合成,导致肝脏脂肪病变。SREBP-1c作为调控肝脏脂质代谢的关键因子,能够激活脂肪酸和胆固醇的生物合成,抑制TG的转运[17-19]。Shimano[20]研究发现,SREBP-1c直接参与脂肪酸和TG合成的表达调控是参与脂肪合成的主要调节因子。McPherson等[21]认为SREBP-1c的过表达可引起脂肪合成相关酶基因的表达量过大,导致脂肪在非脂肪组织中堆积。在本文的研究中发现,PCB156暴露能够显著诱导PPARα和SREBP-1c信使核糖核酸(mRNA)的表达,表明PPARα和SREBP-1c在PCB156引起的NAFLD中起着潜在重要的调控作用。
PPARα、SREBP-1c作为NAFLD进程中重要的调控分子,其表达量的增加使细胞内TG蓄积,从而引发NAFLD进程。在PCB156诱导NAFLD发病进程中,关于PPARα、SREBP-1c等信号通路分子机制的问题还有待进一步研究,以期为治疗NAFLD提供新思路。

