壬基酚聚氧乙烯醚对成年雄性斑马鱼HPG轴相关基因表达的影响
姜锦林,刘仁彬,张宇峰,梁 霞,单正军
壬基酚聚氧乙烯醚对成年雄性斑马鱼HPG轴相关基因表达的影响
姜锦林1*,刘仁彬1,2,张宇峰2,梁 霞1,单正军1
(1.环境保护部南京环境科学研究所,国家环境保护农药环境评价与污染控制重点实验室,江苏 南京 210042;2.南京工业大学环境学院,江苏 南京 210009)
本研究以模式动物斑马鱼()为受试生物,采用半静态水体暴露的方式研究了不同浓度壬基酚聚氧乙烯醚(NPEO)对斑马鱼雄性成鱼下丘脑-垂体-性腺轴(HPG轴)的影响.结果显示,考察浓度范围内的NPEO暴露可以显著上调斑马鱼脑中、、、、和基因,以及性腺中基因的相对表达量.和基因表达量对较低浓度NPEO暴露较为敏感,其中和基因表达量在低至0.001mg/L的NPEO暴露下即出现显著上调.0.1和10mg/L NPEO暴露可以显著抑制斑马鱼精巢中基因的表达量,而10mg/L NPEO暴露则可以显著诱导基因的表达量.相关调控基因表达量的上调,表明NPEO暴露可以诱导下丘脑分泌,进而刺激垂体分泌.NPEO暴露诱导基因的表达,促进了内源雌激素的合成.同时,NPEO通过抑制表达,可能抑制睾酮(T)的合成,干扰斑马鱼精巢中原有的性激素平衡.斑马鱼精巢内雌激素水平升高负反馈给垂体,刺激垂体分泌促性腺激素.由此表明,考察浓度范围内(0.001~10mg/L)的NPEO的暴露可以影响雄性斑马鱼成鱼HPG轴的反馈调节.
壬基酚聚氧乙烯醚;雄性斑马鱼;内分泌干扰效应;HPG轴
壬基酚聚氧乙烯醚(NPEO),作为一种常见的非离子表面活性剂,广泛应用于许多工业和农业产品,如洗涤剂、化妆品、造纸、印刷、纺织、农药杀虫剂、制药、冶金、石油、合成橡胶、塑料、油漆甚至食品等产品的加工和生产[1-3].近些年来,NPEO全世界年均产量达到700000t左右[4],是全球使用量第二大的商用非离子表面活性剂[5].NPEO可以通过农药使用、污泥农用和污水灌溉等多种途径释放到环境中[6],其本身和代谢产物的环境潜在影响引起人们广泛关注.在自然环境中,NPEO易被降解成短链壬基酚聚氧乙烯醚、壬基酚(NP)和羧酸衍生物等多种代谢产物[7].其中,NP在废水、地表水和沉积物中常被测出[8],已被证实具有类雌激素性质[9],其毒性远远高于母体本身.有学者[10-11]监测了2000年长江和嘉陵江重庆段中NPEO类和4-NP等污染物的浓度,发现四月份和十二月份河流中NPEO类是其中主要的污染物,且有着近似的剖面分布情况.总NPEO(包含不同氧乙烯链长度)浓度为6.9~97.6µg/L (四月份)和2.5~52.7µg/L(十二月份).但在七月份时NP变为河流中主要的污染物,浓度为1.7~7.3µg/L. NPEO及代谢产物还可以通过食物链在动物和人体内累积,对人体正常的激素分泌产生影响,造成雌性效应、致畸、致癌和致突变等多种效应,具有典型内分泌干扰物(EDCs)的特征[12-13].EDCs可以通过模仿天然激素作用、与天然激素相结合等方式干扰内分泌系统,影响生物正常发育和繁殖,导致产卵量和受精率下降[14-15].
截止目前,关于NPEO降解产物NP对鱼类毒性效应的研究比较多[16],刘晓丽等[17]研究了NP对斑马鱼精巢组织及性激素合成酶基因表达的影响,发现NP可以诱导斑马鱼精巢中内源雌激素合成和雌激素受体的表达,提高雌激素效应.但关于NPEO暴露干扰鱼类内分泌系统的研究较少,研究表明NPEO具有一定雌激素活性,Metcalfe等[18]观察到100µg/L的NP1EO和NP2EO混合暴露组导致一条雄性青鳉出现雌雄间性,NPEO对鱼类内分泌干扰效应的作用机制还不明确.本研究在基因转录水平上研究NPEO对斑马鱼雄性成鱼的影响,应用实时荧光定量PCR方法,检测鱼体下丘脑一垂体一性腺轴(HPG轴)相关调控基因的相对表达量,以期通过基因表达的变化,揭示NPEO干扰斑马鱼内分泌系统可能的毒性作用机制.
1 材料与方法
1.1 仪器与试剂
仪器:体视显微镜(Leica,S8APO),全自动电泳系统(Bio-Rad,Experion),凝胶成像分析系统(Bio-Rad, Gel Doc XR+),PCR仪(Bio-Rad,DNA Engine),荧光定量PCR仪(Bio-Rad,CFX96TMOptics Module).
试剂:壬基酚聚氧乙烯醚(CAS号:9016-45-9,分析纯),购自阿拉丁化学公司;17β-雌二醇(CAS号: 50-28-2,>99%),购自Sigma-Aldrich公司;丙酮(CAS号:67-64-1,分析纯),购自上海凌峰化学试剂有限公司.
1.2 受试材料和暴露实验
斑马鱼购自南京大学模式生物研究中心,平均体重(0.315±0.064)g,均为性成熟雄性个体,在环境保护部南京环境科学研究所斑马鱼实验系统中心驯养2周以上,驯养鱼用水为曝气处理24h以上的自来水,水质硬度为136~144mg/L(以CaCO3计),溶解氧饱和浓度保持在80%左右,pH值为7.8±0.2.每天定时投喂新鲜孵化的卤虫无节幼体()2次,投喂量以饲料在5min内被吃完为准.
NPEO暴露设计:斑马鱼驯养结束后,参考OECD测试准则230对斑马鱼进行暴露处理[19].以丙酮为助溶剂,将NPEO配制成母液,浓度为500mg/L.设置5个NPEO试验浓度组,分别为0.001, 0.01,0.1,1, 10mg/L,NPEO暴露剂量根据预试验及相关文献报道而设计[18,20],浓度最高组丙酮含量为0.01%.设置一个空白对照组、一个溶剂对照组和一个80μg/L的雌二醇(E2)试验组,每个浓度组设置3个平行组.E2实验组作为阳性对照组,E2是一种强效的雌激素,能对鱼类产生间性性腺(卵巢-睾丸)[18].试验在10L(含8L暴露液)的玻璃缸中进行,每个平行组随机放入40尾试验用鱼.采用半静态试验,48h更换一次试液,水温控制在(25±2)oC,光照周期14:10h.暴露周期为21d,试验期间每天喂食3次.暴露21d后取样,取样时将斑马鱼置于冰上,冻僵后快速取脑和精巢组织,液氮冷冻后,放在-80℃冰箱中保存待用.
1.3 荧光定量PCR实验步骤
1.3.1 总RNA提取与检测 利用Invitrogen TRIzol Reagent从斑马鱼脑和精巢组织中提取总RNA,测定总RNA在260和280nm的吸收值,计算OD260/OD280比值,测得比值均介于1.8~2.0,可用于后续反转录实验.将提取的斑马鱼组织的总RNA进行1.0%琼脂糖凝胶电泳,可观察到清晰的28S、18S和5S rRNA条带,说明所提取的总RNA完整性较好,可继续进行后续试验.
1.3.2 cDNA合成 根据HiScript™ 1ST strand cDNA Synthesis kit的说明进行反转录,反应体系为10μL.在一个RNase-free离心管里按如下体系加入反应液(10mL):总RNA(1pg~500ng) 1mL,4×gDNA wiper Mix 2mL,RNase-free water 5mL.用移液器轻轻吹打混匀后短时离心,PCR仪上42℃反应2min.在第1步的反应管中直接加入5×qRT SuperMixⅡ 2μL,用移液器轻轻吹打混匀后短时离心,按以下程序进行逆转录反应:25℃10min,42℃ 30min,85℃ 5min.所得cDNA产物可在-20℃储存或立即用于qRT-PCR反应.
1.3.3 荧光定量PCR 将cDNA样品.实时荧光定量PCR反应体系为20μL:10μL Faststart Universal SYBR Green Master,4μL cDNA模板(反转录后按1:10稀释),2μL引物(6mmol/L),4μL RNase-free water.反应条件如下:95℃ 10min,1个循环;95℃ 10s,55℃ 3s,40个循环,4℃保存.3次重复实验以减少误差.溶解曲线的分析是为了确保各步反应只有一个片段进行扩增.选择基因作为内参基因,进行实时荧光定量PCR测定,目标基因和参照基因扩增效率都接近100%且相互间效率偏差在5%以内.选取11种与内分泌干扰系统相关的基因,检测了其相对表达量.基因名称、引物序列和引物序列号见表1.

表1 基因名称、引物序列和引物序列号
1.4 数据统计分析
相对基因表达量采用2-ΔΔCt法进行计算,其中ΔΔCt由公式(1)计算得到:
ΔΔCt=[(Cttarget-Ctactin)t-(Cttarget-Ctactin)0] (1)
式中:Ct表示循环阈值;Cttarget表示目标基因的Ct值;Ctactin表示内参基因的Ct值;t代表任意时间点;0表示经基因校正后1倍量的目标基因表达.
荧光实时定量得到的数据进行单因素方差分析(ANOVA).所有实验数据采用SPSS19.0统计软件处理分析,利用方差分析检验实验组和对照组各组织中不同时间点的数据显著性差异,用Tukey法检验计算值,当<0.05(*)时认为差异显著,<0.01(**)认为差异极为显著.
2 结果
2.1 NPEO对斑马鱼促性腺激素释放激素基因及其受体基因mRNA表达的影响
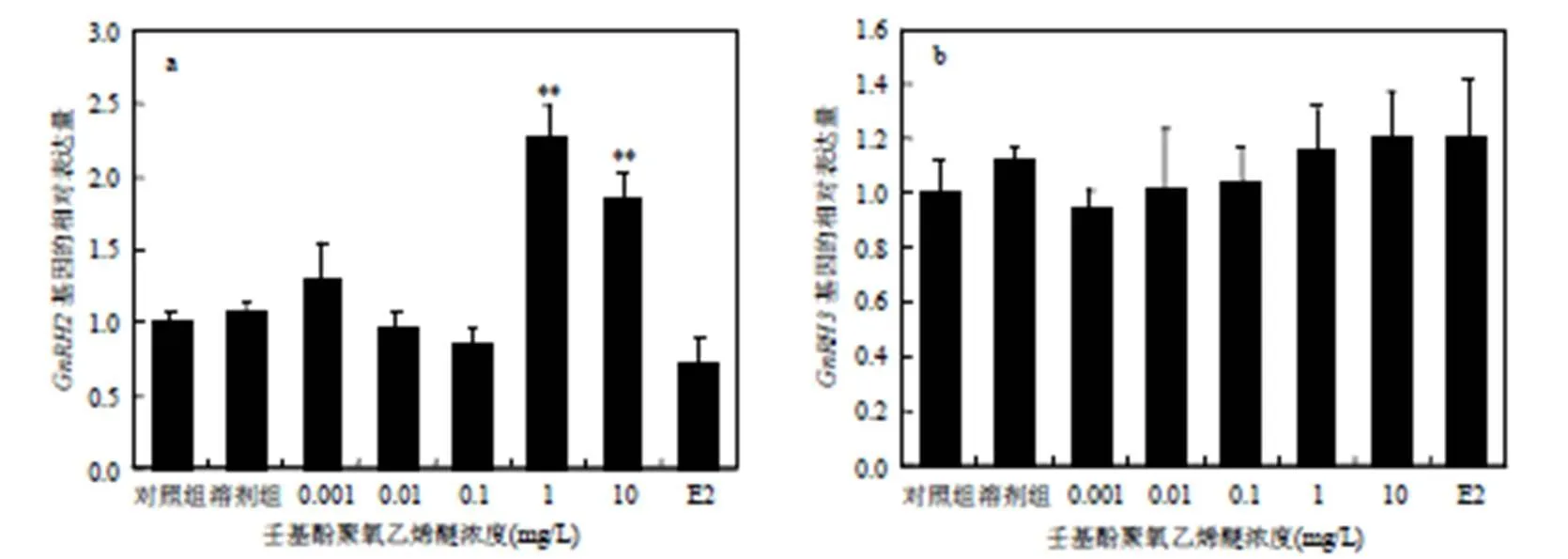
图1 NPEO对斑马鱼脑中GnRH2(a)、GnRH3(b) mRNA表达的影响
整个试验过程中,对照组和处理组都未观察到受试鱼行为和形态的异常.由图1可以看出,与对照组相比,1,10mg/L的NPEO可以使斑马鱼脑中基因的表达量显著增高,但在低浓度NPEO和E2的处理下没有出现显著性变化,所有浓度NPEO和E2对斑马鱼脑中基因的表达影响均不显著.
由图2可知,斑马鱼脑中基因的相对表达量与NPEO的浓度呈明显的正相关.与对照组相比,在0.01mg/L的NPEO作用下,斑马鱼脑中、基因的相对表达量即发生显著影响,10mg/L的NPEO对斑马鱼脑中、基因表达量的影响极为显著.NPEO暴露对斑马鱼脑中基因表达量的影响较为敏感,所有浓度组对其相对表达量的影响都很显著.
2.2 NPEO对斑马鱼促性腺激素基因及其受体基因表达的影响
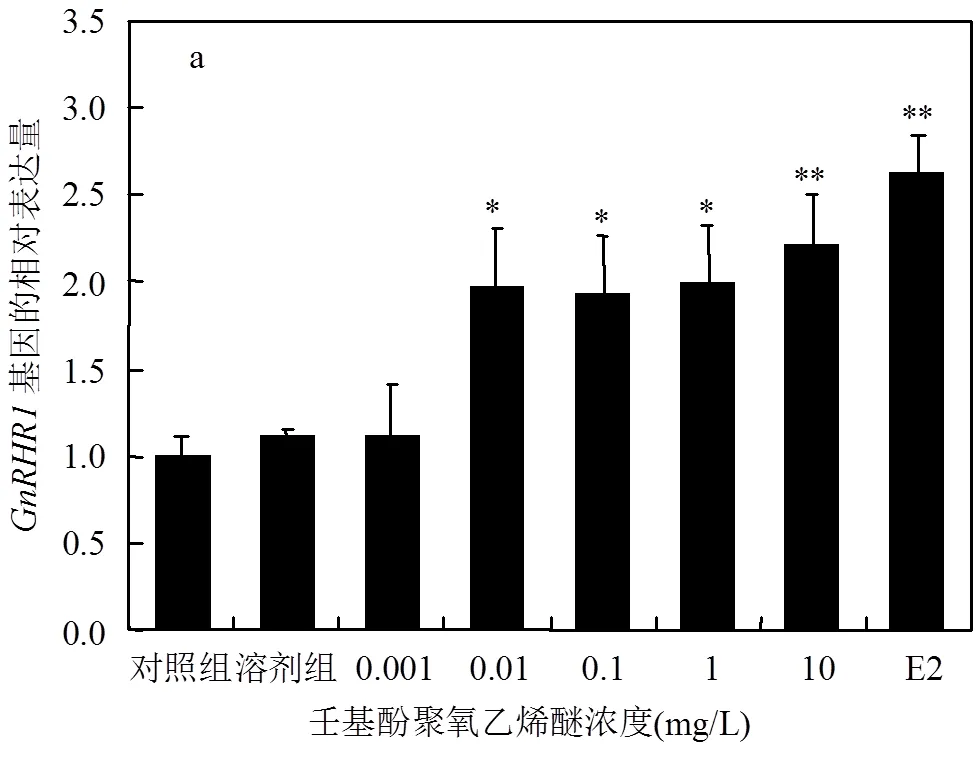
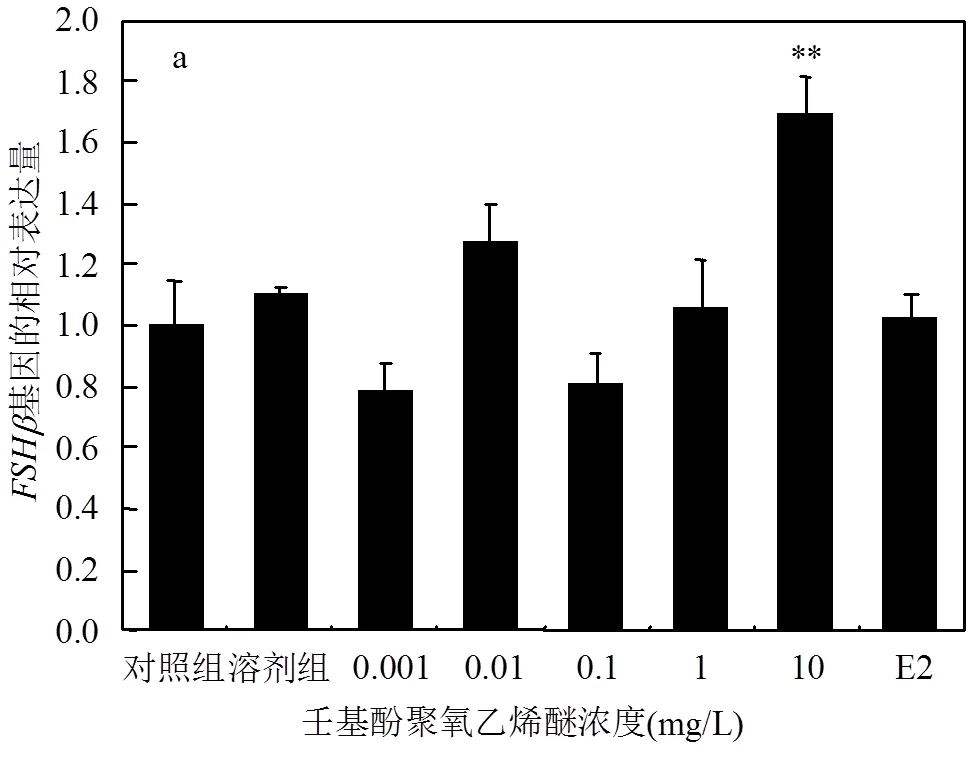
由图3可知,在低浓度的NPEO作用下,斑马鱼脑中基因的表达量与对照组相比无明显的影响,仅在10mg/L的NPEO作用下,斑马鱼脑中基因的表达量出现显著性上调.NPEO可以诱导斑马鱼脑中基因表达量的上调,其中0.001和10mg/L处理组对其表达量影响显著,0.01,0.1和1mg/L对其表达量影响极为显著.
由图4可知,NPEO对斑马鱼精巢中基因的表达量与对照组相比无明显的影响,但E2对其影响极为显著.0.001mg/L的NPEO暴露可以显著上调斑马鱼精巢中基因的表达量,0.01mg/L的NPEO暴露对其表达量的影响极为显著,其他浓度暴露组均无明显影响.
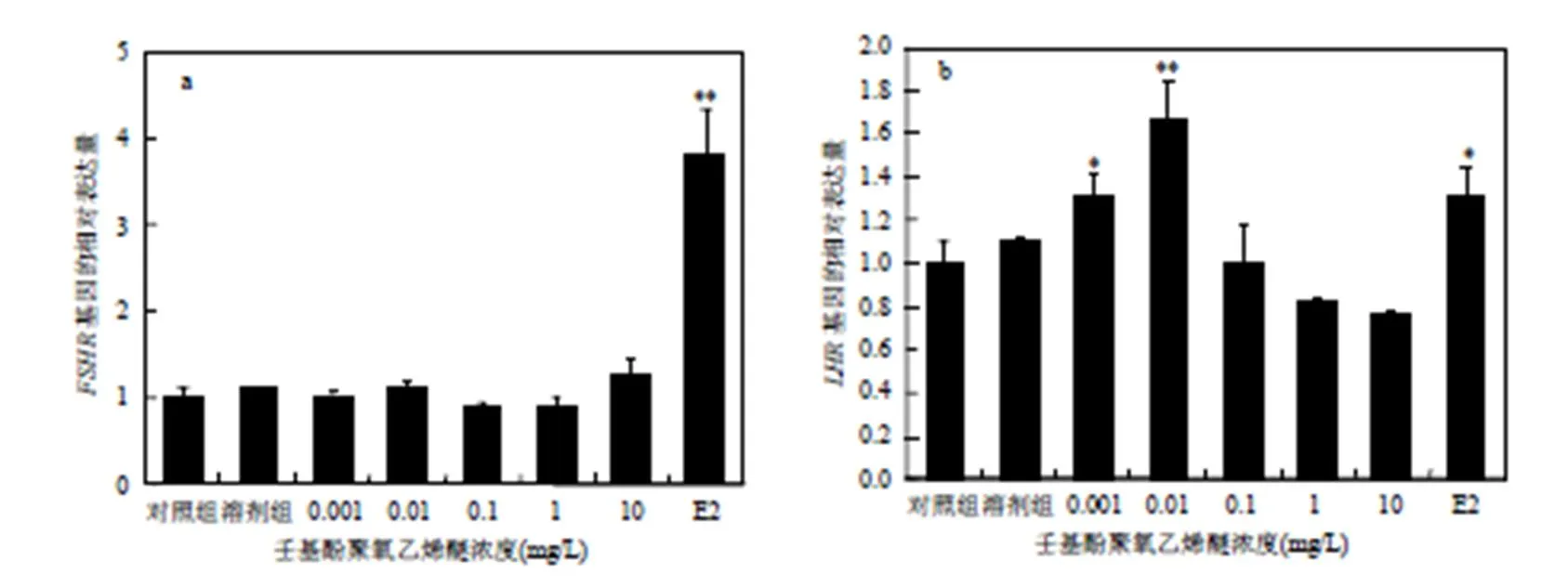
图4 NPEO对斑马鱼性腺中FSHR(a)、LHR(b) mRNA表达的影响
2.3 NPEO对斑马鱼细胞色素P450酶相关基因表达的影响
由图5可知,斑马鱼精巢中基因的表达量与NPEO暴露浓度存在负相关关系,其表达在0.1和10mg/L的NPEO暴露浓度下受到显著抑制,而10mg/L的NPEO暴露则可以显著诱导斑马鱼精巢中基因的表达.

图5 NPEO暴露对斑马鱼精巢中性激素合成相关酶基因表达的影响 Fig.5 Effects of NPEO exposure on the expression of steroidogenic genes in testis of zebrafish
3 讨论
鱼类感受外部刺激,促使下丘脑分泌促性腺激素释放激素(GnRH),GnRH的释放会激发脑垂体合成并释放促性腺激素(GtH).GtH包括促卵泡生成素(FSH)和黄体生成素(LH),它们通过血液循环到达性腺,促使性腺产生性类固醇激素,进而影响配子的发育,调节生殖行为[21].同时性激素也可以反馈给下丘脑和垂体,脑中相应部位接受到反馈调节信号后会自我调节,以应对外部环境对机体产生的刺激[22].如此反馈与负反馈,调节着鱼类的生殖和繁殖活动,这就是调控鱼类配子形成和性腺成熟的下丘脑-垂体-性腺轴[23].
本研究中,特定浓度的NPEO暴露对基因、基因、基因、基因和基因表达量的影响与E2对这些基因表达量的影响基本一致,显示出NPEO对斑马鱼具有类雌激素效应.下丘脑-垂体-性腺轴控制性类固醇激素的合成,影响激素的释放及其在靶器官的效应,再通过反馈作用影响到神经系统.促性腺激素释放激素在HPG轴中起着至关重要的作用[24].与垂体前叶的促性腺激素分泌细胞处的受体结合,从而调节促性腺激素的合成和分泌.根据国际通用标准,区分为()、()和()三种类型.斑马鱼中只有和两个亚型[25].本研究结果显示,NPEO暴露显著上调了斑马鱼脑中、、、基因的相对表达量,其中10mg/L的NPEO暴露对和的影响均极为显著.Ji等[25]发现双酚S暴露同样可以上调雄性斑马鱼脑中和基因的相对表达量,进而影响促性腺激素的产生.说明NPEO可能通过诱导下丘脑产生,与垂体上的受体结合,进而影响促性腺激素相关基因的表达水平.需要注意的是,斑马鱼脑中和基因表达水平的变化会对性激素平衡产生干扰[26].
促性腺激素由垂体分泌,作用于性腺,刺激生殖细胞的生长、发育、成熟和排出.在硬骨鱼中发现的两种促性腺激素最初被命名为GtH I和GtH II, Bogerd等[27]提议将鱼类的GtH I和GtH II分别命名为FSH和LH,得到了大家广泛的认可.在雄鱼中,FSH决定精巢支持细胞的增值以及促进精子细胞的成熟,而LH则作用于精巢中的间质细胞,调节精子发生的最后阶段[28].性激素的合成和分泌受到上游的调控,研究表明鱼类的功能与哺乳动物类似[26].Han等[29]发现DE-71暴露可以增加斑马鱼垂体中、基因,从而刺激精巢中和的表达,影响类固醇激素的产生.本研究中也观察到类似DE-71暴露后产生的效应,NPEO暴露上调了斑马鱼、和基因的表达量,说明下丘脑分泌的对垂体的分泌产生影响,进而影响雄性斑马鱼精巢组织的正常发育.与基因表达量的变化相比,基因表达对NPEO的暴露响应更加敏感.低浓度的NPEO暴露可能仅通过改变雄激素的合成来干扰斑马鱼精巢中原有性激素的平衡,10mg/L的NPEO暴露可以同时改变雌、雄激素的合成,从而加强对斑马鱼内分泌系统的干扰.此现象的具体作用机制尚不确定,有待进一步研究.
细胞色素P450芳香化酶()是雌激素合成过程中的限速酶,它能催化雄激素向雌激素转化,这一过程在鱼类性腺发育中是必不可少的[30].鱼类的P450芳香化酶具有和两种结构不同的亚型,它们之间的相似性具有60%,基因主要在卵巢中表达,而基因则主要在脑组织中表达.基因编码的细胞色素P45017α-羟化酶是类固醇激素生成过程中的重要酶,是体内雄激素合成的限速酶,所以在雄激素的生物合成过程中非常重要,分布于肾上腺和性腺的间质细胞中[31].刘晓丽等[17]报告了NP暴露对斑马鱼精巢中及基因表达量的影响,125µg/L的NP暴露可显著上调基因的表达,250µg/L的NP暴露可导致基因的表达量显著下调,干扰精巢原有的性激素平衡.NP主要表现为对斑马鱼精巢中内源性雌激素的干扰,但NPEO可能优先干扰雄激素的合成.本研究结果显示,仅10mg/L的NPEO暴露显著上调了斑马鱼精巢中基因的表达量,与NPEO对基因表达的影响保持一致.雄鱼体内雌激素升高,可能反馈给垂体,刺激促性腺激素的分泌,这可能是本研究中雄鱼垂体分泌促性腺激素增加的主要原因.0.1和10mg/L的NPEO暴露使斑马鱼精巢中基因的表达量显著下调,同时诱导斑马鱼脑中基因的表达.HPG轴的控制不是单向的,脑垂体通过分泌作用于性腺,而性腺类固醇激素的变化也可能对下丘脑产生反馈作用.Baudiffier等[32]研究了抗真菌药物克霉唑对斑马鱼精巢类固醇合成的影响,观察到斑马鱼和基因的表达量发生上调,认为克霉唑抑制精巢中11-KT合成激活了/通路,引起脑垂体对精巢雄性激素合成的补偿调节作用.NPEO抑制斑马鱼精巢中雄激素的合成激活了/R通路,NPEO暴露可能引发类似的补偿作用,从而上调了斑马鱼脑中基因的表达量.NPEO可能通过干扰精巢中原有性激素的平衡,最终对斑马鱼内分泌系统产生不利的影响.
4 结论
4.1 NPEO暴露可以诱导下丘脑产生促性腺激素释放激素,进而刺激垂体分泌促性腺激素.促性腺激素与其受体结合激活了内源雌激素的活性,促进了内源雌激素的合成.
4.2 NPEO通过抑制表达,可能抑制睾酮(T)的合成,影响斑马鱼精巢中的性激素平衡.雄鱼精巢内雌激素水平升高负反馈给垂体,刺激垂体分泌促性腺激素,导致垂体分泌促性腺激素增加,从而对斑马鱼的HPG轴产生干扰,进而影响斑马鱼的生殖活动.
4.3 不同浓度的NPEO暴露对精巢中性激素平衡的影响略有不同,低浓度NPEO暴露对精巢中性激素平衡影响不显著,0.1,1mg/L的NPEO 暴露主要通过抑制雄激素的合成干扰精巢中的性激素平衡,10mg/L的NPEO暴露对斑马鱼精巢中性激素平衡干扰显著,增加雌激素合成的同时抑制雄激素的合成.
[1] 吴 伟,吴 滟,陈家长,等.壬基酚聚氧乙烯醚及壬基酚对鱼肝EROD酶的体外诱导 [J]. 中国环境科学, 2005,25(1):125-128.
[2] 张 双,刘 芳,李佳蔓,等.氮改性介孔碳的制备及其对水中壬基酚聚氧乙烯醚的吸附 [J]. 石油学报(石油加工), 2017,33:471-479.
[3] 顾宇翔.洗涤剂和化妆品中烷基酚和烷基酚聚氧乙烯醚的检测进展 [J]. 日用化学工业, 2017,47:352-356.
[4] Gao D W, Li Z, Guan J X. Seasonal variations in the concentration and removal of nonylphenol ethoxylates from the wastewater of a sewage treatment plant [J]. Journal of Environmental Sciences, 2017,54:217- 223.
[5] 翟 彬,高 雅.介孔碳及其改性材料对壬基酚聚氧乙烯醚吸脱附性能的研究 [J/OL]. 环境科技, 2017,30:10-15+20.
[6] 卜元卿,单正军,智 勇,等.壬基酚聚氧乙烯醚暴露下赤子爱胜蚓(Eisenia foetida)的生理损伤 [J]. 生态与农村环境学报, 2013,29: 749-754.
[7] Wang Z, Yang Y, Sun W, et al. Nonylphenol biodegradation in river sediment and associated shifts in community structures of bacteria and ammonia-oxidizing microorganisms [J]. Ecotoxicology and Environmental Safety, 2014,106:1-5.
[8] Zhang Q M, Wang F F, Xue C H, et al. Comparative toxicity of nonylphenol, nonylphenol-4-ethoxylate and nonylphenol-10- ethoxylate to wheat seedlings (Triticum aestivum L) [J]. Ecotoxicology and Environmental Safety, 2016,131:7-13.
[9] Xu J, Li J M, Feng Z, et al. Neurotoxic effects of nonylphenol:a review [J]. Wiener Klinische Wochenschrift, 2013,125:61-70.
[10] Shao B, Hu J, Yang M, et al. Nonylphenol and nonylphenol ethoxylates in river water, drinking water, and fish tissues in the area of Chongqing, China [J]. Archives of Environmental Contamination and Toxicology. 2005,48:467-473.
[11] Priac A, Morin-Crini N, Druart C, et al. Alkylphenol and alkylphenol polyethoxylates in water and wastewater: a review of options for their elimination [J]. Arabian Journal of Chemistry, 2017,41:4511-4523.
[12] 胡雪雷,周静韵,段舜山.壬基酚与壬基酚聚氧乙烯醚对多刺裸腹溞的复合毒性效应 [J]. 生态环境学报, 2011,20:1725-1730.
[13] 鲍国芳,叶 琼,童珈珈,等.儿童服装中壬基酚聚氧乙烯醚的风险及管控 [J]. 印染, 2016,42:39-41.
[14] Cabaton N J, Wadia P R, Rubin B S, et al. Perinatal exposure to environmentally relevant levels of bisphenol A decreases fertility and fecundity in CD-1mice [J]. Environmental Health Perspectives, 2011, 119:547-552.
[15] 高明杰,张青树.环境内分泌干扰物与自身免疫性疾病 [J]. 医学信息(上旬刊), 2010,23:3260-3261.
[16] Jin X W, Wang Y Y, Jin W, et al. Ecological Risk of Nonylphenol in China Surface Waters Based on Reproductive Fitness [J]. Environmental Science & Technology, 2014,48:1256-1262.
[17] 刘晓丽,汪 奇,贾林芝,等.壬基酚对斑马鱼精巢组织及性激素合成酶基因表达的影响 [J]. 环境科学学报, 2011,31:2523-2529.
[18] Metcalfe C D, Metcalfe T L, Kiparissis Y, et al. Estrogenic potency of chemicals detected in sewage treatment plant effluents as determined by in vivo assays with Japanese medaka (Oryzias latipes) [J]. Environmental Toxicology and Chemistry, 2001,20:297-308.
[19] Organization for Economic Co-operation and Development. 21-day Fish Assay:A Short-Term Screening for Oestrogenic and Androgenic Activity, and Aromatase Inhibition [S]. OECD guideline 230, Paris, France, 2009.
[20] Balch G, Metcalfe C. Developmental effects in Japanese medaka (Oryzias latipes) exposed to nonylphenol ethoxylates and their degradation products [J]. Chemosphere, 2006,62:1214-1223.
[21] 云 丹,刘晓丽,程乐华,等.双酚A对斑马鱼精巢性激素生成酶基因表达的影响 [J]. 生态毒理学报, 2014,9:81-89.
[22] 喻 亮.三种三唑类杀菌剂对斑马鱼的内分泌干扰效应研究 [D]. 杭州:浙江大学, 2013.
[23] Jie Hou, Li Li, Ning Wu, et al. Reproduction impairment and endocrine disruption in female zebrafish after long-term exposure to MC-LR: A life cycle assessment [J]. Environmental Pollution, 2016, 208:477-485.
[24] Okuzawa K, Gen K, Bruysters M, et al. Seasonal variation of the three native gonadotropin-releasing hormone messenger ribonucleic acids levels in the brain of female red seabream [J]. General and Comparative Endocrinology, 2003,130:324-332.
[25] Ji K, Hong S, Kho Y, et al. Effects of Bisphenol S Exposure on Endocrine Functions and Reproduction of Zebrafish [J]. Environmental Science & Technology, 2013,47:8793-8800.
[26] Liu X S, Ji K, Jo A,et al. Effects of TDCPP or TPP on gene transcriptions and hormones of HPG axis, and their consequences on reproduction in adult zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2013,134-135:104-111.
[27] Bogerd J. Ligand-selective determinants in gonadotropin receptors [J]. Molecular and Cellular Endocrinology, 2007,260-262:144-152.
[28] Ji K, Liu X, Lee S, et al. Effects of non-steroidal anti-inflammatory drugs on hormones and genes of the hypothalamic-pituitary-gonad axis, and reproduction of zebrafish [J].Journal of Hazardous Material, 2013,254:242-251.
[29] Han X B, Lei E N, Lam M H, et al. A whole life cycle assessment on effects of waterborne PBDEs on gene expression profile along the brain-pituitary-gonad axis and in the liver of zebrafish [J]. Marine Pollution Bulletin, 2011,63:160-165.
[30] Zhao Y, Xie L, Yan Y. Microcystin-LR impairs zebrafish reproduction by affecting oogenesis and endocrine system [J]. Chemosphere, 2015, 120:115-122.
[31] Fernandes D, Schnell S, Porte C. Can pharmaceuticals interfere with the synthesis of active androgens in male fish? an in vitro study [J]. Marine Pollution Bulletin, 2011,62:2250-2253.
[32] Baudiffier D, Hinfray N, Vosges M, et al. A critical role of follicle-stimulating hormone(Fsh) in mediating the effect of clotrimazole on testicular steroidogenesis in adult zebrafish [J]. Toxicology, 2012,298:30-39.
Effects of nonylphenol ethoxylate exposure on genes expression along HPG axis of adult male zebrafish.
JIANG Jin-lin1*, LIU Ren-bin1,2, ZHANG Yu-feng2, LIANG Xia1, SHAN Zheng-jun1
(1.Key laboratory of Pesticide Environmental Assessment and Pollution Control, Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China;2.College of Environment, Nanjing Technology University, Nanjing 210009, China)., 2018,38(8):3135~3142
In the present study, the semi-static exposure test method was used for elucidating the effects of different concentrations of nonylphenol polyethylene glycol ether (NPEO) on the hypothalamic-pituitary-gonadal axis (HPG axis) of adult male zebrafish (). The results showed that the expressions of,,,,andgenes in the brain, as well as the expression ofgene in the testis of zebrafish were significantly up-regulated under the exposure of NPEO at the experimental concentrations. The expressions ofandgenes were sensitively to the NPEO exposure at relatively low concentrations and the most sensitive biomarkers were the expressions ofandgenes, which were significantly induced under the exposure to 0.001mg/L of NPEO. The expression ofgene was significantly inhibited in the testis of fish exposed to NPEO at 0.1 and 10mg/L NPEO and on the contrary, the expression ofgene was significantly induced in the 10mg/L of NPEO group. Up-regulation ofgene indicated that the exposure to NPEO could induce the secretion ofin the hypothalamus and stimulate the secretion ofin the pituitary of zebrafish in turn. The exposure to NPEO could promote the synthesis of endogenous estrogen in zebrafish by up-regulating the expression ofgene and inhibit the synthesis of testosterone (T) by down-regulating the expression ofgene, and therefore disrupt the sexual hormone homeostasis in zebrafish. The increased levels of estrogen in the testis of zebrafish could produce the negative feedback to the pituitary gland and then stimulated the secretion ofin the pituitary, suggesting that NPEO at the experimental concentrations (0.001~10mg/L) could affect the feedback regulation of the HPG axis in male adult zebrafish.
nonylphenol ethoxylate;male zebrafish;endocrine disrupting effects;HPG axis
X592
A
1000-6923(2018)08-3135-08
姜锦林(1984-),男,浙江温州人,副研究员,博士,主要从事污染生态毒理学研究.发表论文30余篇.
2018-01-05
国家科技重大专项项目(2017ZX07602-002)
* 责任作者, 副研究员, jjl@nies.org

