人参Cu/Zn SOD原核可溶性表达条件的优化
高云鹏,赵 雨,王思明,刘美辰,王佳雯
(长春中医药大学中医药与生物工程研究开发中心,长春 130117)
目前,多个物种的Cu/Zn SOD已经被克隆出来,并在大肠杆菌、酵母、烟草和昆虫细胞等系统中得到了表达[1-11]。人参SOD广泛应用于多个领域,尤其是化妆品行业。人参Cu/Zn SOD基因已经被发现并且在大肠杆菌中完成了表达,但是大部分蛋白是以包涵体形式存在的,给纯化带来了一定的困难[12]。本次研究通过优化诱导条件和诱导成分,获得了可溶性表达的人参SOD蛋白,表达率略高于文献,可溶性表达可以是纯化过程简化,省略了变性复性过程,保持蛋白天然构象和活性,未纯化的粗酶即有SOD的活性,为大规模生产人参SOD重组蛋白及研究人参SOD生物学功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 原核表达载体pET-30α、pMD18T-pgSOD质粒由本实验室保存。 E.coli DH5α菌株、E.coli BL21菌株购自碧云天公司,保存于- 80 ℃。限制性内切酶、DNA连接酶、胶回收试剂盒及质粒提取试剂盒等购自TaKaRa公司;
1.1.2 试剂 IPTG购自Sigma;SOD检测试剂盒购自南京建成;其他生化试剂均为国产分析纯或进口分装试剂。
1.1.3 仪器 离心机(eppendorf centrifuge 5804R-德国),全自动蛋白质分离纯化系统(AKTA start,美国),蛋白电泳仪(Power Pac-美国),摇床(IKA.KI4000-美国)。1.1.4 培养基 蛋白胨(OXOID-英国),酵母粉(OXOID-英国)。
1.2 pET-30α-pgSOD的构建和鉴定 pMD18T-pgSOD质粒和pET-30α经Not I和Nco I双酶切后胶回收,在16 ℃连接过夜。转化感受态DH5α细胞,接种卡那抗性的LB固体培养基,37 ℃条件下过夜培养,挑取单克隆,提取质粒后进行酶切鉴定。
1.3 重组人参SOD蛋白的诱导表达 测序正确的pET30α-pgSOD质粒转化感受态BL21细胞,接种卡那抗性的LB固体培养基,37 ℃条件下过夜培养,挑取单克隆,培养过夜后,按照1:100比例转接于100 mL培养基在37 ℃条件下扩大培养,待OD值达到0.6~0.8时,加入1 mmol/L IPTG及1.2 mmol/L CuSO4,0.25 mmol/L ZuSO4进行诱导,37 ℃条件下培养6 h。培养基在4 000 r/min条件下离心30 min,菌体使用20 mmol/L Tris-Cl(pH 8.0)重悬,冰浴条件下超声5 s,停5 s,共30 min。8 000 r/min离心30 min,获得破碎上清。
1.4 重组人参SOD蛋白诱导条件的优化
1.4.1 诱导温度对蛋白质可溶表达的影响 参考1.3项下,其余条件不变,诱导剂加入后于37、30、25 ℃继续培养,完成诱导后收集菌体,超声破碎后分别取上清和沉淀,通过SDS-PAGE分析蛋白质表达情况。
1.4.2 加入IPTG浓度对蛋白质可溶表达的影响 参考1.3项下,其他条件不变,OD值达到0.6~0.8时,分别加入0.5、1、1.5 mmol/L IPTG,诱导后收集菌体,超声破碎后分别取上清和沉淀,SDS-PAGE分析蛋白质表达情况。
1.4.3 诱导时间对蛋白质可溶表达的影响 参考1.3项下,其他条件不变,加入诱导剂后分别培养6、12、18、24 h,收集菌体,超声破碎后分别取上清和沉淀,SDS-PAGE分析蛋白质表达情况。
1.4.4 不同离子浓度对蛋白质可溶表达及酶活的影响 参考1.3项下,其他条件不变,诱导时分别加0、0.5、1.2、3 mmol/L CuSO4溶液,诱导后收集菌体,超声破碎后分别取上清和沉淀,SDS-PAGE分析蛋白质表达情况。参考1.3项下,其他条件不变,诱导时加0、0.03、0.1、0.25 mmol/L ZnSO4溶液,诱导后收集菌体,超声破碎后分别取上清和沉淀,SDS-PAGE分析蛋白质表达情况。
1.4.5 离子加入时机对蛋白质可溶表达及酶活的影响 参考1.3项下,其余条件不变,分别在培养基中,IPTG诱导时加入Cu2+和Zn2+,并设置不加离子的对照组,比较各条件下上清中的SOD活力差异。
1.5 SOD活力的鉴定 采用黄嘌呤氧化酶法测定目的蛋白的活力,按照试剂盒说明书完成实验,活力计算公式:总SOD活力(U/mg)=(对照OD值-测定
OD值)/对照OD值÷ 50%×反应液总体积(mL)/取样量(mL)÷待测样本蛋白浓度(mg/mL)。
2 结果
2.1 原核表达载体 PET-30α-pgSOD双酶切鉴定pMD 18T-pgSOD质粒和PET-30α双酶切后连接过夜,重组质粒经Not I和Nco I双酶切鉴定,在5 000 - 7 000 bp和500 bp两处可见特异性条带,提示目的片段成功插入到PET-30a载体中。
2.2 重组人参SOD蛋白的可溶性表达 通过SDSPAGE分析结果,与诱导前相比,诱导后的转化菌在20~26 kDa处有明显的特异性蛋白条带,大小与理论值相符,应该为SOD蛋白。其中部分目的蛋白以可溶形式表达,部分在包涵体中。
2.2.1 诱导温度优化 根据对不同诱导温度下蛋白表达情况的比较,结果表明,25 ℃时目的蛋白表达量最高,且可溶性最好。
2.2.2 IPTG浓度优化 IPTG作为目的蛋白诱导剂,浓度过低不利于成功诱导,浓度过高会对菌体生长有抑制作用。通过对IPTG最佳诱导浓度的摸索,结果当终浓度为0.5 mmol/L时,目的蛋白上清中表达量最大。
2.2.3 诱导时间优化 根据对不同诱导时间下蛋白表达情况的比较,在诱导6 h时,上清中目的蛋白已经得到了较好的表达,沉淀中目的蛋白较少,随着诱导时间的延长,虽然目的蛋白总量增加,但上清中的目的蛋白量没有变化甚至减少,增加的表达量均在沉淀中。到诱导24 h时,杂蛋白的量提高,绝大部分目的蛋白均以包涵体形式表达在沉淀中。因此6 h为最佳诱导时间。
2.2.4 离子浓度优化 由于人参Cu/Zn SOD需要结合金属离子才能发挥歧化酶作用,同时在金属离子存在的情况下能够提高蛋白折叠的正确率,增加蛋白可溶性。然而,金属离子也具有一定的毒性,添加过多会导致菌体生长减慢甚至死亡,因此需要摸索Cu2+、Zn2+离子的添加浓度,结果当Cu2+和Zn2+的离子浓度为0.5 mmol/L 和0.1 mmol/L时,蛋白的可溶性最好,并且较少影响菌体生长。
2.2.5 离子加入时机优化 金属离子的添加方式对酶活也具有一定影响,在诱导的同时加入Cu/Zn离子,所表达的蛋白酶活达到最高,达到363.9 U/mL,在培养基中加入离子也能提高酶活,为339.9 U/mL,超过不添加金属离子的试验组,139.6 U/mL。见表1。
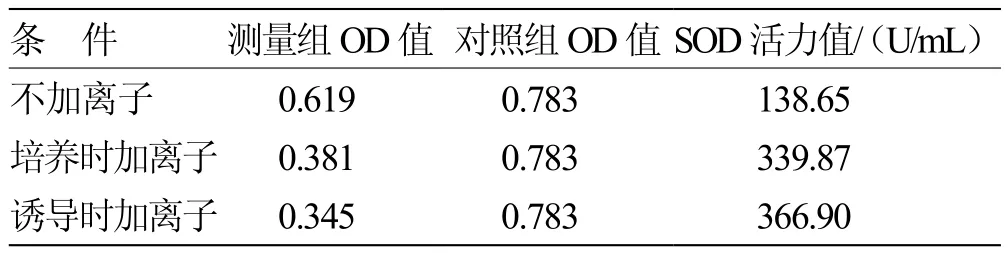
表1 离子加入时机优化表
3 小结
本研究采用pET30a原核表达载体进行人参SOD的重组表达,pET系统在大肠杆菌中表达水平最高,调控最为严谨,表达周期短,能快速获得结果,保证人参SOD的高效表达。重组蛋白的大肠杆菌中高水平表达时经常导致蛋白聚集,形成不可溶的,无活性的包涵体,为了解决这一问题,笔者参照文献[13],采用在诱导时加入金属离子,提高蛋白表达后折叠的正确率,以可溶的有活性的形式表达出来。同时,通过对诱导时间、诱导温度和最佳诱导剂浓度的摸索,使目的蛋白达到了最高表达量,成功优化了诱导条件。
本研究构建了人参Cu/Zn SOD原核表达载体,通过一系列条件优化,成功实现了人参SOD的可溶性表达,表达量高,上清活力约为363.9 U/mL。为人参SOD的纯化及今后大规模生产和工业化应用奠定了基础。

