p16,Ki67,CK8、17在CIN及宫颈鳞癌中的临床表达及病理意义
张力忆 蒋奉希 桂定清
宫颈浸润性鳞状细胞癌一般由上皮内瘤变演变而来,潜伏期较长,是1种常见的女性恶性肿瘤。p16作为1种抑癌基因,基本在所有的宫颈癌及病变中表达,控制细胞的生长和分化,参与肿瘤的形成和发展[1-2]。Ki67抗原是1种与细胞增殖有关的核内蛋白,可用来判断细胞增殖情况。细胞角蛋白其细胞分化状态、生理和病理环境等影响着角蛋白性质的表达方式,研究其在宫颈上皮内瘤变病变中的表现形式,可以作为研究其病症原理和诊断治疗的角度[3]。本研究运用免疫组织化学技术法检测P16、Ki67、细胞角蛋白8、17在宫颈上皮内瘤变和浸润性鳞状细胞癌中的表达,探讨其临床诊断价值。
1 材料与方法
1.1 一般资料
选取2015年1月至2017年1月本院宫颈活检病例250例,患者年龄26~74岁,平均年龄(46.8±3.6)岁,其中宫颈上皮内瘤变125例(1级60例,2~3级65例)、浸润性鳞状细胞癌65例、以正常宫颈组织60例作为对照。全部病例由3位经验丰富的病理医生确诊。
1.2 纳入及排除标准
纳入标准:宫颈细胞正常或癌变患者;患者年龄25~75岁;研究对象均知情同意。排除标准:宫颈细胞是否正常或癌变难以确认;患者年龄<25岁或>75岁。
1.3 方法
1.3.1 试剂选取 采用型鼠抗人p16,Ki67,细胞角蛋白8、17单克隆抗体和免疫组织化学技术,结合EnVion两步法[4]按照药剂使用指示进行免疫组织化学技术操作。
1.3.2 操作步骤 制作5张5 μm石蜡标本切片,一定处理后使切片紧附在载玻片上,其中4张分别进行p16、Ki67、细胞角蛋白8、17的免疫组织化学技术染色;1张HE染色,核实病理诊断[5]。再经过一定处理后,滴加一抗鼠抗人p16、Ki67、细胞角蛋白8、17单克隆抗体50 μl,特殊处理后[6]。经冲洗、复燃、脱水、透明后封片。
1.4 标准判定
1.4.1 p16阳性判定 p16以细胞核或细胞质中出现棕黄色颗粒为阳性表达。p16阳性细胞数<13%为(-);局限在鳞状上皮中下1/4层为(+);超过鳞状上皮中下1/4层而未超过中下3/4层的阳性表达为(++);高于鳞状上皮的3/4层表达为(+++)[7]。
1.4.2 Ki67阳性判定 Ki67以细胞核内出现棕黄色颗粒为阳性表达。Ki67阳性细胞百分率计算值是阳性细胞数与计数细胞总数的比值,若阳性细胞表达<6%为(-),阳性细胞数6%~28%为(+);>28%~78%为(++);>78%为(+++)。
1.4.3 细胞角蛋白8、17阳性判定 细胞角蛋白8、17都以细胞质内出现棕黄色颗粒为阳性表达。等级分配按照阳性在同类细胞中所占百分比。无着色(-);阳性细胞、<7%为(+);>7%~57%为(++);>57%~77%为(+++);>77%为(++++)。
1.5 统计学方法
采用SPSS 13.0处理数据,计数资料使用χ2检验,一致性分析采用Kappa系数检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 宫颈病变组织p16表达情况
p16分布范围和表达范围均为细胞核与细胞质,在宫颈上皮内瘤变中存在阳性分层表达现象。浸润性鳞状细胞癌变组织中,p16强阳性表达在病变部位,且随着病变等级的升高而加强。正常宫颈组的阳性表达率为0%,宫颈上皮内瘤变低级组的阳性表达为63.3%,高级组为100.0%,浸润性鳞状细胞癌中表达为100.0%。宫颈上皮内瘤高级组与浸润性鳞状细胞癌p16阳性率差异无统计学意义(χ2=7.796,P=0.005);正常组与高级组、低级组均有统计学差异[(χ2=7.796,P=0.005)(χ2=44.110,P=0.000)];高级组与低级组也有统计学差异(χ2=7.596,P=0.000),正常组与鳞癌组有统计学差异(χ2=45.021,P=0.000)。见表1。
2.2 宫颈病变组织Ki67表达情况
Ki67阳性主要在细胞核上表达,其病变部位与阳性表达部位基本一致,且伴随病变级别升高而增加。高级别组与浸润性鳞状癌细胞阳性率大体一致,无明显差异(χ2=7.896,P=0.005);正常组与高级别组、低级别组有统计学差异[(χ2=44.110,P=0.000)、(χ2=44.121,P=0.000)];高级别组与低级别组也有差异(χ2=7.596,P=0.006),表达情况见表1。
2.3 宫颈病变组织细胞角蛋白8表达情况
细胞角蛋白8阳性在细胞质中,为淡黄色或棕黄色颗粒,其在宫颈上皮内瘤和浸润性鳞状细胞癌中有明显差异的表达情况,但其表达强度也随病变级别升高而增加。正常组与高级别组有统计学差异(χ2=4.110,P=0.000);低级别与浸润性鳞状细胞癌组相比也有统计学差异(χ2=7.786,P<0.005)。见表1。
2.4 宫颈病变组织细胞角蛋白17表达情况
细胞角蛋白17的阳性表达情况,以黄色颗粒分布在细胞质中。正常组与高级组别相比有统计学差异(χ2=44.110,P=0.000),与浸润性鳞状细胞癌组也有统计学差异(χ2=45.121,P=0.000)。高级组别与低级组别也有统计学差异(χ2=7.746,P=0.006)。见表1。
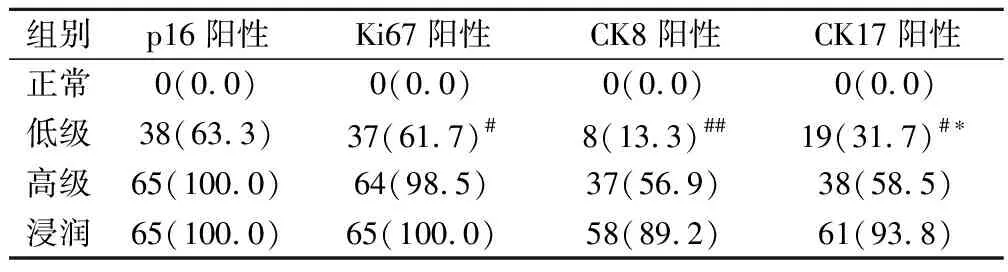
表1 p16、Ki67、CK8、CK17在宫颈组织中的阳性表达(例,%)
注:与高级组、浸润组比较,低级组*为P<0.05,#为P<0.05,##为P<0.05,#*为P<0.05。
3 讨论
宫颈癌是常见的威胁女性健康的恶性肿瘤之一,有极高的发病率和死亡率,且发病年龄有年轻化趋势,已然成为危害女性健康的第二大恶性肿瘤[8]。宫颈上皮内瘤变及浸润性鳞状细胞癌是由宫颈经过不典型增生(轻→中→重)→原位癌→早期浸润癌→浸润癌的一系列变化导致的[9-10]。根据宫颈浸润性鳞状细胞病变状态与p16、Ki67、细胞角蛋白8、17的阳性表现情况,判断宫颈上皮内瘤病变情况、浸润性鳞状细胞癌增殖状态,鉴别宫颈良恶性病变,并及时进行相关治疗[11-13]。
该研究采用免疫组织化学法进行,是通过标记抗体与特异性抗原反应显色的组织化学法,主要检测细胞内多肽、蛋白质等大分子物质,特异性强、敏感度高,广泛运用于生物学和医学研究。该研究结果显示:p16、Ki67、细胞角蛋白8、17蛋白阳性表达呈正相关,且都与宫颈浸润性鳞状细胞病变直接相关。p16分布范围和表达范围均为细胞核与细胞质,在宫颈上皮内瘤变中存在阳性分层表达现象;Ki67阳性主要在细胞核上表达,其病变部位与阳性表达部位基本一致,且伴随病变级别升高而增加;细胞角蛋白8、17阳性在细胞质中,为淡黄色或棕黄色颗粒,其在宫颈上皮内瘤和浸润性鳞状细胞癌中有明显差异的表达情况,但其表达强度也随病变级别升高而增加[14-15]。有学者表明,Ki67与p16的染色强度与病毒负荷量有关,初步说明了高病毒负荷量是导致宫颈病变进度的机制,但其他病因和机制有待下一步研究发现。
综上所述,p16、Ki67、细胞角蛋白8、17的阳性表达情况直接反映了宫颈浸润性鳞状细胞病变情况,这4个指标联合可用于辅助宫颈癌及癌前病变的早期诊治。本实验研究不足之处在于操作过程较为繁琐,且4项指标的阳性表达率偏为主观,存在实验操作误差。对于宫颈癌的研究需再进一步深入,探究宫颈癌辩证分型与浸润转移的相关性,用中医辩证思维联系宫颈癌的生物学行为,提高治疗宫颈癌水平。

