噬菌体复配抑菌剂对三文鱼中沙门氏菌的抑制与保鲜作用
江艳华,许东勤,2,姚 琳,李风铃,朱文嘉,郭莹莹,张 媛,王联珠※
(1. 中国水产科学研究院黄海水产研究所, 农业农村部水产品质量安全检测与评价重点实验室,青岛 266071;2. 上海海洋大学食品学院,上海 201306;3. 獐子岛集团股份有限公司,大连 116001)
0 引 言
水产品因其味道鲜美和高营养价值深受广大消费者的青睐,然而,由于特殊的生长环境以及加工过程中与其他物品的接触,水产品不可避免地存在微生物的污染。水产品具有高水分、高蛋白等营养特点,如果储存不当,其中的微生物往往会滋生,从而导致产品腐败,缩短货架期,如果污染了食源性致病菌,会对人类健康造成严重危害,对国家造成巨大的经济损失。尤其像三文鱼等主要以生食为主的海产品,更是高风险的食品[1]。因此,水产品的安全控制与防腐保鲜尤为重要。
目前,水产品中常用的抑菌剂包括茶多酚、壳聚糖、ε-聚赖氨酸、乳酸链球菌素(nisin)、双乙酸钠、山梨酸钾等[2],这些抑菌剂抑菌机理各不相同,单独使用并不能达到最佳效果,尤其在控制某种致病菌方面靶向性差。噬菌体(bacteriophage或phage)的发现及其在食品中的应用,丰富了抑菌剂的种类,更为食品安全提供了一种安全、高效和靶向性强的生物抑菌剂[3]。噬菌体是细菌的病毒,在自然界中含量丰富,其中裂解性噬菌体在繁殖过程中能裂解并杀死宿主菌。2006年美国食品药品管理局批准了一种噬菌体混合物作为食品添加剂用于李斯特氏菌的控制[4],此后,噬菌体在食品安全领域的应用报道越来越多[5-12]。然而,噬菌体的宿主特异性限制了其应用范围,有研究报道表明,噬菌体与其他抑菌剂复配比二者单一使用能更有效地控制病原菌,同时还可抑制其他腐败菌的生长,达到对食品防腐保鲜的作用[13-15]。
沙门氏菌(Salmonella)是重要的食源性致病菌之一,能引起人类急性肠胃炎,出现腹泻、腹痛、发烧和呕吐等症状,其中引起食物中毒的主要为鼠伤寒沙门氏菌和肠炎沙门氏菌[16]。沙门氏菌在环境中广泛存在,畜禽肉、蛋、水产品等都可能携带该菌,因此,沙门氏菌是多数食品必检项目,并被规定不得检出。在中国,由沙门氏菌引起的微生物中毒事件位居第二,但导致的发病人数最多[17]。本研究以沙门氏菌作为靶致病菌,通过筛选能与噬菌体SLMP1复配的抑菌剂,并将复配抑菌剂应用于生三文鱼中,评价其对沙门氏菌和腐败的控制效果,以期为水产品的质量安全控制提供新的技术手段。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
沙门氏菌为鼠伤寒沙门氏菌(SalmonellaTyphimurium),购自美国典型微生物保藏中心,编号为 ATCC14028。
噬菌体SLMP1由本实验室从贝类样品中分离得到,能裂解鼠伤寒沙门氏菌和部分肠炎沙门氏菌,前期对其生物学特性进行了分析[18]。
1.1.2 样品
生三文鱼购自青岛当地超市,试验前测定样品中沙门氏菌的污染情况,无沙门氏菌检出方可用于试验。在低温条件下无菌操作将样品切成约3 cm×5 cm的片状(约10 g),备用。
1.1.3 培养基及试剂
营养肉汤、营养琼脂、木糖赖氨酸脱氧胆酸钠(xylose lysine deoxycholate,XLD)琼脂、磷酸盐缓冲液,北京陆桥生物技术有限公司;营养琼脂半固体培养基,为营养肉汤中添加 0.75%琼脂配制而成;壳聚糖(脱乙酰度80.0%~95.0%)国药集团化学试剂有限公司;ε-聚赖氨酸(纯度≥95%),浙江银象生物技术有限公司;乳酸链球菌素(nisin,活力>1 000 IU/g),浙江银象生物技术有限公司;茶多酚(多酚含量≥98%),天津希恩思生化科技有限公司;双乙酸钠、山梨酸钾(纯度99%),阿拉丁生化科技股份有限公司;EDTA(乙二胺四乙酸二钠),纯度>99%,索莱宝科技有限公司;三氯乙酸、硼酸 国药集团化学试剂北京有限公司;SM缓冲液(5.8 g NaCl,2 g MgSO4·7H2O,50 mL 1 mol/L pH 值 7.5 Tris-HCl,5 mL 2%明胶溶液)。
1.2 仪器与设备
SpectraMax i3x酶标仪,美国Molecular Devices公司;麦氏浊度仪,法国生物梅里埃公司;分光光度计,尤尼柯(上海)仪器有限公司;高压蒸汽灭菌器,日本SANYO公司;恒温培养振荡箱,上海智城分析仪器制造有限公司;生化培养箱,日本SANYO公司;生物安全柜,美国NUAIRE公司。
1.3 方法
1.3.1 不同抑菌剂对沙门氏菌的最小抑菌浓度(minimum inhibitory concentration,MIC)测定
将沙门氏菌培养至麦氏浓度约 1.0,即约 2×108cfu/mL,然后稀释至2×104cfu/mL。抑菌剂的选择与配制参考GB 2760-2014《食品安全国家标准 食品添加剂使用标准》[2],最高测定浓度比标准规定限量适当升高,即壳聚糖 6.0 mg/mL、茶多酚 1.2 mg/mL、ε-聚赖氨酸1.0 mg/mL、nisin 2.0 mg/mL、EDTA 4.0 mg/mL、nisin+EDTA 0.5 mg/mL+4.0 mg/mL、山梨酸钾4.0 mg/mL、双乙酸钠4.0 mg/mL,其中EDTA作为细胞膜通透剂与nisin复配使用。将抑菌剂进行倍比稀释,共稀释 10次,取100μL浓度为2×104cfu/mL沙门氏菌与对应的各稀释度的抑菌剂100μL混匀,36 ℃培养24 h,采用酶标仪测定菌液在600 nm处的吸光值,以沙门氏菌不生长的最低浓度为抑菌剂的MIC值。
1.3.2 不同抑菌剂对噬菌体SLMP1稳定性的影响
配制最高试验浓度的抑菌剂溶液,分别与噬菌体SLMP1(终浓度为1×108pfu/mL)混合,置于36 ℃培养48 h,测定噬菌体效价。对照采用无菌水替代抑菌剂溶液。噬菌体效价的测定采用双层平板法,即对噬菌体悬液进行10倍梯度稀释,取100μL适当浓度悬液与200μL培养至对数期的沙门氏菌悬液混合,然后加入5 mL溶解后在50 ℃下保温的营养琼脂半固体培养基,充分混匀后倒入营养琼脂平板,待培养基凝固、表面水分晾干后在36 ℃下培养18~24 h,计数平板上噬菌斑数,从而计算噬菌体效价[19]。
1.3.3 噬菌体与其它抑菌剂复配在生三文鱼中的应用
1)样品处理:参照萨姆布鲁克《分子克隆实验指南(第三版)》[20]的方法制备高浓度噬菌体悬液(约 1011pfu/mL),然后稀释成适宜的使用浓度。每片生三文鱼表面接种100μL 1×106cfu/mL的沙门氏菌悬液,放置10 min让其充分吸收。取250μL抑菌剂(单用和复配,见表1)添加至人工污染了沙门氏菌的三文鱼片表面。将处理好的样品置于无菌封口袋中,于(4±1)℃下贮藏,分别在贮藏3、7、10和14 d时取样进行菌落总数、沙门氏菌、噬菌体效价以及挥发性盐基氮(TVB-N)的测定。每个试验组设3个平行,并重复2次。
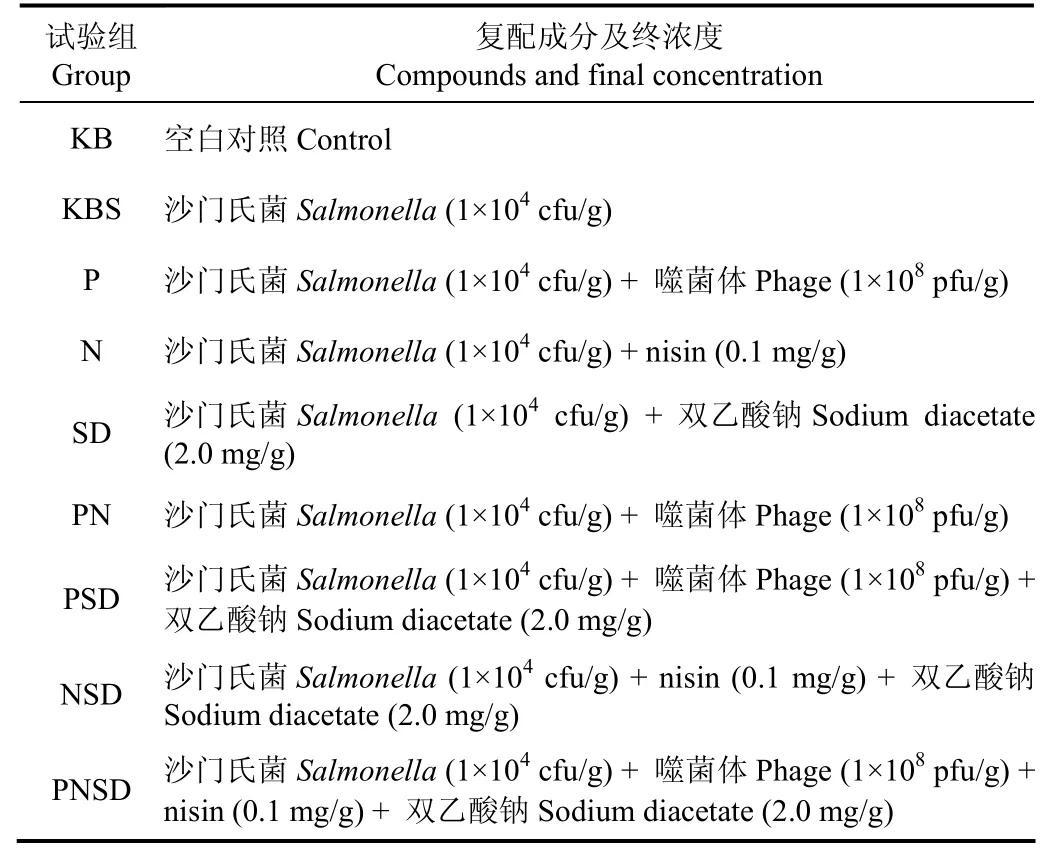
表1 噬菌体与抑菌剂复配应用表Table 1 Application of bacteriophage and other bacteriostatic agents
2)沙门氏菌的计数:将10 g样品加入90 mL磷酸盐缓冲液中,均质,制成1∶10样品匀液。为了避免噬菌体对沙门氏菌的干扰,取10 mL样品匀液,8 000 r/min离心10 min,沉淀重悬于10 mL磷酸盐缓冲液中,取100μL涂布XLD琼脂平板;对于菌浓度极低的样品,将10 mL匀液沉淀重悬于1 mL磷酸盐缓冲液中,涂布3块平板(检出限为1 cfu/g)。在36 ℃培养18~24 h,计数平板上典型沙门氏菌菌落数,从而计算样品中沙门氏菌含量[21]。
3)菌落总数的测定:按2)方法制成1∶10样品匀液,取10 mL匀液,8 000 r/min离心10 min,沉淀重悬于10 mL磷酸盐缓冲液中,进行10倍梯度稀释,取100μL适当浓度稀释液涂布营养琼脂平板;对于菌落总数较低的样品,则将沉淀重悬于1 mL磷酸盐缓冲液中,取100μL涂布营养琼脂平板。将平板置于30 ℃培养72 h,计数平板上菌落数,从而计算样品中的菌落总数。
4)TVB-N值的测定:TVB-N值的测定参照 GB 5009.208-2016《食品安全国家标准 食品中挥发性盐基氮的测定》[22]。即取(10± 0.001)g均质样品,加入50.0 mL三氯乙酸溶液振摇1 min,静置15 min待蛋白沉淀后过滤,采用凯氏定氮仪进行蒸馏,10 mL硼酸加5滴指示剂用于接收蒸馏液,最后以盐酸标准滴定溶液(0.010 mol/L)滴定至终点。
5)噬菌体效价的测定:将2)中1∶10样品匀液离心后的上清液用于噬菌体效价的测定,方法参照1.3.2。
1.3.4 数据分析
试验结果以平均值±标准偏差表示。采用 T检验对数据的差异性进行统计分析,P<0.05表示差异性显著。
2 结果与分析
2.1 不同抑菌剂的MIC值
本研究以沙门氏菌作为靶细菌,分析各种抑菌剂对其抑制效果,表 2为不同抑菌剂对沙门氏菌的最小抑菌浓度。
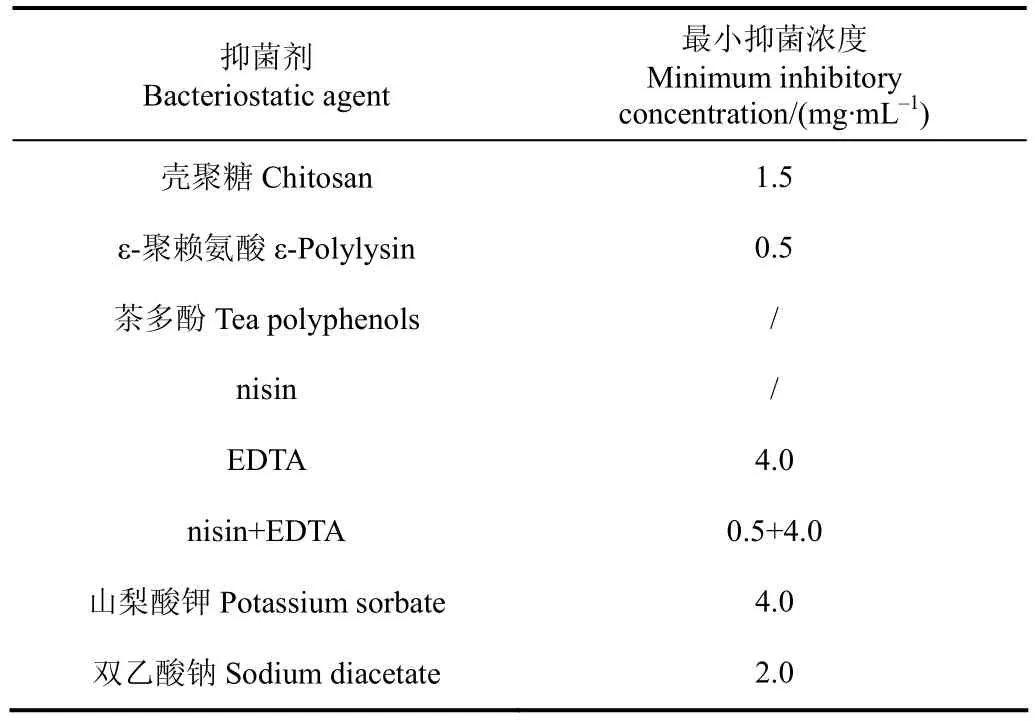
表2 不同抑菌剂对沙门氏菌的最小抑菌浓度Table 2 Minimal inhibitory concentration of different bacteriostatic agents against Salmonella
在所测试的浓度范围为,壳聚糖、ε-聚赖氨酸、EDTA、nisin+EDTA对沙门氏菌有抑制作用,而茶多酚和 nisin对沙门氏菌没有抑制作用。壳聚糖 MIC值为1.5 mg/mL,ε-聚赖氨酸为 0.5 mg/mL,EDTA 为4.0 mg/mL,nisin+EDTA为0.5 mg/mL+4.0 mg/mL,山梨酸钾为4.0 mg/mL,双乙酸钠为2.0 mg/mL。其中ε-聚赖氨酸和山梨酸钾的MIC超过了GB 2760《食品安全国家标准 食品添加剂使用标准》中的允许使用限值(0.25和1.0 mg/g)[2]。虽然有研究证明当茶多酚浓度为8 mg/mL时三文鱼片有明显保鲜作用[23],但这已经超过国家标准规定的允许使用限值0.3 mg/g[2]。ε-聚赖氨酸抑菌谱广,对大部分革兰氏阴性菌和阳性菌、酵母菌和霉菌均具有较高的抑菌活性,是一种安全性高的生物抑菌剂,对海产品有较好的保鲜作用[24]。nisin通常能抑制大部分革兰氏阳性菌及其芽孢的生长,而对革兰氏阴性菌抑菌范围较窄[25]。本研究发现即使在细胞膜通透剂EDTA的作用下,也没有增加nisin对沙门氏菌的抑菌效果,据报道鼠伤寒沙门氏菌可以改变其脂糖层的组成和结构来减轻对它们的敏感性[26]。山梨酸钾和双乙酸钠能有效抑制霉菌和好养性细菌,在食品防腐保鲜中有广泛应用[27-28],然而山梨酸钾的抑菌效果不明显,而双乙酸钠的抑菌效果则较强。
2.2 噬菌体的稳定性
表 3为不同抑菌剂对噬菌体稳定性的影响作用。nisin、茶多酚、山梨酸钾和双乙酸钠对噬菌体没有显著影响。壳聚糖、ε-聚赖氨酸、EDTA能显著(P<0.05)降低噬菌体的效价,与对照组相比,噬菌体效价分别减少了3.9、1.5、4.0 lg pfu/mL,表明这些抑菌剂对噬菌体有较强的抑制作用。曾有报道 ε-聚赖氨酸对噬菌体有抑制作用,能使大肠埃希氏菌噬菌体失活, ε-聚赖氨酸对病毒的抑制作用最主要是由于聚赖氨酸中的赖氨酸单体数,赖氨酸单体数越高,抑菌活性越强[29]。此外,壳聚糖及其衍生物对噬菌体也有抑制作用,抑制作用与壳聚糖的氨基酸组成有关[30]。而其他抑菌剂对噬菌体的影响作用没有相关报道。
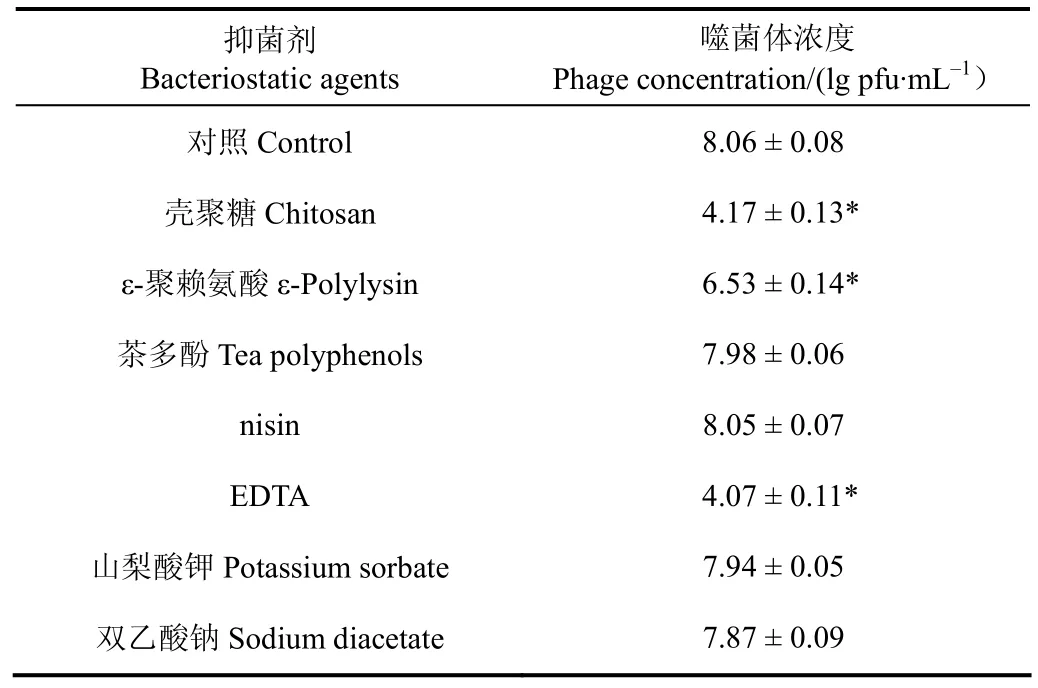
表3 不同抑菌剂对噬菌体稳定性的影响Table 3 Effect of bacteriostatic agents on stability of phage
2.3 噬菌体与其他抑菌剂复配在生三文鱼中的应用
2.3.1 抑菌剂的复配
在测定的抑菌剂中,壳聚糖、ε-聚赖氨酸能够抑制沙门氏菌的生长,同时在短期内对噬菌体有明显抑制作用,因此不能与噬菌体进行复配。山梨酸钾的MIC值超过了国家标准限量的规定[2],因而不做考虑。双乙酸钠MIC值在国家标准规定限值内、同时对噬菌体没有明显抑制作用,因此选择双乙酸钠作为与噬菌体复配的抑菌剂。此外,考虑到nisin能抑制革兰氏阳性菌,是一种安全高效、应用广泛的生物保鲜剂,以往的研究也发现其对水产品有一定保鲜作用[31],且对噬菌体没有抑制作用,因此选择nisin作为其中一种抑菌剂进行复配。噬菌体浓度参考前期的试验选择1×108pfu/g,双乙酸钠浓度选择对沙门氏菌的MIC值,由于抑菌剂以样品终浓度计(以往的报道多以浸泡液的浓度计),高浓度的nisin溶液很难配制,同时考虑到nisin的成本,本试验选择浓度为0.1 mg/g。
2.3.2 不同抑菌剂对沙门氏菌的抑制作用
图1为不同抑菌剂对沙门氏菌的抑制作用。用噬菌体处理的三文鱼片试验组(P,PN,PSD,PNSD)中沙门氏菌数量显著降低,其中P和PN组在3 d时降至1.0 lg cfu/g以下,随后渐趋于0.5 lg cfu/g,但不能完全消除沙门氏菌;而PSD和PNSD组在10 d后才降至1.0 lg cfu/g以下,PNSD组在14 d后低于检测限(1 cfu/g)。没有用噬菌体处理的N、SD和NSD组与对照KBS组数量接近,表明在样品中,nisin和双乙酸钠对沙门氏菌没有明显抑制作用,这与 Wan等[32]的报道结果一致,即 nisin(500 IU/mL)、EDTA(0.02 mol/L)、山梨酸钾(3%)复配剂在4 ℃下处理虾7 d后不能显著降低沙门氏菌数量。以往的研究表明噬菌体对海产品中沙门氏菌具有较强的控制作用,Galarce等[33]将沙门氏菌噬菌体分别用于生的和熏制的三文鱼片中,4和18 ℃时,生三文鱼片中肠炎沙门氏菌分别减少了2.82和3.19 lg cfu/g,熏制三文鱼中肠炎沙门氏菌分别减少了1.16和1.96 lg cfu/g。本研究的噬菌体对沙门氏菌的抑制作用比上述报道的更强。本试验使用的双乙酸钠在肉汤体系中能抑制沙门氏菌,而在样品中却没有明显抑制作用,推测可能是样品基质影响了双乙酸钠的抑菌活性。因此,虽然噬菌体裂解谱较窄,但其抑制靶细菌的效果是其他抑菌剂不能比拟的。
2.3.3 不同抑菌剂对菌落总数的影响
图 2为不同抑菌剂对菌落总数的影响作用。未用其他抑菌剂处理的样品(KB、KBS、P),菌落总数先增长后稳定在约6 lg cfu/g。只用噬菌体处理的样品菌落总数与对照组(KBS)相比,没有显著性降低,表明噬菌体不能抑制沙门氏菌外的其他细菌。而用其他抑菌剂处理的样品(N、SD、NSD、PN、PSD、PNSD)与KB、KBS、P组相比,都出现了不同程度的降低,其中SD和PSD组3 d后基本稳定在5.0~5.5 lg cfu/g;N和PN组3 d后稳定在4.5~5.0 lg cfu/g,与初始菌数基本一致。表明nisin和双乙酸钠能抑制样品中的其它细菌,与nisin复配的抑菌效果比与双乙酸钠复配的抑菌效果明显。海产品由于生存在水生环境,其中的菌群为海洋细菌,常见的特定腐败菌为假单胞菌、腐败希瓦氏菌、弧菌、嗜冷杆菌等[34],可能 nisin对其中的优势菌抑菌效果优于双乙酸钠。而NSD和PNSD组的数值则逐渐降低,14 d时PNSD组比只污染沙门氏菌的对照组(KBS)降低了2.5 lg cfu/g,抑菌效果最好。

图1 不同抑菌剂对沙门氏菌的抑制作用Fig.1 Inhibitory effect of different bacteriostatic agents on Salmonella

图2 不同抑菌剂对菌落总数的影响Fig.2 Effect of different bacteriostatic agents on total viable counts
2.3.4 不同抑菌剂对TVB-N值的影响
图3为不同抑菌剂对TVB-N值的影响作用。在低温储藏过程中,所有试验组的TVB-N值均逐渐升高,表明样品鲜度在缓慢下降,10 d内所有试验组TVB-N值均低于30 mg/100 g,14 d后KB、KBS、P和PN组的TVB-N值高于30 mg/100g。含有双乙酸钠的试验组SD、PSD、NSD、PNSD的TVB-N含量增长速度较慢,与对照组KBS相比,14 d时TVB-N质量分数分别减少了9.00、8.11、9.98、13.73 mg/100 g,其中PNSD组抑制TVB-N含量增长的效果最好。用双乙酸钠处理的 NSD、PNSD组的TVB-N含量变化趋势与菌落总数变化趋势一致,SD和PSD组的TVB-N含量比N组和PN组稍好,这与对菌落总数的抑制效果相反。虽然nisin对三文鱼中的总细菌有较强抑制作用,但可能双乙酸钠对特定腐败菌的抑制作用比nisin更好,从而使样品的 TVB-N含量更低。《GB 2733-2015 食品安全国家标准 鲜、冻动物性水产品》中规定了海水鱼的 TVB-N含量应小于或等于 30 mg/100g[35]。14 d后含有双乙酸钠的试验组的TVB-N含量仍低于腐败限值30 mg/100 g,其中噬菌体、nisin和双乙酸钠复配处理的样品TVB-N值最低。

图3 不同抑菌剂对TVB-N质量分数的影响Fig.3 Effect of different bacteriostatic agents on TVB-N mass fraction of samples
2.3.5 噬菌体在样品中的稳定性
图4为不同抑菌剂对噬菌体的影响作用。P和PN组噬菌体效价稳定,而PSD和PNSD组随着时间延长逐渐降低,14 d时与初始效价相比分别降低了 1.38、1.40 lg pfu/g。从中可以看出,双乙酸钠对噬菌体有抑制作用,时间小于3 d时抑制作用不显著(P> 0.05),随着处理时间的延长,抑制作用明显。虽然双乙酸钠在长时间作用时对噬菌体有一定抑制作用,但随着时间的增加,噬菌体、nisin和双乙酸钠复配组对沙门氏菌的抑制作用比其他组效果更好,同时保鲜作用最明显,因此双乙酸钠对噬菌体的抑制作用可以忽略。
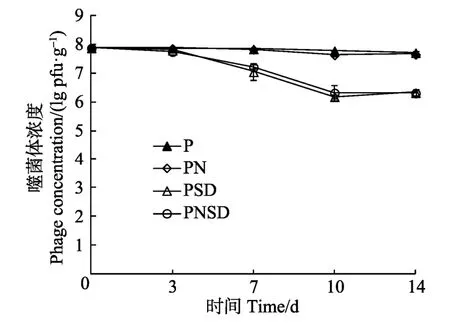
图4 不同抑菌剂对噬菌体的影响Fig.4 Effect of different bacteriostatic agents on phage
3 讨 论
以往的研究表明,噬菌体对致病菌的抑菌作用效果是明显的。然而,由于噬菌体是一种微生物,其安全性会引起人们的担忧。噬菌体分布极广,凡是有细菌的场所,就可能有相应噬菌体的存在。据估计,噬菌体的丰度是原核生物的 5~10倍左右,是自然界最丰富的生物体[36]。噬菌体是环境中的正常菌群,日常人们食用的生食或熟食品都能分离到噬菌体,不会对人体造成危害。东欧国家就一直研究和生产用于治疗疾病的噬菌体制剂,并没有关于噬菌体不良副作用的报道。此外,动物和人体试验均证明,噬菌体对动物和人体是安全的[37−39]。因此,噬菌体的安全性较高,可以作用食品添加剂使用。
目前,关于噬菌体与其他抑菌剂的复配研究报道很少,由于噬菌体是一种微生物,与其他抑菌剂复配后能否稳定存在、抑菌效果如何并不清楚,需要开展相关研究。研究结果发现,对沙门氏菌抑制效果较强的抑菌剂对噬菌体SLMP1有不同程度的抑制作用。由于噬菌体的特异性极强,因此只对沙门氏菌有抑制作用,发挥着靶向抑制食源性致病菌的目的,而nisin和双乙酸钠则对样品中其他细菌有抑制作用,发挥着防腐保鲜作用。噬菌体与 nisin、双乙酸钠复配后,对生三文鱼片中的沙门氏菌、菌落总数和TVB-N值均具有较强的抑制作用,保鲜效果优于各抑菌剂单独使用或两两复配。下一步可以通过分析样品中菌群结构的变化探讨复配抑菌剂的作用机理。
本实验室前期预试验验证了噬菌体SLMP1对生三文鱼中不同浓度沙门氏菌的作用,发现当噬菌体效价在 1×108pfu/mL,样品中102cfu/g的沙门氏菌能迅速降至检测限1 cfu/g以下。虽然本研究中样品中沙门氏菌在短期内无法将至检测限以下,但自然污染的样本中沙门氏菌的浓度一般要低于本试验设置的浓度,因此在实际应用中,噬菌体、nisin和双乙酸钠复配抑菌剂的作用效果将会更明显。本研究将为水产品的质量安全控制提供新的技术手段,下一步将通过开展不同致病菌的噬菌体与其他生物抑菌剂的复配作用研究,筛选更优的复配剂应用于水产品质量安全控制中。
4 结 论
本研究筛选获得能与沙门氏菌噬菌体SLMP1进行复配的抑菌剂nisin和双乙酸钠,将三者复配的抑菌剂应用于污染了沙门氏菌的生三文鱼片中,在低温贮藏条件下,复配抑菌剂与三者单独使用相比具有明显的抑菌优势:1)复配抑菌剂能显著降低样品中沙门氏菌的数量,14 d后沙门氏菌低于检测限1 CFU/g,其中噬菌体发挥着靶向抑制沙门氏菌的作用;2)复配抑菌剂能显著抑制样品中菌落总数的增长,14 d后与空白对照相比菌落总数减少了2.5 lg CFU/g,其中nisin对其他细菌的抑菌作用最强,噬菌体对沙门氏菌以外的细菌没有明显抑制作用;3)复配抑菌剂能显著抑制样品中TVB-N的增加,14 d后与空白对照相比TVB-N值降低了13.73 mg/100 g,其中双乙酸钠的抑制作用最强。结果表明,噬菌体、nisin及双乙酸钠复配剂在生三文鱼沙门氏菌控制及防腐保鲜中具有良好应用前景。
[1]Kim H W, Hong Y J, Jo J I, et al. Raw ready-to-eat seafood safety: Microbiological quality of the various seafood species available in fishery, hyper and online markets[J]. Letters in Applied Microbiology, 2017, 64(1): 27-34.
[2]中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品添加剂使: GB 2760-2014[S]. 北京: 中国标准出版社, 2014.
[3]Hagens S, Loessner M J. Bacteriophage for biocontrol of foodborne pathogens: Calculations and considerations[J].Current Pharmaceutical Biotechnology, 2010, 11 (1): 58-68.
[4]U. S. Food and Drug Administration. 2006. Food additives permitted for direct addition to food for human consumption:bacteriophage preparation[EB/OL]. http://edocket.access.gpo.gov/2006/E6-13621.htm.
[5]龙门,詹歌,金双潮,等. JS25噬菌体生物特性及对食品中致病菌的生物防治[J]. 农业工程学报,2016,32(22):303-308.Long Men, Zhan Ge, Jin Shuangchao, et al. Biological properties of bacteriophages and biocontrol ofStaphylococcus aureusin foods[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(22): 303-308. (in Chinese with English abstract)
[6]Bao H D, Zhang P Y, Zhang H, et al. Bio-control ofSalmonellaEnteritidis in foods using bacteriophages[J].Viruses, 2015, 7(8): 4836-4853.
[7]Han H, Wei X, Wei Y, et al. Isolation, characterization, and bioinformatic analyses of lyticSalmonellaEnteritidis phages and tests of their antibacterial activity in food[J]. Current Microbiology, 2017, 74: 175-183.
[8]Thung T Y, Chang W S, Loo Y Y, et al. Use of a lytic bacteriophage to controlSalmonellaEnteritidis in retail food[J]. LWT-Food Science and Technology, 2017, 78:222−225.
[9]Hudson J A, Billington C, Cornelius A J, et al. Use of a bacteriophage to inactivateEscherichia coliO157: H7 on beef[J]. Food Microbiology, 2013, 36: 14-21.
[10]Perera M N, Abuladze T, Li M, et al. Bacteriophage cocktail significantly reduces or eliminatesListeria monocytogenescontamination on lettuce, apples, cheese, smoked salmon and frozen foods[J]. Food Microbiology, 2015, 52: 42-48.
[11]Jun J W, Kim H J, Yun S K, et al. Eating oysters without risk of vibriosis: application of a bacteriophage againstVibrio parahaemolyticus in oysters[J]. International Journal of Food Microbiology, 2014, 188: 31-35.
[12]Bueno E, García P, Martínez B, et al. Phage inactivation ofStaphylococcus aureusin fresh and hard-type cheeses[J].International Journal of Food Microbiology, 2012, 158(1): 23-27.
[13]Dykes G A, Moorhead S M. Combined antimicrobial effect of nisin and a listeriophage againstListeria monocytogenesin broth but not in buffer or on raw beef[J]. International Journal of Food Microbiology, 2002, 73(1): 71-78.
[14]Chibeu A, Agius L, Gao A, et al. Efficacy of bacteriophage LISTEXTM P100 combind with chemical antimicrobials in reducingListeria monocytogenesin cooked turkey and roast beef[J]. International Journal of Food Microbiology, 2013,167(2): 208-214.
[15]Wang C B, Yang J, Zhu X Y, et al. Effects of Salmonella bacteriophage, nisin and potassium sorbate and their combination on safety and shelf life of fresh chilled pork[J].Food Control, 2016, 73: 869-877.
[16]Majowicz S E, Musto J, Scallan E, et al. The global burden of nontyphoidalSalmonellagastroenteritis[J]. Clinical Infectious Diseases, 2010, 50(6): 882-889.
[17]毛雪丹,胡俊峰,刘秀梅. 用文献综述法估计我国食源性非伤寒沙门氏菌病疾病负担[J]. 中华疾病控制杂志,2011,15(7):622-625.Mao Xuedan, Hu Junfeng, Liu Xiumei. Estimation on disease burden of foodborne non-typhoid salmonellosis in China using literature review method[J]. Chinese Journal of Disease Control and Prevention, 2011, 15(7): 622−625. (in Chinese with English abstract)
[18]江艳华,李风铃,王联珠,等. 一株沙门氏菌裂解性噬菌体的分离鉴定及生物学特性[J]. 微生物学通报,2015,42(3):534-542.Jiang Yanhua, Li Fengling, Wang Lianzhu, et al. Isolation,identification and biological propertics of a lytic phage againstsalmonella[J]. Microbiology China, 2015, 42(3):531−535. (in Chinese with English abstract)
[19]Carey-Smith G V, Billington C, Cornelius A J, et al. Isolation and characterization of bacteriophages infectingSalmonellaspp[J]. Fems Microbiology Letters. 2006, 258(2): 182-186.
[20]Sambrook J, Russell D W著,. 分子克隆实验指南(第三版)[M]. 黄培堂,译. 北京: 科学出版社,2002:185-197.
[21]Bigwood T, Hudson J A, Billington C, et al. Phage inactivation of foodborne pathogens on cooked and raw meat[J]. Food Microbiology, 2008, 25: 400-406.
[22]中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228-2016[S]. 北京: 中国标准出版社, 2016.
[23]吴乐乐,周军辉,刘春娥,等. 茶多酚对三文鱼保鲜效果研究[J]. 食品研究与开发,2016,37(13):173-176.Wu Lele, Zhou Junhui, Liu Chun’e, et al. Studies on effect of tea polyphenols on the preservation of salmon[J]. Food Research and Development, 2016, 37(13): 173-176. (in Chinese with English abstract)
[24]冯建岭,魏敏,刘海燕,等. ε-聚赖氨酸应用于海鱼保藏的研究展望[J]. 食品工业,2016,37(2):233-236.Feng Jianling, Wei min, Liu Haiyan, et al. Research on prospect of ε-polylysine applying to marine fish preservation[J]. The Food Industry, 2016, 37(2): 233-236.(in Chinese with English abstract)
[25]唐春红,冯敏,张春晖,等. 天然防腐剂与抗氧化剂[M]. 北京: 中国轻工业出版社,2010:48-51.
[26]Prudêncio C V, Vanetti M C D, Prieto M. Tolerance ofSalmonella entericaserovar Typhimurium to nisin combined with EDTA is accompanied by changes in cellular composition[J]. Food Research International, 2015, 69: 281-288.
[27]任剑豪,吴卫国. 山梨酸及其钾盐防腐效果的研究进展[J].南方农业,2017,11(17):77-78.
[28]王晓英,王宇光,刘颖,等. 新型防霉保鲜剂—双乙酸钠的生产与应用研究进展[J]. 山东化工,2013,42(3):29-34.Wang Xiaoying, Wang Yuguang, Liu Ying, et al. Research progress on production and application of new-type mouldproof antistaling agent-sodium diacetate[J]. Shandong Chemical Industry, 2013, 42(3): 29-34. (in Chinese with English abstract)
[29]Shalitin C, Katchalski E. Inactivation ofEscherichia colibacteriophage T2 by poly-L-lysine. Ⅱ. properties of the irreversibly inactivated phage[J]. Archives of Biochemistry and Biophysics, 1962, 99(3): 508-516.
[30]Kochkina Z M, Surgucheva N A, Chirkov S N. Coliphages inactivation using chitosan derivatives[J]. Mikrobiologiia,2000, 69(2): 261-265.
[31]蓝蔚青,谢晶,杨胜平,等. Nisin生物保鲜剂对冷藏带鱼的保鲜效果研究[J]. 天然产物研究与开发,2010,22:683-686.Lan Weiqing, Xie Jing, Yang Shengping, et al. Research on the fresh-keeping effects of nisin onTrichiurus haumelaunder the cold storage[J]. Natural Product Research and Development, 2010, 22: 683-686. (in Chinese with English abstract)
[32]Wan N M, Poole S E, Deeth H C, et al. Effects of nisin,EDTA and salts of organic acids onListeria monocytogenes,Salmonellaand native microflora on fresh vacuum packaged shrimps stored at 4 ℃ [J]. Food Microbiology, 2012, 31(1):43-50.
[33]Galarce N E, Bravo J L, Robeson J P, et al. Bacteriophage cocktail reducesSalmonella entericaserovar Enteritidis counts in raw and smoked salmon tissues[J]. Revista Argentina De Microbiología, 2014, 46(4): 333-337.
[34]Gram L, Dalgaard P. Fish spoilage bacteria-problems and solutions[J]. Current Opinion in Biotechnology, 2002, 13(3):262-266.
[35]中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 鲜、冻动物性水产品GB 2733-2015 [S]. 北京: 中国标准出版社, 2015.
[36]Wommack K E, Colwell R R. Virioplankton: Viruses in aquatic ecosystems[J]. Microbiology and Molecular Biology Reviews, 2000, 64(1): 69-114.
[37]Carlton R M, Noordman W H, Biswas B, et al. Bacteriophage P100 for control ofListeria monocytogenesin foods: genome sequence, bioinformatic analysis, oral toxicity study, and application[J]. Regulatory Toxicology and Pharmacology,2005, 43(3): 301−312.
[38]Bruttin A, Brüssow H. Human volunteers receivingEscherichia coliphage T4 orally: A safety test of phage therapy[J]. Antimicrobial Agents and Chemotherapy, 2005,49(7): 2874−2878.
[39]O’Flaherty S, Ross R P, Coffey A. Bacteriophage and their lysins for elimination of infectious bacteria[J]. FEMS Microbiology Reviews, 2009, 33(4): 801-819.

