桂花OfCCD1基因启动子克隆与表达特性
刘玉成,王艺光,张 超,董 彬,付建新,胡绍庆,赵宏波
(1.浙江农林大学 风景园林与建筑学院,浙江 杭州 311300;2.浙江理工大学 建筑工程学院,浙江 杭州310018)
类胡萝卜素是广泛分布于自然界的一类色素,迄今已发现了近800种[1],主要存在于植物的叶、花、果实和根等器官中,在吸引昆虫、鸟类传播花粉和种子中发挥作用[2]。类胡萝卜素可作为多种生物活性物质的前体,经过氧合酶或非酶裂解作用可以形成阿朴类胡萝卜素[3],后者及其衍生物可生成β-紫罗兰酮(β-ionone)等香气物质及脱落酸(abscisic acid,ABA)等植物生长调节剂[4]。作为类胡萝卜素裂解氧合酶(carotenoid cleavage oxygenases,CCO)中的重要成员,类胡萝卜素裂解双加氧酶1(carotenoid cleavage dixoygenase 1,CCD1)在不同的植物中所裂解的底物、作用位点不尽相同。研究发现[5],CCD1在C9~C10(C9′~C10′)位时剪切番茄红素、胡萝卜素、玉米黄质或脱辅基类胡萝卜素等,形成β-紫罗兰酮, β-环柠檬醛(β-cyclocitral), 香叶基丙酮(geranylacetone)和假紫罗兰酮(pseudoionone)等芳香类物质;在番茄红素 C5~C6(C5′~C6′)位裂解时则形成 6-甲基-5-庚烯-2-酮[6], 认为 CCD1 对基于类胡萝卜素代谢途径的香气物质合成发挥着重要作用。桂花Osmanthus fragrans在中国栽培历史悠久,集绿化、美化和香化为一体,花香和花色是其重要观赏性状。类胡萝卜素裂解双加氧酶1(OfCCD1)[7]降解桂花中的着色物质——α-胡萝卜素和β-胡萝卜素[8],合成主要香气物质α-紫罗酮和β-紫罗酮[9]。基因启动子控制着基因在特定的组织[10]、特定的发育阶段[11]以及一定的环境条件下表达[12];分离相关基因启动子,分析其序列及其作用元件,并研究其功能,可明确该基因的调控因子及其作用机制。本研究利用染色体步移技术克隆了OfCCD1启动子,通过启动子序列分析、载体构建和瞬时表达分析,初步明确了其功能,为揭示OfCCD1基因调控花色花香代谢机制奠定基础。
1 材料与方法
1.1 植物材料
供试材料为6~8年生地栽丹桂品种 ‘堰虹桂’ ‘Yanhong Gui’,栽植于浙江农林大学桂花资源圃。
1.2 主要试剂
Taq聚合酶、限制酶(DraⅠ,EcoRⅤ,PvuⅡ,StuⅠ),质粒载体PMD18-T,大肠埃希菌Escherichia coliDH5α,胶回收试剂盒,DNA片段纯化试剂盒和无缝连接试剂盒均购自Takara公司(大连)。
1.3 方法
1.3.1 DNA提取 参照十六烷基三甲基溴化铵法(CTAB)提取 ‘堰虹桂’基因组DNA[13]。
1.3.2 引物设计与合成 根据 ‘堰虹桂’转录组数据库中的CCD1序列(GenBank登录号MG138152)[14]和 BALDERMANN 等发表的OfCCD1(GenBank登录号 AB526197.1)序列[9], 用 Primer Primer 5.0设计下游特异性引物1(GSP1),特异性引物2(GSP2)和特异性引物4(GSP4);利用上述2段序列的重复序列设计特异性引物3(GSP3);利用接头引物1(AP1)与GSP1,接头引物2(AP2)与GSP2经2轮聚合酶链式反应(PCR)获得的启动子片段设计特异性引物5(GSP5)。利用pBI121质粒上的β-葡萄糖苷酸酶(β-Glucosidase,GUS)基因序列设计上游引物GUS-F和下游引物GUS-R。引物及接头均由上海生工合成(表1)。
1.3.3 DNA文库的构建、扩增 ①DNA文库的构建。分别用DraⅠ,EcoRV,PvuⅡ,StuI 4种限制性内切酶对提取到的DNA进行酶切。酶切体系为基因组DNA 25.0 μL(100 mg·L-1),限制内切酶8.0 μL, 10×限制酶 buffer 10.0 μL, 灭菌水 57.0 μL, 总体积 100.0 μL,37 ℃过夜。 取 5.0 μl酶切产物用质量分数0.6%琼脂糖进行检测。按照DNA纯化试剂盒的说明书对酶切产物进行纯化后加接头。分别取4组酶切纯化的DNA各4.8 μL,染色体步移接头GWA 1.9 μL,10×连接缓冲液0.8 μL,T4 DNA连接酶0.5 μL,16.0℃过夜;70.0℃水浴5 min,加入32.0 μL去离子水。② 聚合酶链式反应(PCR)扩增。取AP1, 引物 GSP1/GSP3, 模板各 1.0 μL, 预混合Taq酶 10.0 μL, 去离子水补至 20.0 μL进行第 1轮PCR。扩增程序为94.0℃ 5 min;94.0℃ 25 s,72.0℃ 3 min,7循环;94.0℃ 25 s,65.0℃ 3 min,32循环;67.0℃ 7 min。取第1轮产物1.0 μL并稀释50倍作为第2轮PCR的模板。第2轮PCR体系为:AP2,GSP2/GSP4/GSP5,模板各1.0 μL,预混合Taq酶10.0 μL,去离子水补至20.0 μL。扩增程序为94.0℃ 5 min;94.0℃ 25 s,72.0℃ 3 min,5循环;94.0℃ 25 s,65.0℃ 3 min,20循环;67.0℃ 7 min。取GUS-F,GUS-R和pBI121质粒各1.0 μL,预混合Taq酶10.0 μL,去离子水补至20.0 μL进行GUS序列扩增。扩增程序为95.0℃5 min;95.0℃30 s,69.8℃30 s,72.0℃1 min,35循环;72.0℃10 min;4.0℃10 min。质量分数为1.2%的琼脂糖凝胶电泳检测。

表1 OfCCD1启动子克隆所用引物Table 1 Primer sequences used in the cloning of OfCCD1 promoters
1.3.4 PCR产物回收、连接、转化鉴定及序列测定与分析 切胶回收按照MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(TaKaRa,大连)的说明书进行。载体连接按照PMD18-T载体说明书(Takara,大连)进行,连接后的重组质粒导人大肠埃希菌DH5α感受态细胞中,在50 mg·L-1氨苄青霉素的固体LB培养基上进行蓝白斑筛选,挑取白色单菌落菌液PCR检测后将阳性克隆送公司测序。序列初步分析采用DNAMAN软件进行。启动子序列作用元件分析采用在线网站PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行。
1.3.5 表达载体的构建及瞬时表达分析 根据获得的OfCCD1的启动子序列,利用Takara(http://www.clontech.com)无缝连接引物设计软件设计3对无缝连接引物CCD1P-S-F和CCD1P-S-R,CCD1P-L-F和CCD1P-L-R,GUS-F和GUS-R。具体操作步骤按照Takara无缝连接试剂盒的说明书进行。将重组好的表达载体利用冻融法转入农杆菌Agrobacterium tumefaciensGV3101感受态。随后将烟草Nicotiana tabacum叶片剪切成0.5 cm×0.5 cm的叶块,在农杆菌菌液吸光度D(600)为0.6的侵染液中浸染10 min;无菌滤纸吸干叶片表面的菌液,将侵染的外植体移至于无菌水浸润的滤纸上培养24 h并进行GUS染色,37℃下保温16~24 h。V(乙酸)∶V(乙醇)=3∶1的混合液脱色后取出,对染色结果进行拍照。
2 结果与分析
2.1 启动子克隆
以 ‘堰虹桂’DNA为模板,分别利用引物GSP1和GSP2,接头引物AP1和AP2进行2轮PCR,在EcoR文库扩增得到条带;经比对和拼接得到长度为511 bp的序列(图1A)。利用引物GSP3和GSP4,接头引物AP1和AP2经过2轮PCR,在DraI文库中得到约2 000 bp的条带(图1B)。测序后,经比对和拼接得到长度为2 747 bp的条带,命名为OfCCD1P-L(图2)。利用GSP3和GSP5经过2轮PCR后在PvuⅡ文库中得到750 bp左右的条带(图1B),经过拼接比对得到OfCCD1上游981 bp的启动子序列,命名为OfCCD1P-S(图 3)。
2.2 启动子序列分析
利用PlantCARE网站对启动子序列进行序列分析发现,OfCCD1P-L有TATA-box和CAAT-box等基本作用元件,同时有7个响应元件,响应茉莉酸甲酯、赤霉素、水杨酸、乙烯的元件,以及热激元件,鸟类成髓细胞性白血病病毒癌基因同源物(MYB)结合位点,并有4个响应脱落酸(ABA)的核心序列ACGT(表2)。OfCCD1P-S中含有TATA-box和CAAT-box等基本作用元件,同时有3个光响应元件,1个热激响应元件以及1个ABA响应元件(表3),并有4个ABA响应元件(ABRE)核心序列ACGT。
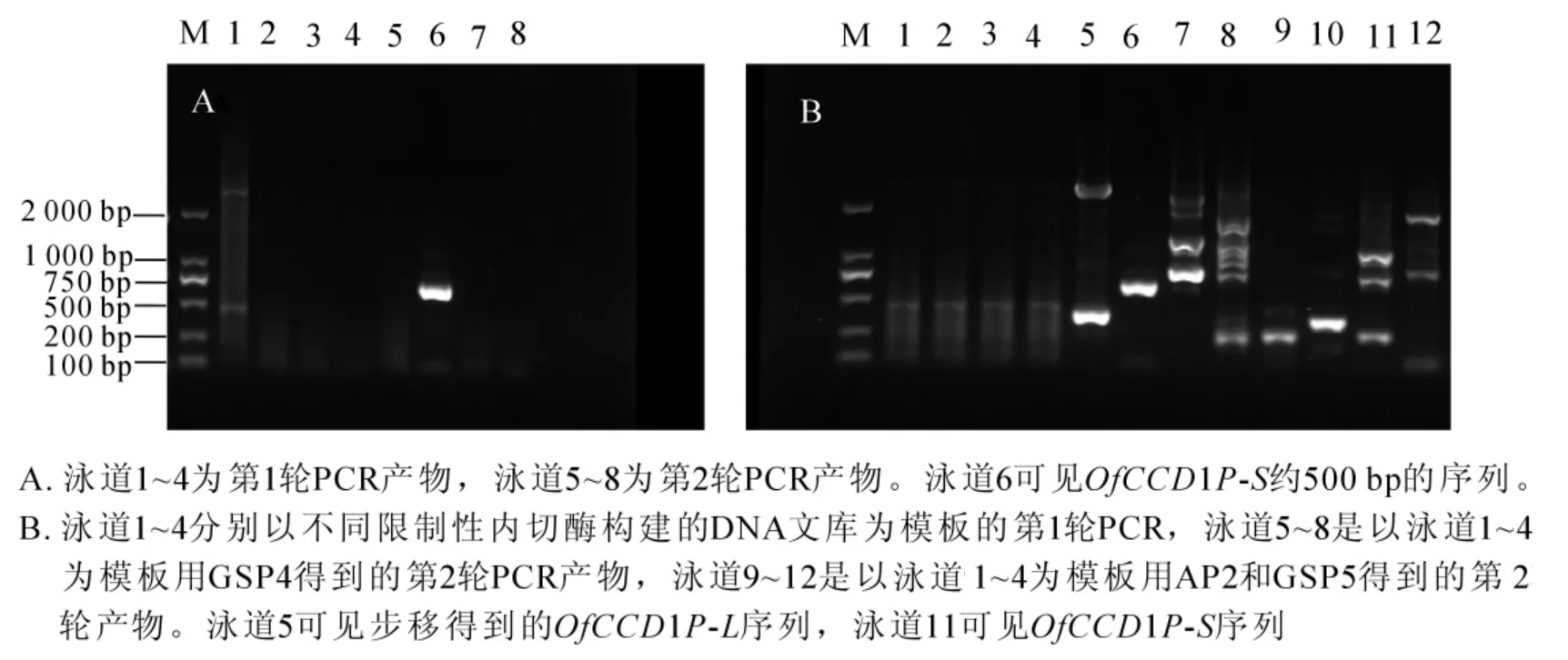
图1 OfCCD1启动子克隆电泳图Figure 1 PCR products of OfCCD1 promoters

表2 OfCCD1P-L中顺式作用元件Table 2 Cis-acting elements in OfCCD1P-L
2.3 植物表达载体构建与瞬时表达分析
将克隆得到的启动子和GUS片段分别与pBI121质粒进行重组(图4),以含GUS∶∶GUS表达载体的菌株为阴性对照(ck1),以含pBI 121载体菌株为阳性对照(ck2),对构建的OfCCD1P-L∶∶GUS和OfCCD1P-S∶∶GUS表达载体进行瞬时表达分析(图5)。从图5可以看出,阴性对照没有着色,阳性对照着色范围和程度最好,OfCCD1P-L∶∶GUS表达载体和OfCCD1P-S∶∶GUS表达载体均有着色,但着色都比阳性对照要弱。
3 讨论

图2 OfCCD1P-L序列Figure 2 Sequence of OfCCD1P-L

图3 OfCCD1P-S序列Figure 3 Sequence of OfCCD1P-S

表3 OfCCD1P-S中顺式作用元件Table 3 Cis-acting elements in OfCCD1P-S
桂花OfCCD1基因有2个拷贝[14]。在启动子克隆过程中,第1次步移并未得到足够长的序列。目前,已报道的OfCCD1序列有2个:ZHANG等[14]发现的CCD1序列(GenBank登录号MG138152)和 BALDERMANN发表的OfCCD1序列(GenBank登录号AB526197.1)[9]。 本研究利用上述2个序列的重复序列设计了引物GSP3,并在GSP3 5′上游设计了GSP4,利用已获得的部分OfCCD1启动子序列设计了引物GSP5,分别步移从而获得了OfCCD1P-S和OfCCD1P-L的启动子序列。其中OfCCD1P-L长度为2 747 bp,OfCCD1P-S长度为981 bp。原因是OfCCD1启动子区域的2个拷贝所含酶切位点不同,构建文库时OfCCD1P-L启动子区域被内切酶截断的区域短,步移得到的启动子就较长;而OfCCD1P-S启动子区域大部分被截断,所得的启动子序列就较短。类似地,已报道的CCD家族其他成员的启动子长度也有差异,如拟南芥Arabidopsis thaliana的AtCCD7[10]和AtNCED2[15],花生Arachis hypogaea的AhNCED1[16]启动子都有 2 000 bp 左右, 而菊花Chrysanthemum morifolium的CmCCD4a-5[17]和桂花的OfCCD4[18]启动子则分别为 1 094 bp和 1 337 bp。 上述文献中进行启动子克隆所用方法不尽相同,这也是造成获得启动子长度不一的因素。

图4 OfCCD1的2个启动子重组质粒图Figure 4 Recombinant vectors of two OfCCD1

图5 瞬时表达检测Figure 5 Detection of transient expression
本研究所获得的2个OfCCD1启动子所含元件种类是具有一致性的,都含有光响应元件、热激响应元件和ABA响应元件,其中较多的是光响应元件。在桂花中,OfCCD1的表达受光照影响[9],证实了OfCCD1启动子中的光响应元件的存在。同一个亚家族的其他成员,如CCD4[19]和CCD2[20]的启动子中也发现了光响应元件。这表明光响应元件在CCD家族的启动子中可能是普遍存在的。不过功能上可能有差异,因为在藏红花Crocus sativus中,CsCCD2的表达是受光抑制的[20]。
此外,克隆得到的2个启动子中含有4个ACGT序列[21]。ACGT是启动子中一个重要的顺式作用元件,该序列可以响应水杨酸(salicylic acid,SA),紫外线,ABA和茉莉酸(jasmonic acid,JA)[22]的处理。有研究表明:响应ABA至少需要2个ACGT序列,且2个ACGT之间的碱基数不同,响应的激素种类也不同。MEHROTRA等[23]的研究发现:当2个ACGT序列之间的距离是5 bp时,这段序列响应SA的处理;当距离是25 bp时,该序列响应ABA处理。在碱蓬Suaeda salsa[24]和大豆Glycine max[25]中ABA处理会使CCD1的表达量升高,因此,桂花中OfCCD1的表达极有可能响应ABA的诱导,具体的响应机制还需要进一步研究。
4 参考文献
[1] JOHNSON J D.Do carotenoids serve as transmembrane radical channels? [J].Free Rad Biol Med,2009,47(3):321-323.
[2] CAZZONELLI C I,POGSON B J.Source to sink:regulation of carotenoid biosynthesis in plants [J].Trends Plant Sci,2010,15(5):266-274.
[3] HOU Xin,RIVERS J,LEÓN P,et al.Synthesis and function of apocarotenoid signals in plants [J].Trends Plant Sci,2016,21(9):792-803.
[4] WALTER M H,FLOSS D S,STRACK D.Apocarotenoids:hormones,mycorrhizal metabolites and aroma volatiles [J].Planta,2010,232(1):1-17.
[5] SIMKIN A J,SCHWARTZ S H,AULDRIDGE M,et al.The tomato carotenoid cleavage dioxygenase 1 genes contribute to the formation of the flavor volatiles β-ionone,pseudoionone,and geranylacetone [J].Plant J Cell Mol Biol,2004,40(6):882-892.
[6] ILG A,BEYER P,ALBABILI S.Characterization of the rice carotenoid cleavage dioxygenase 1 reveals a novel route for geranial biosynthesis [J].Febs J,2009,276(3):736-747.
[7] BALDERMANN S,KATO M,FLEISCHMANN P,et al.Biosynthesis of α-and β-ionone,prominent scent compounds,in flowers ofOsmanthus fragrans[J].Acta Biochim Pol,2012,59(1):79-81.
[8] HAN Yuanji,WANG Xiaohui,CHEN Weicai,et al.Differential expression of carotenoid-related genes determines diversified carotenoid coloration in flower petal ofOsmanthus fragrans[J].Tree Genet Genomes,2014,10(2):329-338.
[9] BALDERMANN S,KATO M,KUROSAWA M,et al.Functional characterization of a carotenoid cleavage dioxygenase 1 and its relation to the carotenoid accumulation and volatile emission during the floral development ofOsmanthusfragransLour.[J].J Exp Bot,2010,61(11):2967-2977.
[10] LIANG Yingshi,JEON Y A,LIM S H,et al.Vascular-specific activity of theArabidopsiscarotenoid cleavage dioxygenase 7 gene promoter[J].Plant Cell Rep,2011,30(6):973-980.
[11] ZHENG Xiongjie,XIE Zongzhou,ZHU Kaijie,et al.Isolation and characterization ofcarotenoid cleavage dioxygenase4 genes from different citrus species [J].Mol Genet Genomics,2015,290(4):1589-1603.
[12] RUBIO-MORAGA A,RAMBLA J L,FERNÁNDEZ-de-CARMEN A,et al.New target carotenoids for CCD4 enzymes are revealed with the characterization of a novel stress-induced carotenoid cleavage dioxygenase gene fromCrocus sativus[J].Plant Mol Biol,2014,86(4/5):555-569.
[13] 徐沂春,胡绍庆,赵宏波.基于AFLP分子标记的不同类型野生桂花种群遗传结构分析[J].浙江农林大学学报,2014, 31(2):217-223.XU Yichun,HU Shaoqing,ZHAO Hongbo.Genetic structure of different naturalOsmanthus fragranspopulations based on AFLP method [J].J Zhejiang A&F Univ,2014,31(2):217-223.
[14] ZHANG Chao,WANG Yiguang,FU Jianxin,et al.Transcriptomic analysis and carotenogenic gene expression related to petal coloration inOsmanthus fragrans‘Yanhong Gui’ [J].Trees,2016,30(4):1207-1223.
[15] 万小荣,莫爱琼,潘家辉,等.拟南芥AtNCED2基因启动子区域序列克隆及其活性分析[J].生物技术,2010, 20(6): 18-23.WAN Xiaorong,MO Aiqiong,PAN Jiahui,et al.Molecular cloning and GUS-aided activity analysis of promoter region sequence ofAtNCED2 gene fromArabidopsis thalianaL.[J].Biotechnology,2010,20(6):18-23.
[16] 万小荣,莫爱琼,刘帅,等.粤油7号花生AhNCED1基因启动子克隆及其活性分析[J].核农学报,2011, 25(4): 692-699.WAN Xiaorong,MO Aiqiong,LIU Shuai,et al.Molecular cloning and GUS-aided activity analying of promoter sequence ofAhNCED2 gene fromArachis hypogaeaL.cv.Yueyou 7 [J].J Nucl Agri Sci,2011,25(4):692-699.
[17] IMAI A,TAKAHASHI S,NAKAYAMA K,et al.The promoter of the carotenoid cleavage dioxygenase 4a-5 gene ofChrysanthemum morifolium(CmCCD4a-5) drives petal-specific transcription of a conjugated gene in the developing flower [J].J Plant Physiol,2013,170(14):1295-1299.
[18] 韩远记.桂花花色变异的机理和不同花色品种花瓣的cDNA-AFLP差异分析[D].开封:河南大学,2014.HAN Yuanji.Mechanism of Flower Color Variation and cDNA-AFLP Analysis of2Cultivers with Different Flower Color in Osmanthus fragrans[D].Kaifeng:Henan University,2014.
[19] AHRAZEM O,TRAPERO A,GÓMEZ M D,et al.Genomic analysis and gene structure of the plant carotenoid dioxygenase 4 family:a deeper study inCrocus sativusand its allies [J].Genomics,2010,96(4):239-250.
[20] AHRAZEM O,RUBIO-MORAGA A,ARGANDOÑA-PICAZO J,et al.Intron retention and rhythmic diel pattern regulation of carotenoid cleavage dioxygenase 2 during crocetin biosynthesis in saffron [J].Plant Mol Biol,2016,91(3):355-374.
[21] CHOI H I,HONG J H,HA J O,et al.ABFs,a family of ABA-responsive element binding factors [J].J Biol Chem,2000,275(3):1723-1730.
[22] BHALOTHIA P,SANGWAN C,ALOK A,et al.PP2C-like promoter and its deletion variants are induced by aba but not by MeJA and SA inArabidopsis thaliana[J].Front Plant Sci,2016,7(14):547.doi:10.3389/fpls.2016.00547.
[23] MEHROTRA R,MEHROTRA S.Promoter activation by ACGT in response to salicylic and abscisic acids is differentially regulated by the spacing between two copies of the motif[J].J Plant Physiol,2010,167(14):1214-1218.
[24] CAO Yongrong,GUO Xiaoli,ZHANG Quan,et al.Isolation and characterization of carotenoid cleavage dioxygenase gene in halophyteSuaeda salsa[J].Plant Growth Regul,2005,46(1):61-67.
[25] WANG Ruikai,WANG Chune,FEI Yunyan,et al.Genome-wide identification and transcription analysis of soybean carotenoid oxygenase genes during abiotic stress treatments [J].Mol Biol Rep,2013,40(8):4737-4745.
——一道江苏高考题的奥秘解读和拓展

