SIRT1对牛卵泡颗粒细胞凋亡及雌激素分泌的影响
陈 洋,单雪松,吕文发*,赵志辉
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.吉林大学畜牧兽医学院,吉林长春 130062)
颗粒细胞是卵泡的重要组成成分,可分泌多种卵泡发育所需因子,并通过旁分泌及间隙连接等方式调控卵母细胞的生长、分化和成熟[1],颗粒细胞的存活或凋亡直接影响着卵泡的发育。沉默信息调节因子1(Silent Information Regulator1,SIRT1)是一种依赖于NAD+的组蛋白去乙酰化酶,通过赖氨酸残基去乙酰化调节相关基因表达,其作用底物包括FOXOs[2]、P53[3]、PGC1-α[4]、PPAR-γ[5]、NF-kB[6]等多种转录因子及蛋白。相关研究表明,SIRT1在哺乳动物颗粒细胞中表达,通过参与颗粒细胞凋亡过程调控卵泡闭锁退化[7]。Morita等[8]研究发现,SIRT1具有促进大鼠卵巢孕酮(P4)分泌的功能。Xiong等[9]研究表明,SIRT1表达下调抑制小鼠颗粒细胞的凋亡。SIRT1调节生殖过程的可能机制是通过促进促性腺激素释放激素(GnRH)、促黄体生成素(LH)释放和诱导LH受体表达完成[8,10],但其具体分子机制迄今尚未阐明。相关研究认为,SIRT1对细胞凋亡的调控可能通过Bcl-2家族发挥功能[11]。
目前,SIRT1对动物生殖功能调控的研究主要集中在小鼠和人类,对牛的研究相对较少。本研究构建了牛SIRT1-shRNA表达载体,通过转染体外培养的牛卵泡颗粒细胞,探讨SIRT1对卵泡颗粒细胞凋亡及雌激素分泌的影响,为揭示SIRT1基因在牛卵泡发育过程的作用及机制提供参考。
1 材料与方法
1.1 实验材料 屠宰场采集牛卵巢,37℃保温带回实验室,用灭过菌的剪刀剪掉卵巢周边多余结缔组织,预热含双抗的生理盐水冲洗3遍,备用。
1.2 实验试剂 qPCR相关试剂为日本TaKaRa公司产品,Western Blotting试剂盒、蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒、凋亡试剂盒为上海碧云天生物技术有限公司产品,兔抗人Bax、Bcl-2、GAPDH一抗、HRP标记的二抗为北京博奥森生物技术有限公司产品,DMEM/F12、胰蛋白酶为美国Gibco公司产品,雌激素ELISA试剂盒为武汉基因美生物科技有限公司产品。
1.3 细胞培养与转染 用带16号针头的10 mL无菌注射器抽吸卵巢上直径为2~6 mm的卵泡,收集卵泡液至15 mL离心管中,400 r/min,离心5 min,取培养液重悬沉淀,分装于培养皿中,加10%胎牛血清、37℃、5%CO2、饱和湿度培养。实验分为转染SIRT1-shRNA的干扰组、转染NC-shRNA的对照组和未转染的空白组。将待转染的颗粒细胞数量调整到5×104/mL接种于6孔板中,用无双抗培养液培养24 h,选取铺板均匀且融合度在70%~80%的细胞进行转染。转染前用无血清、双抗的DMEM/F12洗细胞2遍,再加入1.5 mL无血清、双抗培养液,按照Lipofectamine 2000说明书步骤进行转染。
1.4 实时定量PCR检测 Trizol法提取干扰组、对照组和空白组颗粒细胞总RNA,用反转录试剂盒将RNA反转录为cDNA。用SYBR Premix Ex Taq试剂盒进行扩增,反应条件:95℃预变性30 s,95℃变性5 s,60℃退火34 s,40个循环,以β-actin为内参基因。结果采用2-ΔΔCT法计算基因的相对表达量。实验设3次重复。所用引物均由上海生工生物技术公司合成,引物序列见表2。
1.5 流式细胞术检测细胞凋亡 细胞转染48 h后,用0.25%胰酶消化收集孔中所有细胞,用PBS洗涤细胞两遍,并调整细胞浓度为1×106/孔,加入400 μL Binding Buffer悬浮细胞,然后再加入5 μL Annexin V-FITC染液,轻轻混匀后避光孵育15 min,再加入10 μL PI上机检测并分析细胞凋亡率。实验设3次重复。
1.6 Western Blot检测蛋白水平 转染48 h后收集细胞,用预冷的PBS洗细胞2遍,加入细胞裂解液,冰上裂解,收集6孔板内的细胞,提取细胞总蛋白,用BCA蛋白浓度测定试剂盒测定蛋白浓度。取30 μg总蛋白进行SDS-PAGE,电转移至PVDF膜,5%脱脂奶粉常温封闭1 h,分别用相应的一抗4℃封闭过夜,TBST充分洗涤3次,每次5 min,除去未结合的一抗。加入辣根过氧化物酶标记的二抗常温避光孵育1 h;TBST充分洗涤3次,每次5 min,ECL发光显影。以β-actin为内参。采用Image J软件分析灰度值。实验设3次重复。
1.7 雌激素测定 转染48 h后收集培养液,用雌激素酶联免疫分析试剂盒检测培养液中雌激素的浓度。以标准物浓度为横坐标,OD值为纵坐标绘制标准曲线,测出样品OD值,由标准曲线查出相应浓度,乘以稀释倍数即为样品实际浓度。具体步骤参照ELISA试剂盒说明书进行。试验设3次重复。
1.8 统计分析 采用SPSS 20.0统计分析软件进行单因素方差分析,数据用平均值±标准误表示,以P<0.05为差异显著。
2 结 果
2.1 卵泡颗粒细胞转染效果检测 转染48 h后,干扰组(图1-A)和转染空载体的对照组(图1-B)颗粒细胞在荧光显微镜下均可见荧光蛋白表达。
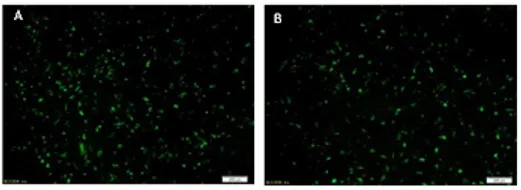
图1 颗粒细胞形态及绿色荧光蛋白表达情况(40×)
2.2 干扰后SIRT1基因实时定量PCR结果 图2显示,转染48 h后,转染SIRT1-shRNA干扰组颗粒细胞中SIRT1 mRNA的表达量较转染NC-shRNA对照组显著减少(P<0.05);对照组和空白组之间颗粒细胞的SIRT1 mRNA表达量无显著差异(P>0.05)。

表1 合成的shRNA序列
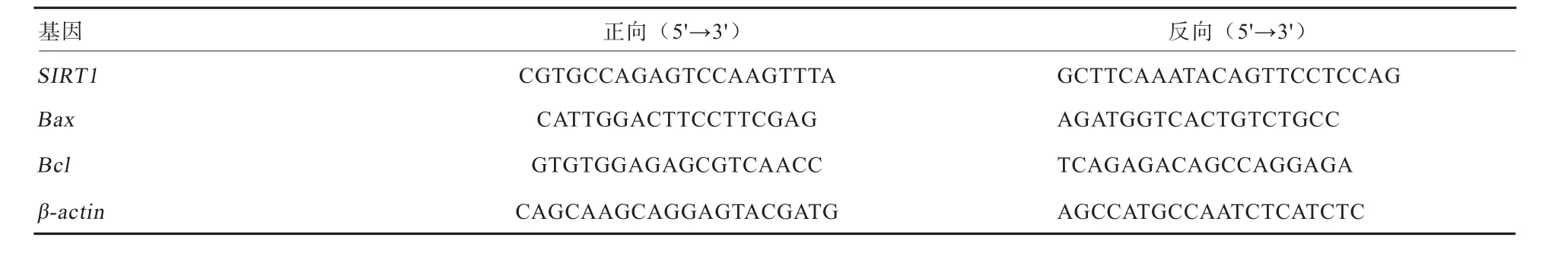
表2 目的基因引物序列

图2 不同处理组颗粒细胞SIRT1 mRNA的表达
2.3 SIRT1-shRNA对颗粒细胞凋亡的影响 流式细胞术检测结果(图3、4)显示,转染48 h后,对照组和空白组颗粒细胞凋亡率显著高于干扰组(P<0.05),前两者之间差异不显著(P>0.05)。
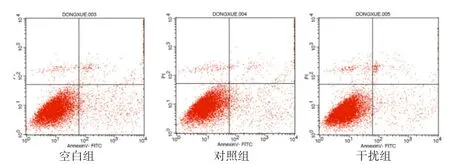
图 3 流式细胞仪检测细胞凋亡
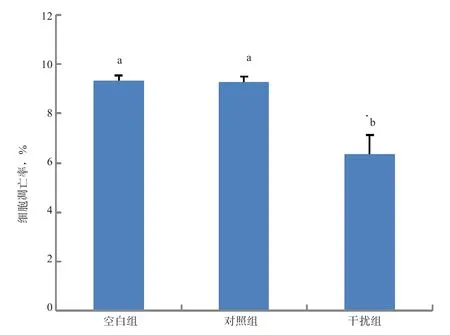
图4 不同处理组颗粒细胞凋亡率
2.4 SIRT1-shRNA对Bax、Bcl-2 mRNA和蛋白质表达的影响 由图5可知,转染48 h 后,干扰组颗粒细胞中Bax mRNA和蛋白质表达均显著低于对照组和空白组(P<0.05),而干扰组颗粒细胞Bcl-2 mRNA和蛋白质表达较对照组和空白组显著升高(P<0.05)。
2.5 SIRT1-shRNA对颗粒细胞雌激素分泌的影响 由图6可知,转染48 h后,干扰组颗粒细胞中雌激素分泌水平较对照组显著减少(P<0.05),对照组和空白组差异不显著(P>0.05)。
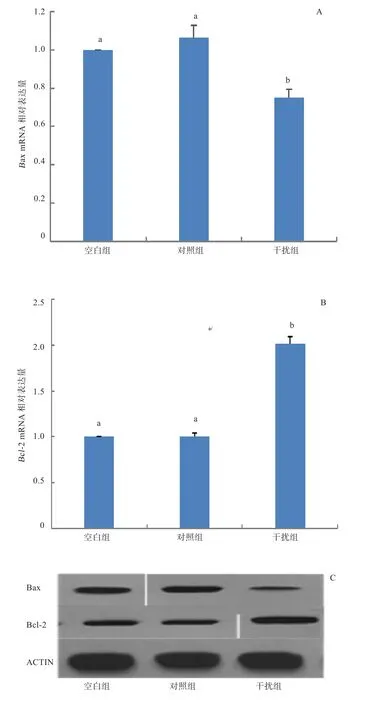

图5 不同处理组颗粒细胞Bax和Bcl-2 mRNA和蛋白质的表达
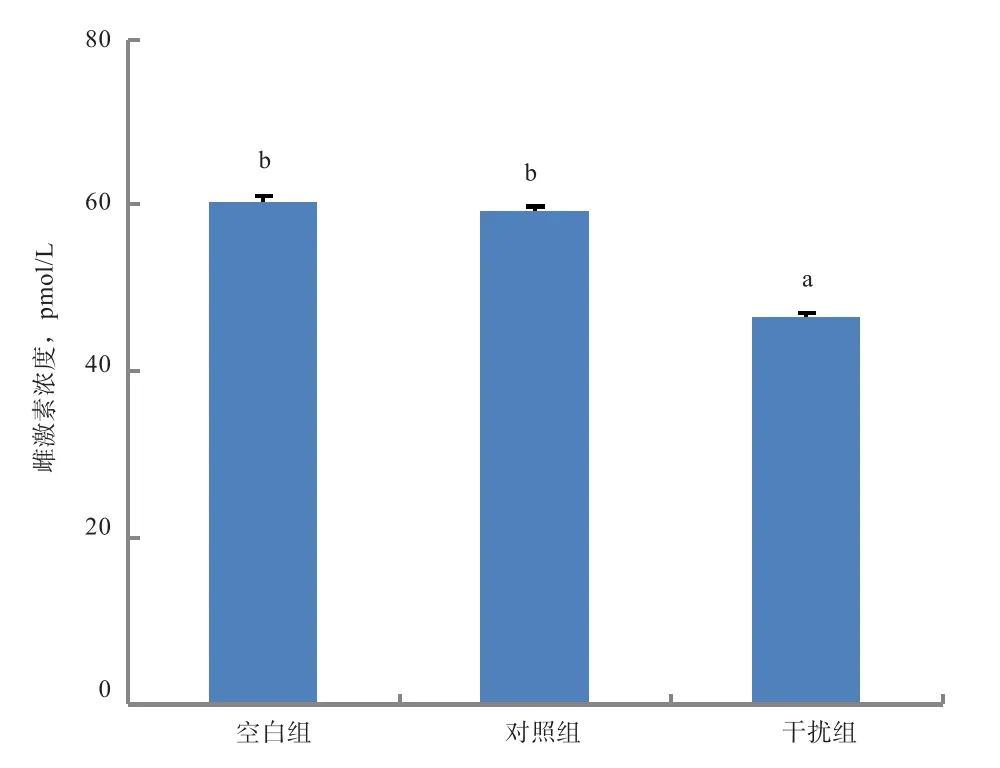
图6 不同处理组颗粒细胞培养液中雌激素分泌水平
3 讨 论
卵泡发生发育过程中,小部分卵泡发育成熟排卵,大部分卵泡则闭锁退化。卵泡的生长发育伴随着卵泡中颗粒细胞的增殖与分化,卵泡闭锁则起始于颗粒细胞凋亡。SIRT1是Ⅲ型组蛋白去乙酰化酶Sirtuins家族的重要成员,在细胞增殖、分化、凋亡、自噬、DNA损伤修复和代谢等生物过程中起着重要的调控作用[12-13]。越来越多的研究表明,在哺乳动物中SIRT1信号通路可以抑制原始卵泡发育,减少卵泡闭锁,从而增加卵泡储备延长卵巢寿命[14],在猪的卵母细胞中SIRT1表达量随着年龄的增长而下降[15]。有研究表明,当SIRT1缺失时,无论雌雄小鼠都丧失生育能力[16-17]。这说明SIRT1在生殖过程中起重要调控作用。SIRT1调控多种细胞类型的凋亡,但SIRT1在哺乳动物卵泡发育中的确切作用,特别是在卵泡颗粒细胞凋亡中的作用仍鲜为人知。本研究发现,干扰SIRT1基因表达,颗粒细胞凋亡减少,这可能通过Bcl-2通路调节。通过实时定量PCR和Western Blot检测发现,干扰SIRT1基因后颗粒细胞促凋亡基因Bax mRNA和蛋白质表达明显低于对照组与空白组,抗凋亡基因Bcl-2 mRNA和蛋白质表达明显高于对照组和空白组,提示SIRT1可能通过参与凋亡因子表达水平的调控,间接参与颗粒细胞凋亡,从而促进颗粒细胞凋亡。Kuo等[18]研究表明,在人乳腺癌细胞中抑制SIRT1活性可下调Bcl-2蛋白的表达,进而加速乳腺癌细胞凋亡并抑制乳腺癌进展。以上结果说明SIRT1可以促进细胞增殖,也可以抑制细胞增殖,主要取决于细胞类型。本实验中,干扰组颗粒细胞中雌激素分泌水平与对照组和空白组比较降低明显,这与李碧侠等[19]对猪的颗粒细胞研究结果相似。结果初步说明牛卵巢颗粒细胞中SIRT1基因表达量影响颗粒细胞雌激素分泌水平,具体调控机制尚需进一步深入研究。
综上所述,干扰SIRT1基因表达能够抑制牛卵泡颗粒细胞凋亡,且降低雌激素分泌。

