人星状病毒1型野毒株的培养及生物学鉴定*
梁雪雪,刘鹏飞,谭李倩,李明,赵微
(锦州医科大学,辽宁 锦州 121001)
人星状病毒(human astrovirus,HAstV)为无囊膜、单股、正链RNA病毒,是导致婴幼儿、老人及免疫缺陷人群腹泻的重要病原体[1]。HAstV具有8个传统的血清型(HAstV 1~8),其中HAstV-1型在全世界范围内广泛流行[2]。目前,国内HAstV的研究报道局限在流行病学分析,有关病毒的分离方法及生物学特性报道较少。本文对HAstV-1型野毒株进行细胞适应性培养及生物学鉴定,为后续深入研究星状病毒的分子致病机制奠定基础。
1 材料与方法
1.1 细胞与病毒
Caco-2细胞(美国ATCC细胞库),35份腹泻患儿粪便样本来源于辽宁省某市私立幼儿园群体腹泻样本,并由本实验室保存。
1.2 主要试剂
DMEM培养基、胎牛血清(Cell Culture Companion,美国Gibco公司),HAstV抗体(8E7)为小鼠单克隆抗体(美国Santa Cruz Biotechnology公司),HAstV、轮状病毒、诺如病毒、腺病毒酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA) 检测试剂盒购自丹麦Dako Diagnostics公司,FITC标记的羊抗鼠IgG、猪胰酶及胰酶抑制剂购自美国Sigma-ALDRICH公司和中国上海分公司;病毒RNA抽提试剂盒(德国Qiagene公司),逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RTPCR)和实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)相关分子生物学试剂购自大连宝生生物工程公司有限公司,基因测序由上海杰李生物测序公司完成。
1.3 HAstV的鉴定
粪便样本经过PBS漩涡离心处理后取上清液作为第一代野毒株P1,采用ELISA试剂盒检测样本中HAstV、轮状病毒、诺如病毒、腺病毒。提取病毒RNA,采用病毒的特异性引物分别对HAstV、轮状病毒、诺如病毒、腺病毒进行RT-PCR定性检测,引物序列参考文献[3-4]。
1.4 HAstV在Caco-2上的扩增及适应性培养
将Caco-2细胞接种于6孔板,长至单层,取500μl HAstV P1代野毒株上清液,加入猪胰酶(终浓度100~200μg/ml),于37℃激活60~90 min后,加入同量的猪胰酶抑制剂。病毒加入细胞前,细胞饥饿培养4 h,将病毒液加入细胞表面吸附60~90 min后,弃去病毒,用PBS洗2次,加入无血清培养基DMEM持续培养,96 h后用细胞刮刀收集所有细胞及细胞培养液,-70℃冻存。感染后的细胞及细胞培养液经过3次反复冻融后,使病毒释放,4℃离心,弃细胞碎片,收集上清液作为第2代病毒(P2)进行扩增。按照上述方法经过10次(P1~P10)扩增传代及适应性培养。
1.5 qRT-PCR
采用SYBR染料法检测每一代次HAstV的拷贝数。HAstV正向引物:5-CCGAGTAGGATCGAG GGT-3,HAstV反向引物:5-GCTTCTGATTAAATCAAT TTTAA-3,扩增HAstV衣壳蛋白ORF2特异性基因,扩增产物88 bp。扩增产物经过回收纯化后构建标准质粒,采用核酸分光光度计检测质粒浓度,并根据公式基因拷贝数/(copies/ml)=(6.02×1023/mol×质粒浓度g/ml)/分子量(MWg/mol),计算标准质粒DNA拷贝数,建立DNA标准品质粒。标准品质粒进行10倍梯度稀释,每个样本重复3次,以Ct值为横坐标,以log基因拷贝数为纵坐标,建立标准曲线。采用qRT-PCR仪(BIORAD IQ5)对病毒基因拷贝数进行测定。
1.6 免疫荧光法
采用免疫荧光法检测病毒抗原。将Caco-2细胞接种于6孔板,取第6代病毒液(P6)按照上述方法感染细胞,采用4%多聚甲醛固定,经过打孔、封闭后,一抗加入HAstV 8E7抗体(1∶1 000,8E7为小鼠单克隆抗体),二抗为FITC标记的山羊抗小鼠抗体(1∶500)。荧光显微镜下观察细胞内HAstV荧光灶。
1.7 病毒基因稳定性检测
分别提取P1~P10代病毒液RNA,经过逆转录后,采用PCR方法扩增HAstV衣壳蛋白特异性基 因ORF2。ORF2正 向 引 物 :5-ATGGCTAGCAA GTCCAATAAGCA-3,ORF2反向引物:5-CTACTCGG CGTGGCCGCGGCTTCC-3,扩增产物2 364 bp。扩增产物经过琼脂糖电泳检测,回收纯化,构建到PMD-18T载体中,转化大肠杆菌,经过扩增培养后提取质粒,送上海杰李生物测序公司测序。
1.8 荧光灶法
采用荧光灶法检测病毒滴度。将Caco-2细胞按1×104个/ml的密度接种于96孔板,再加入10倍系列稀释的病毒感染细胞上清(50μl/孔),按照1.4中的方法感染细胞,96 h后弃去病毒液,加入4%多聚甲醛4℃固定30 min;弃去固定液,加入抗HAstV荧光抗体8E7(1∶1 000稀释)50μl/孔,37℃中和1 h;PBS清洗后,加入FITC标记的羊抗鼠IgG(1∶500),37℃孵育1 h,PBS冲洗后,在荧光显微镜下观察,计算终末稀释孔荧光灶个数,并计算病毒滴度。病毒滴度(FFU/ml)=(最高稀释倍数孔荧光灶个数的平均值+相邻较低稀释倍数孔荧光灶个数的平均值)/2×相邻较低稀释倍数×每孔加入的病毒稀释液的体积。
1.9 统计学方法
绘制qRT-PCR标准曲线,基因拷贝数取Log对数作为因变量,Ct值作为自变量,应用直线回归法。
2 结果
2.1 HAstV的定性结果
35份腹泻样本经过PBS处理后ELISA结果表明,HAstV感染率为85.7%(30/35),未检出其他病毒的感染。RT-PCR检测结果表明,HAstV检出率为100%。将所有样本进行基因测序,结果检测出15株HAstV(GenBank No.KF211460–KF211474),经过序列分析对比及遗传进化分析,确认分离的毒株属于HAstV-1d亚型[5]。本研究中选取其中1株毒株编号JZ-10作为P1代野毒株进行后续研究。
2.2 HAstV的适应性培养、增殖及抗原检测结果
HAstV JZ-10接种Caco-2细胞传代到第10代,未观察到明显的细胞病变。但通过免疫荧光法检测细胞内的病毒感染情况,表明JZ-10毒株在Caco-2细胞连续传10代,在接种病毒的细胞内均检测到明亮的绿色病毒特异性荧光,而对照组细胞内未见绿色荧光(以第6代病毒为例)(见图1)。表明HAstV已经适应在Caco-2内的复制,且具有良好的抗原性。毒株适应细胞的最佳培养条件为:毒株感染前加入终浓度为200μg/ml的猪胰酶,于37℃激活90 min后再加入同量的猪胰酶抑制剂。激活的病毒液加入细胞表面吸附90 min后,弃去病毒,维持培养液中不加血清,维持培养96 h后收取全部细胞及上清液。经过3次反复冻融使病毒释放,4℃离心,弃去细胞碎片,收集上清液作为下一代病毒。

图1 JZ-10毒株P6代感染Caco-2细胞 (免疫荧光×20)
2.3 细胞内HAstV的拷贝数
采用HAstV荧光定量引物进行PCR扩增后出现88 bp的目的片段,回收目的片段克隆测序进行序列比对,结果显示该片段与HAstV-1ORF2基因相似性为100%。建立标准质粒PMD18-T-ORF2,质粒浓度458.3μg/ml。根据公式计算出质粒的基因拷贝数为1.5×1011copies/ml。质粒按照10倍梯度稀释后行qRT-PCR检测,根据扩增结果绘制Ct值标准曲线,log基因拷贝数=-0.3141(Ct)+13.87,决定系数R2=0.997,Tm值(85±0.05)℃(见图2)。JZ-10毒株基因拷贝数结果见附表,随着病毒传代次数的增加,HAstV的拷贝数增加,P9代和P10代达最高峰,基因拷贝数达1×107。
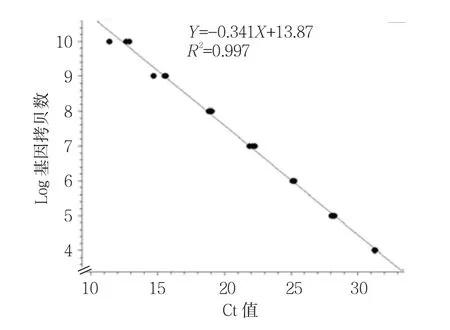
图2 qRT-PCR标准曲线
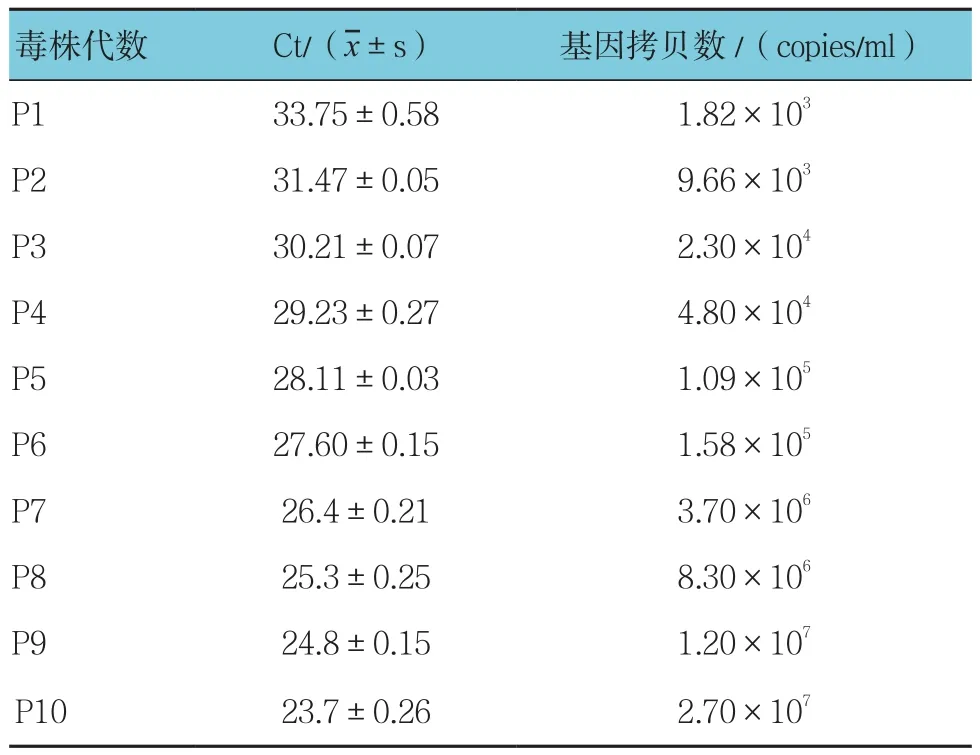
附表 HAstV JZ-10毒株基因拷贝数
2.4 HAstV特异性基因稳定性鉴定结果
提取P1~P10培养物的RNA,采用RT-PCR扩增HAstV衣壳蛋白全长基因ORF2,同时设立阴性对照组和阳性对照组。经琼脂糖凝胶电泳分析,可见2 364 bp的特异性基因片段(见图3)。经过测序分析,P1~P10代基因序列一致,无突变现象,基因序列稳定。

图3 HAstV衣壳蛋白全长基因ORF2 RT-PCR扩增产物
2.5 HAstV的感染滴度
HAstV-1型JZ-10株在Caco-2细胞上连续传10代,病毒的感染性滴度呈持续升高直至稳定适应过程,第1、2代病毒滴度最低,传至第3代时,病毒的感染性滴度开始增加,达3.3 logFFU/ml;至第9、10代,病毒滴度最高,达6.97 LogFFU/ml(见图4)。
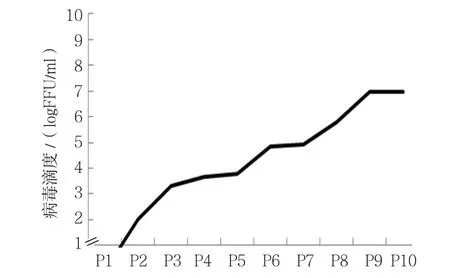
图4 HAstV-1型JZ-10毒株不同代次感染性滴度
3 讨论
小儿腹泻是全球性的重要公共卫生问题之一,除轮状病毒、杯状病毒和腺病毒以外,HAstV是也一个引起儿童病毒性腹泻的重要致病因子[6]。近10年来,我国婴幼儿感染HAstV的检出率逐年增加;2010年,国内幼儿园及产科病房新生儿HAstV感染性腹泻的爆发引起儿科的高度重视[7]。HAstV与其他肠道病毒,如诺如病毒、轮状病毒、腺病毒等混合感染,延长患者的治愈周期,增加患者的死亡率,已成为公共卫生问题[8]。本实验分析HAstV-1型毒株在Caco-2细胞上的适应性及毒株的生物学特性,为后续研究病毒的分子生物学机制及疫苗研发奠定基础。
HAstV具有独特的生物学特性,由于病毒感染细胞后,没有明显的细胞病变,因此给病毒的分离培养及滴度检测带来困难。本课题组前期在幼儿园腹泻群体样本中分离出1株HAstV-1型,根据病毒的生物学特性,进行病毒分离与细胞的适应性培养。文献报道,Caco-2细胞能够支持HAstV株的复制和感染,已成为研究HAstV感染的标准细胞系[9]。一些肠道病毒在体外细胞培养时都需要胰酶的存在,如小儿轮状病毒[10]。本文实验最终采用终浓度为200μg/ml的猪胰酶,于37℃激活90 min后进行病毒感染,在细胞的传代过程中,每次接种病毒都要进行胰酶的激活处理,胰酶的活性作用可以使病毒粒子激活,形成具有感染性的病毒粒子,并能够维持病毒在细胞内具有一定的感染滴度。本实验结果表明,JZ-10毒株经过10代的细胞适应性培养后,虽然未出现可见的CPE,但是免疫荧光检测结果提示,HAstV已经适应在Caco-2内的复制,在无血清DMEM维持培养时,细胞不脱落,免疫荧光检测病毒能够识别HAstV单克隆抗体,具有良好的抗原性。而本实验采用Caco-2细胞进行病毒的分离培养,该细胞的功能和分泌与小肠上皮细胞类似,并能够形成隐窝结构,因此HAstV感染Caco-2后的致病作用与天然病毒感染类似。
病毒滴度测定是HAstV在后续研究实时处理因素中的重要步骤。目前测定病毒滴度的方法有多种,一类是对病毒粒子进行物理定量;一类是生物学方法,如空斑滴定法、50%细胞组织感染法、免疫荧光法等。由于HAstV感染细胞后不能观察到明显的细胞病变,因此本实验采用微量免疫荧光灶法测定病毒滴度,通过HAstV一抗孵育,FITC标记的二抗杂交,利用荧光显微镜观察发光细胞的数量,判断细胞的感染量。该方法有效检测出HAstV的滴度,随着传代次数的升高,病毒滴度增加,病毒感染滴度可以满足后续实验的需要。同时本实验采用qRT-PCR对病毒在细胞内增殖情况进行检测,病毒的基因拷贝数能够反映病毒在宿主细胞内的复制情况和宿主细胞的感染性。该方法能够较为精确地反映病毒中的病毒颗粒数。本实验中,病毒的基因拷贝数与病毒的滴度呈正相关,且随着传代次数增加,病毒基因组保持稳定。
通过本实验HAstV的适应性培养与增殖研究,获得能够在实验室中分离培养的细胞适应性HAstV-1毒株,该毒株的获得为后续进行HAstV的研究奠定了基础。

