荧光PCR法检测畜禽肉中的鸡源性成分
唐修君,樊艳凤,贾晓旭,葛庆联,唐梦君,张小燕,陈大伟,高玉时
(中国农业科学院家禽研究所,江苏扬州 225125)
随着人民生活水平的不断提高,食品质量安全检测技术进一步得到完善和更新,然而食品掺假掺杂手段也在不断提高[1]。近年来,在利益驱动下肉制品掺假事件时有发生,“挂鹅头卖鸭肉”、非法添加“牛肉膏”等食品安全事件不断出现,严重侵害了消费者权益。2017年3月22日,南方网报道黄记煌使用过期变质掺假肉事件。2016年12月12日,广州市消委会发布消息称海欣牌香港撒尿肉丸(牛肉风味)和大鱼市撒尿肉丸(牛肉味)中均没有牛肉。2015年11月4日,法制晚报报道华润万家社区超市出售掺假肉包子事件。2014年1月26日,羊城晚报报道市场出售掺假羊肉卷有70%是猪肉。可见,肉与肉制品掺杂掺假已成为我国食品质量控制面临的重要挑战之一,而对原料肉进行动物源性成分鉴定显得十分必要。
传统的方法是依靠感官评价和形态学进行肉类来源鉴别,但这些手段已远不能满足监管部门对肉制品掺假现象的监控。目前,动物源性食品鉴定的检测方法主要有酶联免疫吸附法[2]、电子鼻技术[3]、色谱法[4]以及分子生物学法[5~7]等。其中,实时荧光定量 PCR技术凭借其特异性好、自动化程度高,检测周期短以及扩增目的片段较小等优势,提高了食品中动物源性成分定性鉴别的有效性,已逐步成为肉类种属检测和鉴定的核心方法[8,9]。孙晶莹等[1]根据牛线粒体 DNA片段,设计合成两对特异性引物,分别以生牛肉、熟牛肉及超市牛肉加工品为实验材料,建立了肉制品中牛源性成分多重实时荧光PCR检测方法。林彦星等[10]根据鸭mtDNA COX基因保守序列设计了鸭特异性引物和TaqMan探针,建立了畜禽肉制品中鸭源性成分实时荧光定量PCR检测方法。
动物线粒体基因组DNA序列由于拷贝数多、在食品加工过程未完全降解以及高度物种特异性等特点,已成为肉与肉制品动物源性成分鉴别的良好靶基因[11~13]。但以往所报道的研究中,所用动物品种较少,而且针对线粒体DNA 16S rRNA基因的研究甚少。本项目拟选择16S rRNA基因为靶基因,根据鸡、鸭、鹅、鸽、鹌鹑、猪、牛、羊和兔等9种动物16S rRNA基因的差异位点,设计筛选鸡特异性引物,并进行系统性研究,拟建立基于线粒体DNA 16S rRNA基因的荧光PCR技术的畜禽肉中鸡源性成分快速鉴别方法,为肉品真假识别提供有力依据。
1 材料与方法
1.1 实验材料
新鲜鸡肉、鸭肉、鹅肉、猪肉、牛肉、羊肉、兔肉、鸽肉和鹌鹑肉购自扬州市农贸市场,火腿肠和腊鸡腿购自扬州市大润发超市。
离心柱式组织基因组DNA小量抽提试剂盒,北京天根生化科技有限公司;2×PCR Mix,南京博尔迪公司;琼脂糖,Promega公司;荧光染料预混液SYBR Green mix:AceQ qPCR SYBR Green Master Mix 2500rxn,南京诺唯赞生物科技有限公司。
1.2 试验方法
1.2.1 DNA提取
将鸡、鸭、鹅、猪、牛、羊、兔、鸽和鹌鹑等 9种动物肉样搅碎至肉糜状,以试剂盒法提取DNA,并溶于100 μL洗脱液中,-20 ℃保存备用。经测定9种动物DNA模板浓度均在110~210 ng/μL之间,其中鸡为174.57 ng/μL。火腿肠、腊肉均通过优化后的十六烷基三甲基溴化铵法(CTAB)方法[14]进行DNA提取。
1.2.2 引物设计与合成
以Genbank上公布的鸡、鸭、鹅、猪、牛、羊、兔、鸽、鹌鹑等动物线粒体DNA 16S rRNA基因序列为靶基因,通过 Arraydesigner2.0、Oligo6.0、Bioedit等软件比对分析,Primer Premier 5.0软件设计合成鸡特异性引物,由上海生物工程公司合成,引物明细具体见表1。

表1 鸡16S rRNA基因引物序列、Tm值及PCR产物大小Table 1 Primer sequence, Tm value and the size of PCR product
1.2.3 普通PCR扩增和测序
PCR 反应体系为20 μL:其中2×PCR Mix 10 μL,10 μmol/L 正向和反向引物各 0.2 μL,DNA 模板 1 μL,灭菌双蒸水8.6 μL。扩增条件为:95 ℃预变性5 min;之后95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,共进行30个循环;最后72 ℃延伸10 min。PCR产物经1.5 g/L琼脂糖凝胶电泳检测后割胶回收、纯化,并交由上海华大基因科技有限公司测序,采用双向测序,测序结果与GenBank上已知序列进行比对。
1.2.4 荧光PCR扩增
荧光PCR反应体系为15 μL:其中Mix 7.5 μL,Dye 0.3 μL,1 μmol/L 正向和反向引物各 0.5 μL,DNA模板 1 μL,灭菌双蒸水 5.2 μL。扩增条件为:先是 50 ℃酶激活2 min;之后95 ℃预变性10 min,然后95 ℃变性15 s,60 ℃延伸1 min,共进行40个循环。反应结束后,观察9种动物DNA模板的扩增曲线图,并读取循环阈值(cycle threshold,Ct值),判定引物的特异性。若无典型扩增曲线且Ct值大于35,判定检测体系无特异性扩增。
1.2.5 灵敏度实验
将鸡肉DNA模板浓度按10n倍梯度进行稀释,稀释倍数分别为 101、102、103、104、105、106、107和108倍,观察方法灵敏度,反应条件同1.2.3和1.2.4。
1.2.6 样品检测
利用建立的方法对市场上随机抽取的样品进行检测。
2 结果与讨论
2.1 9种畜禽肉中鸡源性成分常规PCR检测
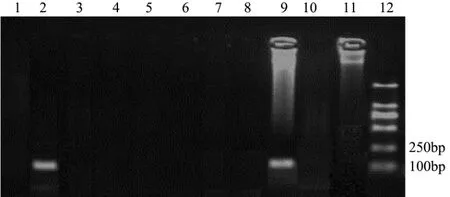
图1 鸡引物PCR扩增结果Fig.1 PCR product of chicken primer

图2 鸡肉DNA不同稀释倍数扩增结果Fig.2 PCR product of different dilution ratio of chicken DNA
肉类作为人类重要的营养来源,与人们生活和健康息息相关,研究肉类掺杂掺假以及畜禽肉动物源性显得尤为重要。PCR技术凭借其简单、快速等特点,在肉品来源等分析中已得到广泛应用,并取得良好效果[15]。本研究采用PCR技术,以设计筛选的基于鸡线粒体DNA 16S rRNA基因的特异性引物,对鸡、鸭、鹅、猪、牛、羊、兔、鸽和鹌鹑等9种动物DNA模板进行PCR扩增,经过多次重复试验证明,该引物仅对鸡肉DNA模板扩增出特异性条带,其它物种无扩增(见图1)。之后将鸡肉DNA模板按10倍梯度稀释,发现当稀释倍数达到 103倍即模板浓度为 174.57 pg/μL时,仍可见到特异性条带(见图2)。同时对PCR产物进行测序,并将测序结果与已发表的序列(GenBank登录号分别为AB086102.1、GU261713.1、GU261678.1)进行比对,发现同源性均在99%以上,与预期结果一致,确定该条带为鸡肉成分。
2.2 9种畜禽肉中鸡源性成分荧光PCR检测
近年来,随着对食品安全的日益重视以及分子生物学等技术的飞速发展,动物源性成分各种检测技术相继涌现[16,17],其中以核酸检测为基础的技术在食品肉类成分鉴别与分析等方面日益成熟,尤其是荧光定量PCR技术,使得定量检测成为可能,由于其具有简单快速以及灵敏度和准确性高等优点,已成为肉与肉制品中动物源性成分鉴别普遍采用的方法之一[18,19]。齐春萌等[20]根据鸵鸟线粒体COⅠ基因序列,设计特异性引物和TaqMan探针,建立了肉制品中鸵鸟源性成分的实时荧光PCR鉴定方法。许如苏等[21]基于马的种属保守序列,设计特异性引物和TaqMan-LNA探针,建立了可快速检测肉制品中马源性成分的TaqMan-LNA荧光PCR检测方法。

图3 不同动物荧光扩增曲线图Fig.3 Fluorescent Amplification curves of different animals
本研究以鸡、鸭、鹅、猪、牛、羊、兔、鸽和鹌鹑等9种不同动物DNA为模板,以线粒体DNA 16S rRNA为靶基因,设计鸡特异性引物,进行荧光定量PCR扩增。结果显示,所设计筛选的鸡引物仅鸡肉DNA模板反应后有典型扩增曲线,Ct值为22.11,而其它动物DNA模板反应后无典型扩增曲线且Ct值均大于35,具体见表2和图3。目前,有关畜禽肉中鸡源性成分检测的研究报道甚少,而且已有的报道中涉及到的动物种类偏少[22,23]。该方法的建立可以补充和完善我国畜禽肉与肉制品中掺杂、掺假检测方法,保护肉类产业健康发展。

表2 不同动物DNA模板荧光PCR扩增Ct值Table 2 The Ct value of fluorescent PCR amplification of different animal DNA template

表3 鸡DNA模板不同稀释倍数获得的Ct值Table 3 The Ct value of different dilution ratio of chicken DNA template
2.3 灵敏度检测

图4 DNA模板不同稀释倍数扩增曲线Fig.4 Amplification curve of different dilution ratio
将鸡肉DNA模板按10倍梯度稀释,从DNA水平进行灵敏度检测,确定方法检测下限。
结果显示,当DNA模板稀释倍数达到104倍,即DNA浓度为17.5 pg/μL时,Ct值为30.37,仍有典型扩增曲线,可见该方法的灵敏度较高。具体结果见表3和图4。
2.4 市场样品随机检测结果
近年来,肉类掺假等食品安全事件屡屡发生,不法商家为了谋取利益,以次充好,以假乱真等现象时有发生,本研究以建立的方法对从市场上随机抽取的样品进行鸡源性成分检测,以供监管部门参考。结果显示所抽检的鸡肉火腿肠和腊鸡腿均检测出了鸡肉成分,而成分表明含有猪肉和牛肉的火腿肠未检测出鸡肉成分,具体见表4。

表4 随机抽检样品鸡源性成分检测结果Table 4 The detection results of chicken origin ingredients in randomly sampling
3 结论
3.1 本研究根据鸡、鸭、鹅、猪、牛、羊、兔、鸽和鹌鹑等9种动物线粒体DNA16S rRNA基因序列的位点差异,设计并筛选出了鸡特异性引物,建立了基于荧光定量PCR检测畜禽肉中鸡源性成分的方法。
3.2 经过多次试验和重复验证表明,所设计筛选的引物对只有在鸡DNA模板存在的情况下才会发生特异性反应,生成典型扩增曲线,而对其它8种动物肌肉DNA模板无典型扩增曲线,可见该引物对特异性较好,该方法灵敏度较高,达到pg级,可以用于畜禽肉及肉制品中鸡源性成分快速准确地检测,为肉品市场监管提供依据。

