代代花化学成份的分离鉴定和抗氧化活性研究
王天星,姜建国
(华南理工大学食品科学与工程学院,广东广州 510640)
代代花(Citrus aurantium L. var.amara Engl.)属于芸香科柑橘亚属植物,其作为药食两用资源在中国被广泛使用[1]。古代中国人发现其具有行气宽中、消食、祛痰的功能[2],中医称之为福寿草。代代花具有强心、利尿、镇静及减慢心率的功能,能降低神经系统的兴奋性和脊髓反射机能亢进,用于急性病和慢性心功能不全。另外,由于代代花茶的美容功效,使其在中国成为一种很受欢迎的饮料。
经实验证实,代代花中主要含有挥发油类、黄酮类及生物碱类,同时含有强心苷和非强心苷、维生素类、香豆素类以及人体必需氨基酸。相关文献报道其具有抗氧化[3]、抗炎[4]、抗动脉粥样硬化[5]、抗肿瘤[6]、抗病毒[7]、促进肠胃动力和降血脂[8]等药理作用。目前,代代花的研究主要集中于挥发油类化合物,对其他活性成分及其药理作用鲜有报道。研究表明柑橘属植物中黄酮和挥发油等有效活性成分具有很好的抗氧化作用,然而从代代花中分离得到的单体化合物的抗氧化作用研究少之又少[9]。目前关于代代花有效活性成分的抗氧化作用的研究主要集中于代代花总黄酮等非单一成分[10]。
以探索更多代代花单体化合物的抗氧化作用为出发点,本文采用传统柱层析分离技术和现代高效液相制备色谱技术相结合的方法对代代花全草进行了化学成分分析。采用DPPH法、ABTS+·法、铁氰化钾还原法、FRAP法四种抗氧化能力测定方法,对单体化合物进行抗氧化药效实验研究,评价三者对DPPH·自由基和 ABTS+·自由基的清除能力,赤血盐的还原能力以及对Fe3+的还原能力,从而评价单体化合物的总体抗氧化活性。
1 仪器与试剂
1.1 仪器
U300型Thermo高效液相色谱仪;FA1104N型电子分析天平;101AB-2型电热鼓风干燥箱;数控超声波清洗器;HH-2型5000 mL电热套;SB-2000型旋转蒸发仪;SHZ-DⅢ型循环水式真空泵;HWS12型电热恒温水浴锅;多功能酶标仪;ZF-2型三用紫外仪;DBS-100电脑全自动部分收集器;AVANCEⅢHD600型超导核磁共振波谱仪。
1.2 试剂
DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸)、TPTZ(三吡啶基三嗪)均购于美国Sigma公司;代代花(产自浙江黄岩,购买于广州清平药材市场;经中国科学院华南植物园邓云飞研究员鉴定);代代花单体化合物(实验室自制)。甲醇、乙腈为色谱纯;水为纯净水;其余试剂均为分析纯。
2 实验方法
2.1 单体化合物的提取与分离纯化
新鲜干燥的代代花全草适当粉碎过筛,称取3 kg置于5000 mL圆底烧瓶中,按料液比1∶15,用体积分数85%的乙醇分批次加热回流提取,每批次重复三次,每次2 h。合并提取液,3000 r/min速度下离心12 min,取上层清液,将上层清液浓缩至棕褐色浸膏状。将代代花粗提浸膏用适量蒸馏水溶解,依次用等体积的石油醚、氯仿、乙酸乙酯、正丁醇萃取,各萃取3次。将氯仿萃取液浓缩干燥,得到氯仿部位干燥样品13.3 g。经200~300目硅胶柱层析,采用氯仿-甲醇洗脱系统,得到洗脱比例依次为 100∶0、100∶3、100∶5、100∶8、100∶10的五个组分。组分3(100∶5)经TLC薄层色谱点样分析显示有一个主斑点和两个次要斑点,将组分3再次经硅胶柱层析纯化,氯仿∶甲醇=100∶6等度洗脱,得到20个组分。经TLC点样分析显示组分3中的主斑点主要富集于组分3-17中。将组分3-17用LH-20型葡聚糖凝胶柱层析纯化,氯仿-甲醇(1∶1)洗脱得到化合物1(62 mg)。化合物1约占代代花全草干重的0.47%。乙酸乙酯萃取液浓缩干燥样品(42 g)经100~200目硅胶柱层析,氯仿-甲醇系统梯度洗脱,得到洗脱比例依次为 100∶0、100∶1、100∶4、100∶7、100∶10、90∶10、80∶20、70∶30、50∶50、0∶100 的 10 个组分。组分2(100∶1)反复经葡聚糖凝胶柱层析纯甲醇洗脱纯化,冷冻干燥后得到白色粉末状化合物2(16 mg)。化合物2约占代代花全草干重的0.42%。组分5再次经硅胶柱层析,氯仿-甲醇系统洗脱纯化,将各组分经TLC点样分析显示组分5-2含有一个主斑点。将组分5-2反复经葡聚糖凝胶柱层析,纯甲醇洗脱得到化合物3(65 mg)。化合物3约占代代花全草干重的1.7%。
2.2 三种化合物的抗氧化活性测定
精密称取三个单体化合物和Vc适量,加以甲醇和蒸馏水使溶解,制成浓度为800 μg/mL的试样液。采用倍半稀释法将四种溶液配制成 800 μg/mL、400 μg/mL、200 μg/mL、100 μg/mL、50 μg/mL、25 μg/mL 6个浓度的待测液。采用96孔板法,测定三个化合物和阳性对照品在六个浓度下的Fe3+还原能力和对两种自由基的清除能力。总还原力依照文献[11]所述方法进行测定;DPPH自由基清除能力按照文献[12]所述方法进行测定;ABTS自由基清除能力按照文献[13]所述方法进行测定;铁离子还原力(FRAP法)参照文献[14]所述方法进行测定。维生素C作为生物体内一种常见的抗氧化剂,其具有很强的还原性,在查阅大量有关抗氧化能力测定相关文献后,本实验最终采用了维生素C作为四个抗氧化测定体系的阳性对照[15]。
2.3 统计分析方法
抗氧化能力测定实验均设置三个平行,所有数据均以X±SD表示。采用ANOVA法进行显著性检验,p<0.05为统计学上有显著差异。
3 结果与讨论
3.1 化合物结构鉴定
化合物1在冷冻干燥后呈现为白色粉末状物体,以硅胶薄层层析(氯仿-甲醇=100∶13)展开,呈现单一斑点,在紫外波长254 nm条件下呈淡绿色荧光。1H-NMR(400 MHz,DMSO-d6)δ∶ 12.97(1H,S,5-OH),10.41(1H,S,4`-OH), 7.07(1H,d,J=1.7,H-2`),6.88(1H,dd,J=8.1,1.7,H-6`),6.77(1H,d,J=8.1,H-5`),5.87(1H,S,H-6),5.87(1H,S,H-8),5.40(1H,dd,J=12.8,2.8,H-2),3.87(3H,s,3,-O CH3),3.22(1H,transm,H-2),2.66(1H,cisdd,J=17.1,2.8,H-2).13C-NMR(600 MHz,DMSO-d6)δ∶196.3(C-4),166.6(C-7),163.3(C-5),162.8(C-9),147.4(C-3`),146.8(C-4`),12 9.2(C-1`),119.5(C-6`),115.0(C-5`),111.0(C-2`),101.6(C-1 0),94.8(C-6,8),78.6(C-2),55.5(C-OCH3).化合物 1的1H-NMR和13C-NMR数据与已报道文献[16]对比结果一致,确定其为高圣草素,其结构式如图 1。其中,不加粗数字代表碳原子化学位移值大小,加粗数字代表氢原子化学位移值大小。
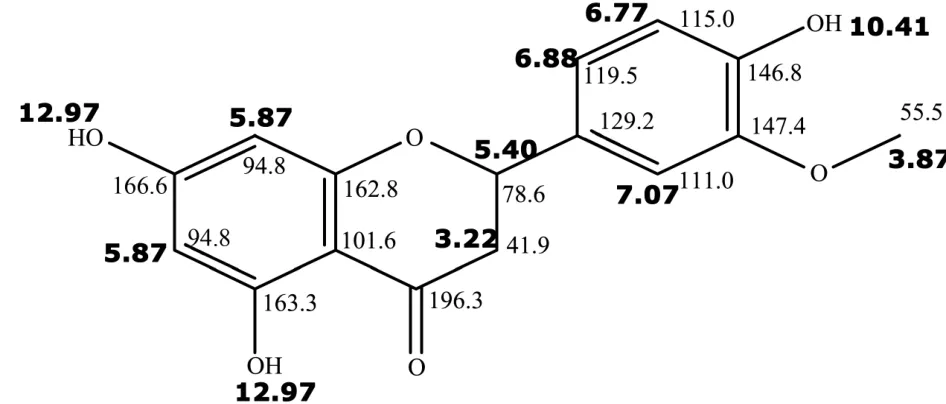
图1 化合物1的化学结构式Fig.1 Chemical formula of compound 1
化合物2为白色带丝光的针状结晶,以硅胶薄层层析(氯仿-甲醇=100∶1)展开,呈现单一斑点,在波长356 nm条件下呈深黄绿色荧光。m.p. 186~187 ℃,ESI-MSm/z201 [M-H]-;1H-NMR (DMSO-d6)δ∶8.25(1H, d,J=9.6 Hz, H-4), 7.89 (1H, d, J=2.2 Hz, H-10),7.19(1H, d, J=2.2 Hz, H-9), 7.14 (1H, s, H-8), 6.24 (1H, d,J=9.6 Hz, H-3);13C-NMR (DMSO-d6)δ∶160.4 (C-2),157.0 (C-7), 152.7 (C-5), 148.0 (C-8a), 144.9(C-10),139.8 (C-4), 112.5 (C-6), 110.9 (C-3), 104.7 (C-9), 103.7(C-4a), 90.9 (C-8).以上波谱数据与文献[17]对比一致,确定化合物2为佛手酚,化学结构式见图2。其中,不加粗数字代表碳原子化学位移值大小,加粗数字代表氢原子化学位移值大小。

图2 化合物2的化学结构式Fig.2 Chemical formula of compound 2
化合物3为无色针状结晶,氯化铁显色剂反应呈紫色,m.p. 228~230 ℃,在波长356 nm紫外条件下呈紫红色色荧光。1H-NMR (400 MHz,CD3OD)δ∶7.46(2H,d,J=8.9Hz,H-2’,6’),7.16 (2H, d, J= 8.9 Hz,H-3′, 5′),5.92 (1H, s, H-8), 5.91 (1H, d, H-6),5.44 (1H,dd, J= 12.4, 3.0 Hz, H-2),4.96 (1H, d, J= 7.0 Hz, H-1″),3.13(1H,dd, J=16.8,12.6Hz,H-3a),2.77 (1H, dd, J=17.4,4. 14 Hz, H-3b),3.40~3.50(m, Glc-H).13C-NMR (150 MHz, CD3OD)δ∶ 196.8 (C-4), 166.9 (C-7), 163.1 (C-5),163.1 (C-9), 146.9 (C-4′),131.5 (C-1′), 127.3 (C-2′, 6′),114.5 (C-3′,5′), 103.1 (C-10), 95.5(C-6),95.1(C-8),78.2(C-2),42.4(C-3).99.4(C-1′),76.4(C-5′),76.0(C-3′),72.8(C-2′),69.3(C-4′),60.5(C-6′)。
以上1H-NMR和13C-NMR数据与已报道文献[18]对比结果一致,确定其为南酸枣苷,结构式如图3所示。其中,不加粗数字代表碳原子化学位移值大小,加粗数字代表氢原子化学位移值大小。

图3 化合物3的化学结构式Fig.3 Chemical formula of compound 3
3.2 化合物抗氧化活性
3.2.1 总还原力
三种化合物和阳性对照Vc在不同摩尔浓度下的总还原力如图4所示。
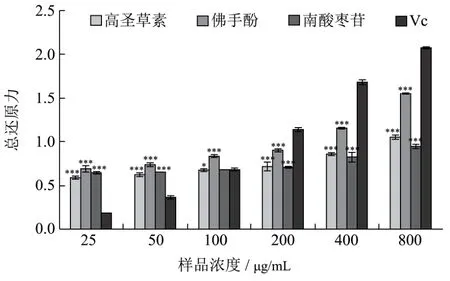
图4 不同样品的总还原力Fig.4 Total reducing power of compound 1, 2, 3 and Vc
由图4可知,三种化合物和Vc的总还原力均呈现一定的剂量依赖关系,即总还原力随着样品浓度的增大而增强。不同样品在相同浓度下的总还原力大小各有不同。当样品浓度低于100 μg/mL时,佛手酚的总还原力最强,其次是南酸枣苷和高圣草素,此时三个化合物的总还原力均强于阳性对照Vc。当样品浓度高于100 μg/mL时,Vc的总还原力最强,其次是佛手酚和高圣草素,南酸枣苷最弱。在最高浓度800 μg/mL时,佛手酚的总还原力为1.554,还原能力接近阳性对照的2.0716。三种化合物显示的较强的还原能力可能与其均含有酚羟基结构有关,它们能够将赤血盐还原成黄血盐,然后在与三价铁离子作用生成普鲁士蓝,以此体现了三者潜在的抗氧化性能。
3.2.2 清除ABTS自由基
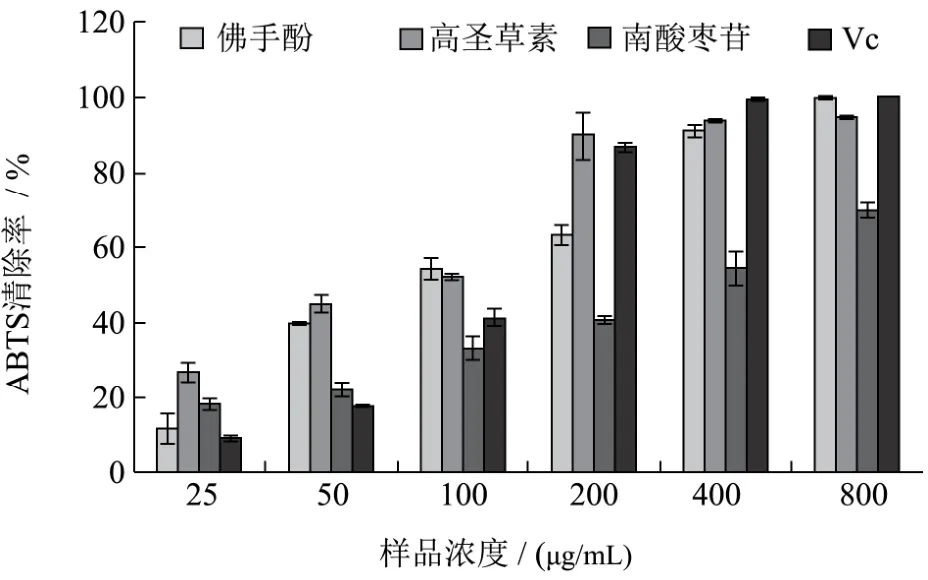
图5 不同样品的ABTS自由基清除效果Fig.5 ABTS scavenging effect of compound 1, 2, 3 and Vc
三种化合物和Vc在不同摩尔浓度下对ABTS自由基的清除效果如图5所示。由图5可知,三种化合物和Vc对ABTS自由基的清除均呈良好的剂量依赖关系。在较低浓度下(50 μg/mL),佛手酚、高圣草素和南酸枣苷对ABTS自由基的清除能力依次为40%、45%和22%,三者的清除能力均高于阳性对照的17%。在中等浓度(100~200 μg/mL)时,佛手酚和高圣草素的清除能力最好,其次是Vc,南酸枣苷最弱。在较高浓度(400~800 μg/mL)时,Vc对ABTS自由基的清除能力最强,且在最高浓度800 μg/mL时,佛手酚和高圣草素的清除率分别为100%和95%,二者清除效果接近或等于阳性对照的 100%。三种化合物含有大量的醇羟基和酚羟基,羟基基团提供的质子通过对自由基基团的清除体现了其较强的自由基清除能力和抗氧化潜能。
3.2.3 清除DPPH自由基
三种化合物和Vc在不同摩尔浓度下对DPPH自由基的清除效果如图6所示。由图6可知,高圣草素对 DPPH自由基的清除率没有随着浓度的增大而升高,在实验设定最高浓度下的清除率仅为24%。佛手酚和南酸枣苷的自由基清除率随着样品浓度的增大而升高,且佛手酚的整体清除效果稍微高于南酸枣苷。在最高浓度800 μg/mL时,佛手酚和南酸枣苷的清除率分别为79%和61%,二者清除效果接近阳性对照的90%。通过与ABTS自由基清除结果比较可知,高圣草素对自由基的清除能力具有一定的选择性。相同浓度下(800 μg/mL),其在保持对ABTS自由基较强的清除能力(95%)的同时,对DPPH自由基的清除率仅为24%。
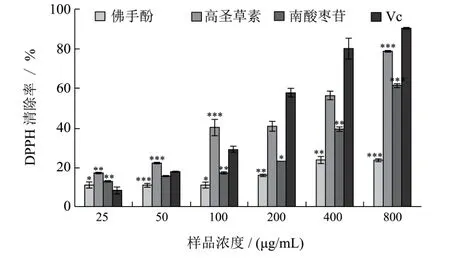
图6 不同样品的DPPH自由基清除效果Fig.6 DPPH scavenging effect of compound 1, 2, 3 and Vc
3.2.4 铁离子还原力
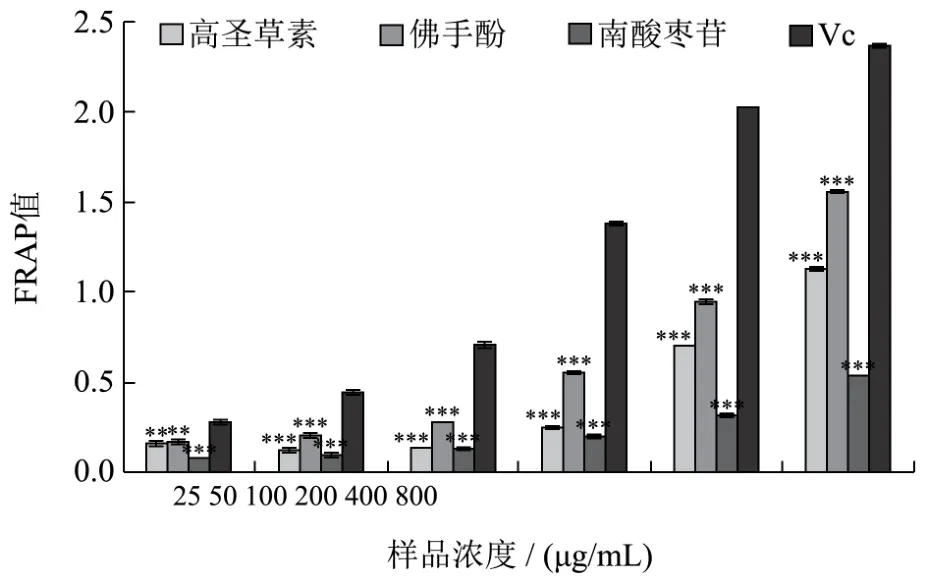
图7 不同样品的铁离子还原能力Fig.7 Fe3+ reducing power of compound 1, 2, 3 and Vc
三种化合物和阳性对照Vc在不同摩尔浓度下对铁离子的还原能力如图7所示。由图7可知,与阳性对照铁离子还原能力具有明显的浓度依赖性不同,南酸枣苷的铁离子还原能力随着浓度的增大平缓增强,在实验设定最高浓度下的 FRAP值仅为阳性对照FRAP值的22.53%。所有样品的铁还原能力均呈一定的剂量依赖关系,其中Vc的还原能力最强,其次是佛手酚和高圣草素,南酸枣苷的还原能力最弱。在最高浓度800 μg/mL时,佛手酚和高圣草素的FRAP值分别为1.5585和1.1239,二者的铁离子还原能力比较接近于阳性对照的2.1682。通过与上述三种体系的结果比较可知,南酸枣苷保持对自由基较强清除能力的同时,其铁离子还原能力较为一般。可能的原因为化合物的给质子能力或清除自由基能力并不能代表其自身的金属离子螯合能力。
4 结论
4.1 代代花乙醇提取物经过分级萃取分别得到代代花氯仿萃取部位和乙酸乙酯萃取部位,然后经过传统柱层析手段,结合高效液相色谱技术从氯仿部位分离得到一个黄酮类化合物高圣草素,从乙酸乙酯部位分离得到一个黄酮类化合物南酸枣苷和一个香豆素类化合物佛手酚,三者均为首次从代代花中分离得到。
4.2 通过四种体外抗氧化能力测定方法,综合评价了三种化合物的抗氧化活性。实验结果表明,三种化合物均具有良好的抗氧化活性,且在不同抗氧化测定指标中,三者的还原能力和对自由基的清除能力具有一定的选择性。佛手酚在四种体系中均表现了很强的抗氧化能力,高圣草素对ABTS自由基的清除能力最强,南酸枣苷则对DPPH自由基的清除能力最为显著。
4.3 代代花富含黄酮和挥发油类成分,主要包括橙皮苷、柚皮苷和新橙皮苷等黄酮类物质。赵海燕[19]对从代代花中分离得到的三个化合物进行了抗氧化活性研究,结果显示三个化合物的总体抗氧化效果较为一般。本文研究表明,代代花中黄酮类化合物和香豆素类化合物具有较强的抗氧化能力。从代代花中分离得到的高圣草素、佛手酚和南酸枣苷在体外抗氧化体系里面表现出的整体抗氧化活性较已报道成分的抗氧化作用更加显著,具有一定的研究价值和应用前景。

