蛇六谷和莪术提取物对小鼠乳腺癌肺转移模型的影响*
高秀飞 刘 培 葛玉清
浙江中医药大学附属第一医院 浙江 杭州 310006
华佗在《中藏经》中提出:“夫痈疽疮肿之所作也,皆五脏六府蓄毒不流则生矣,非独因荣卫壅塞而发者也。”“脏腑蓄毒不化”可能是产生肿瘤的原因。由此,乳腺癌的发生是在“蓄毒”病因的长期刺激下导致“脏腑蓄毒不化”而致“癌毒内生”的过程。“蓄毒”不仅可以影响脏腑气血,导致脏腑失调,影响气血津液的运行,导致痰、瘀内生。痰、瘀、毒相互影响、转化,三者胶着,共同促进了乳腺癌的发展。本实验以化瘀的莪术为对照,观察化痰的蛇六谷对三阴性乳腺癌MDA-MB-231细胞裸鼠肺转移的影响,为中医药抗乳腺癌“痰、瘀、毒”理论提供实验依据。
1 材料
1.1 主要试剂与仪器:RRPMI1640培养基、胎牛血清为美国GIBCO公司产品,CCK-8 Kit(细胞计数CCK8试剂盒)为日本DOJINDO公司产品、二甲基亚砜(DMSO)为SIGMA公司产品。洁净工作台(上海净化设备厂),CO2培养箱(SANYO,日本)。乙醇、石油醚、乙酸乙酯、正丁醇均为分析纯。生物发光成像仪(XGI-8 Gas Anesthesia System)Matrigel basement membrane matrix(BD公司产品),医用显微镜(Nikon,日本),血球计数板,BX60显微镜(Olympus,日本),Chemilmayer 5500/Spectralmayer 5000显微彩色图像分析系统(安莱生命科技有限公司)。DEPC(Sigma),TRIzol(Gibco BRL);Super-Script反转录酶及其缓冲液(Gibco BRL);Taq DNA聚合酶及其缓冲液(Roche);dNTP(Roche);目的基因引物及探针:Takara公司合成。
1.2 细胞:人三阴性乳腺癌细胞株MDA-MB-231由浙江省医学科学院肿瘤研究所惠赠。用10%胎牛血清和10ug/ml人胰岛素的RPMI1640培养液,在37℃细胞培养箱培养备用。构建表达GFP-荧光素酶标记的MDA-MB-231亚细胞系MDA-MB-231-GFP:取经过五次传代的MDAMB-231细胞,用0.125%的胰蛋白酶消化后,吹打使其分散;4℃离心1000rpm/min、5min,吸走上清,再用无菌PBS洗涤2次;用细胞培养液重悬细胞,以每孔2×104个细胞/500μl接种24孔板,置37℃,5%CO2培养箱中培养;待细胞融合率为60%~70%且状态良好时用于慢病毒感染。在感染前将培养基换成低血清的培养基,将已制备好的慢病毒液分别吸取200、100、50μl至3个不同的孔中,并加入polybrene,使其终浓度为10μg/ml。24小时后,换成不含polybrene的完全培养基培养。
1.3 动物:BALB/c裸鼠70只,均为雌性,4周龄,从上海实验动物中心/上海斯莱克实验动物有限公司购买(生产许可证:SCXK沪2012-00002),饲养条件为SPF级。
1.4 药物:蛇六谷由浙江省中医院中药房提供,产地临安,批号201206;莪术由浙江省中医院中药房提供,产地广西,批号201209:表阿霉素由辉瑞制药(无锡)有限公司生产,批号H200000497;生理盐水由上海信谊金朱药业有限公司生产,批号120701。
2 方法
2.1 建立动物模型:将MDA-MB-231-GFP细胞培养,待其生长状态良好时,消化离心后计数并调整细胞悬液的细胞浓度为2×107个/ml。无菌条件下,用4%水合氯醛按10μl/g将裸鼠常规麻醉后,以每只0.2ml尾静脉注射建立裸鼠乳腺癌血液传播模型。
2.2 给药:将裸鼠随机分为6组(A/B/C/D/E/F组),每组10只。注射细胞后3天后进行药物干预:A组:中药蛇六谷水提物组;B组:蛇六谷石油醚提取物组;C组:中药莪术水提物组;D组:莪术石油醚提取物组;E组:表阿霉素组;F组:生理盐水组。给药剂量按照人鼠等效剂量公式dA=dB×(RA/RB)×(WB/WA)1/3进行剂量换算,其中成人体重以60kg计算,裸鼠体重以20g计算。莪术和蛇六谷水提物和石油醚提取物每日灌胃:临床剂量每日30g,人每日临床剂量30g/60kg=0.5g/kg;小鼠每日剂量为人临床剂量20倍,每只小鼠10g/kg×0.02=0.2g,浓度设为1g生药/ml,0.2ml/只/天。表阿霉素每周尾静脉注射:临床用量每3周1次,每次60mg/m2,每周20mg/m2,每周用量为:0.5mg/kg。小鼠每日剂量为人临床剂量10倍,每只小鼠5mg/kg×0.02=0.1mg,浓度设为0.5mg/ml,0.2ml/只/周。100mlGS+50mg的表阿霉素配置。
2.3 检测项目:分述如下。
2.3.1 荧光生物成像:用生物发光成像仪体外观察裸鼠体内肿瘤细胞转移情况,检测裸鼠的肺是否存在转移灶。腹腔内注射0.2mlGFP-荧光素酶标记的MDA-MB-231的底物,10min后放入异氟醚麻醉箱麻醉,采用生物发光成像仪(XGI-8 Gas Anesthesia System,图1)测量(在浙江理工大学生命科学院检测),LuminaⅡ Living Image 4.2分析。

图1 生物发光成像仪
2.3.2 测肺重:在药物干预后的第4周,每组脱颈处死裸鼠5只,解剖观察有无肺转移。取出肺等组织,用电子天平称重。切取部分肿瘤组织0.5cm×0.5cm×0.5cm大小进行石蜡包埋切片,部分肿瘤组织剪碎,液氮保存。计算肺转移增重率,计算公式如下:增重率(%)=[(实验组平均肺重-空白对照组平均肺重)/空白对照组平均肺重]×100%;在药物干预后的第5周,实验结束,脱颈处死所有裸鼠,解剖观察有无肺转移。取出肺等组织,称重;切取部分肿瘤组织进行石蜡包埋切片,部分肿瘤组织剪碎,液氮保存。
2.3.3 Western Blot检测肺组织的粘附因子E-cadherin、E-selectin和趋化因子CCR7、SDF-1、CXCR4蛋白表达:提取各转移灶组织中的蛋白质,将组织在液氮中碾碎后,转移至匀浆器中;在预冷的细胞裂解液中添加PMSF/异丙醇储备液并加入到匀浆器中,冰浴条件下充分研磨后转移至无菌1.5ml的离心管中,离心后转移上清液至一新的1.5ml离心管中,即为组织蛋白提取液。BCA定量法测定提取液中蛋白质浓度后即可进行蛋白质印迹。检测各转移灶组织中E-cadherin、E-selectin、CCR7、SLC、SDF-1、CXCR4的蛋白质表达量。
2.3.4 Real-time PCR方法检测肺组织的粘附因子E-cadherin、E-selectin 和趋化因子 CCR7、SLC、SDF-1、CXCR4基因表达:提取各转移灶组织的RNA:在液氮中将组织在预冷的研钵中研碎,待研磨成粉末状后转移至玻璃匀浆器中,加入适量的Trizol,冰浴条件下轻轻充分研磨,待液体澄清后转移至无菌1.5ml的离心管中。按照Trizol提取RNA方法,依次加入氯仿分层、异丙醇抽提RNA、75%无水乙醇洗涤后,用DEPC水溶解RNA沉淀,测定浓度及OD值。检测各转移灶组织中E-cadherin、E-selectin、CCR7、SLC、SDF-1、CXCR4的mRNA表达量。
3 结果
3.1 荧光生物成像:从生物发光成像仪体外观察裸鼠体内肿瘤细胞转移情况,经尾静脉注射MDA-MB-231-GFP细胞后各药物干预4周后观察到:各组模型中均可见乳腺癌肺转移,蛇六谷水提物组、莪术石油醚提取物组能明显抑制MDA-MB-231-GFP经血液传播转移程度。见图2。
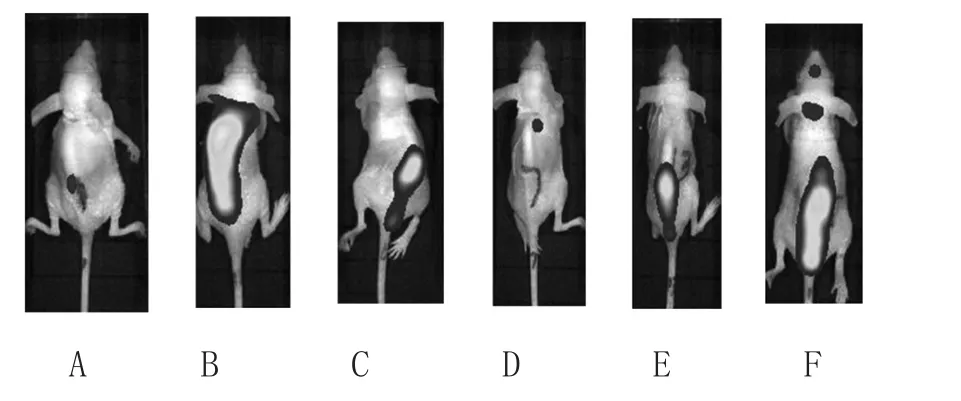
图2 各组药物干预4周后的尾静脉注射MDA-MB-231-GFP裸鼠荧光成像
经尾静脉注射MDA-MB-231-GFP细胞后各药物干预5周后观察到:蛇六谷水提物组、蛇六谷石油醚提取物组、莪术石油醚提取物组、表阿霉素组能明显抑制MDAMB-231-GFP经血液传播转移程度。见图3。
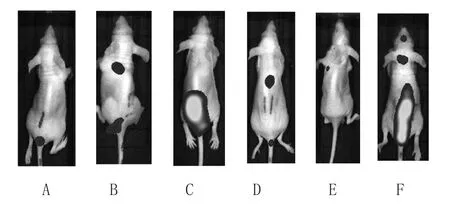
图3 各组药物干预5周后的尾静脉注射MDA-MB-231-GFP裸鼠荧光成像
3.2 测体重和肺重:采用多样本均数间比较的单因素方差分析,方差齐性检验,P=0.079,提示方差齐,采用LSD法,结果显示实验前BALB/c裸鼠各组间体重差异无统计学意义,排除体重对实验结果的影响。见表1。
表1 各实验组BALB/c裸鼠实验前体重(±s,g)
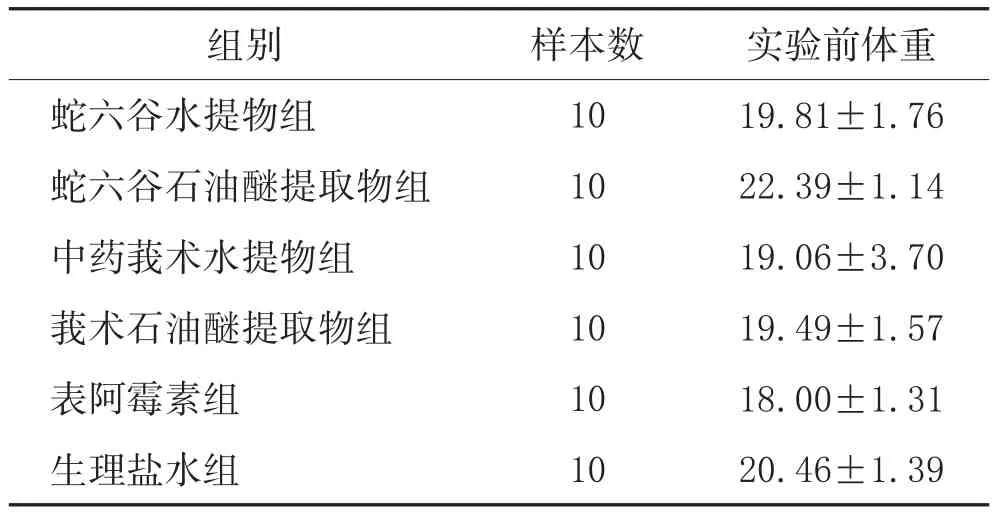
表1 各实验组BALB/c裸鼠实验前体重(±s,g)
实验前体重19.81±1.76 22.39±1.14 19.06±3.70 19.49±1.57 18.00±1.31 20.46±1.39组别蛇六谷水提物组蛇六谷石油醚提取物组中药莪术水提物组莪术石油醚提取物组表阿霉素组生理盐水组样本数10 10 10 10 10 10
采用多样本均数间比较的单因素方差分析,方差齐性检验,P=0.168,提示方差齐,采用LSD法,结果显示在造模后连续给药5周后,各组体重都降低,降低后的体重各组间的差异无统计学意义。见表2。各实验组各自治疗前后量表自身对照结果,组内配对t检验比较均P>0.05,体重降低无统计学意义。
表2 各实验组BALB/c裸鼠实验后体重(±s,g)
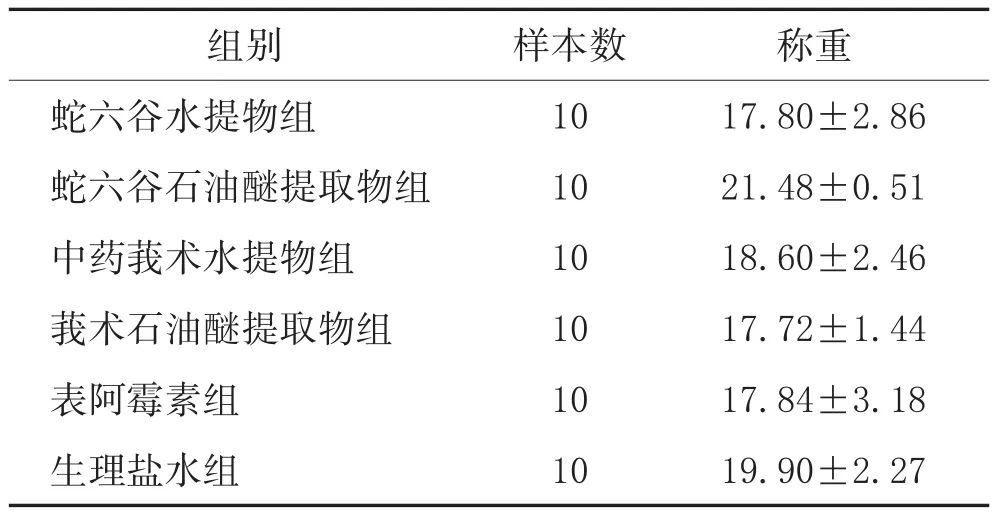
表2 各实验组BALB/c裸鼠实验后体重(±s,g)
称重17.80±2.86 21.48±0.51 18.60±2.46 17.72±1.44 17.84±3.18 19.90±2.27组别蛇六谷水提物组蛇六谷石油醚提取物组中药莪术水提物组莪术石油醚提取物组表阿霉素组生理盐水组样本数10 10 10 10 10 10
在药物干预后的第4周,每组脱颈处死裸鼠5只,取出肺等组织,用电子天平称重,计算肺组织增重率,计算公式如下:增重率(%)=[(实验组平均肺重-空白对照组平均肺重)/空白对照组平均肺重]×100%;表阿霉素肺增重不明显,蛇六谷和莪术肺增重均明显,其中蛇六谷石油醚提取物组肺增重最少(21%),结果如表3。

表3 各实验组BALB/c裸鼠给药4周肺增重率
在药物干预后的第5周,每组脱颈处死裸鼠,取出肺等组织,用电子天平称重,计算肺组织转移增重率,各组的肺组织与生理盐水组比较,均增重明显。表阿霉素肺组织增重最低,抑制肺转移作用最强;蛇六谷和莪术肺增重均明显,其中蛇六谷石油醚提取物组肺增重最少(18%),结果如表4。

表4 各实验组BALB/c裸鼠给药5周肺增重率
3.3 Western Blot检测肺组织的粘附因子E-cadherin、E-selectin和趋化因子CCR7、SDF-1、CXCR4蛋白表达:结果显示,与生理盐水组对比,各组药物均降低了E-cadherin、CCR7蛋白表达;蛇六谷水提取上调E-selectin、CXCR4蛋白表达;蛇六谷石油醚和莪术石油醚提取物提取物上调SDF-1、CCL21蛋白表达,且蛇六谷石油醚作用强于莪术石油醚提取物(P<0.05)。表阿霉素作用均为下调粘附因子和趋化因子的蛋白表达。见图4、5。
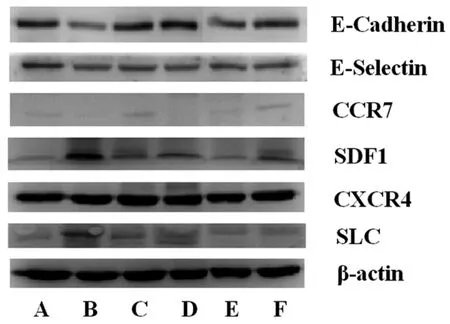
图4 各药物对肺组织中粘附因子、趋化因子蛋白表达的影响
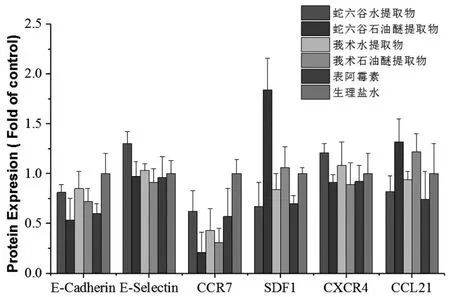
图5 各药物对肺组织中粘附因子、趋化因子蛋白表达的影响
3.4 Real-time PCR方法检测肺组织的粘附因子E-cadherin、E-selectin 和趋化因子 CCR7、SLC、SDF-1、CXCR4基因表达:结果显示,与生理盐水组比较,蛇六谷水提物、蛇六谷石油醚提取物均可显著提高细胞内粘附因子 E-cadherin、E-selectin、CCR7 mRNA表达(P<0.05),莪术石油醚提取物下调E-cadherin、E-selectin、CCR7 mRNA表达;蛇六谷水提物、莪术石油醚提取物提高CXCR4 mRNA的表达,且蛇六谷水提取作用强于莪术石油醚提取物(P<0.05)。见图6。
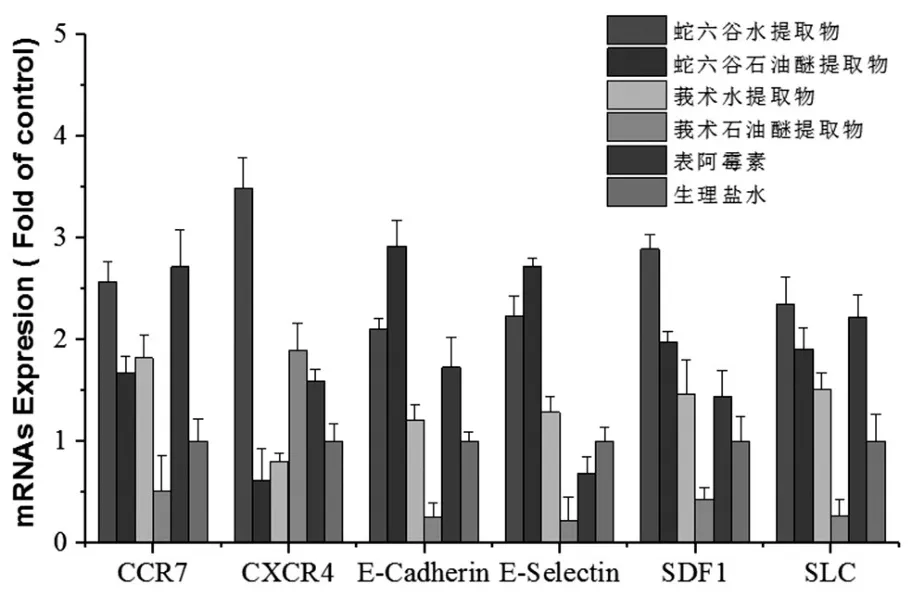
图6 各药物对肺组织中粘附因子、趋化因子mRNA表达的影响
4 讨论
三阴性乳腺癌(triple-negative breast cancer,TNBC)在乳腺癌中约占15~20%,该类型乳腺癌所表达的雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(Her-2)均为阴性,因其靶受体的丧失,三阴性乳腺癌患者不能受益于基于激素或曲妥珠单抗的靶向治疗[1]。故化疗仍然是该类型乳腺癌早晚期主要治疗方法[2]。尽管三阴性乳腺癌患者对化疗药物如紫杉烷类和蒽环类药物的初始反应优于其他乳腺癌亚型,但因其较易形成耐药且病情进展快速,预后仍然很差[1,3]。
中医药由于具有辨证论治的特点,符合肿瘤个体化治疗的要求,有助于减轻放、化疗的毒副反应,可以达到抗转移防复发、提高生活质量、延长生存期、提高生存率的目的。近年来,中医药在预防乳腺癌根治术后的复发以及治疗并发症方面起到了显著的作用。在三阴性乳腺癌治疗上,中医药能提高患者免疫力和降低复发转移[4-6]。
既往研究蛇六谷和莪术均能抑制三阴性乳腺癌细胞株的增殖作用[7-8],本研究结果证实蛇六谷和莪术抗三阴性乳腺癌肺转移的作用,活血化痰解毒中药抑制乳腺癌肺转移,通过“以药测证”演绎“以方测证”,提示了乳腺癌肺转移“痰、瘀、毒”理论。其中化痰解毒的蛇六谷水提物作用较活血解毒的莪术强,这也同样提示乳腺癌肺转移痰毒最甚。蛇六谷、莪术对粘附因子和趋化因子基因和蛋白表达上不平衡,这是因为中药成分复杂,抗肿瘤作用机理是多靶点的,对三阴性乳腺癌作用的信号特异性转导通路、血管生成等方面影响诸多。蛇六谷抗肿瘤转移的临床和实验研究较多[9],针对中药对肿瘤复发转移的机理研究还有待于深入、细致的研究。诸类研究为今后治疗三阴性乳腺癌的临床药物应用提供试验依据和理论基础。

