TNF-α、IL-1β、HOMA-IR水平变化与2型糖尿病发病相关性分析及作用机制研究
迟鹏威
(许昌市人民医院,河南 许昌461000)
2 型糖尿病 (type 2 diabetes mellitus,T2DM)的病情持续性进展,可以导致患者心血管系统、肝肾功能等组织器官的功能衰竭,促进病死率及致残率的上升。流行病学研究显示,T2DM的发病率可达223~345/1万人左右,在具有肥胖症或者高血压等基础性疾病的人群中,T2DM的发病率可进一步上升[1,2]。在探讨T2DM的发病机制的过程中发现,细胞生物学因子的改变能够通过促进胰岛B细胞的功能衰竭,促进细胞炎症因子富集导致损害及氧化应激性损伤等,进而促使胰岛素分泌障碍,降低胰岛素受体敏感性[3,4]。肿瘤坏死因子-α(Tumor Necrosis Factor alfa,TNF-α)、 白细胞介素(interleukin;IL)等,能够通过对下游细胞炎症因子如IL-6等的上调,加剧胰岛B细胞膜完整性的破坏,导致B细胞囊泡分泌机制的障碍[5,6];稳态模型(Homeostasis model assessment,HOMA) 是评估胰岛素抵抗的重要指标,其能够评估外周组织细胞膜受体的敏感性及对于胰岛素降糖作用的整体效果[7]。部分研究揭示了相关指标在T2DM患者中的异常表达情况,但缺乏对于相关指标与患者体内氧化应激指标等的关系研究。为了进一步评估TNF-α、IL-1β、HOMA-IR 水平在 T2DM 病情进展过程中的作用,本次研究选取2016年2月-2017年5月在我院接受治疗的2型糖尿病患者为研究对象,探讨了相关指标与一氧化氮合酶(NOsynthase,NOS)、超氧化物歧化酶Orgotein(Superoxide Dismutase,SOD)等的关系,报道如下。
1 资料与方法
1.1 患者一般资料 选取 2016年2月-2017年 5月在我院接受治疗的2型糖尿病患者为研究对象。纳入标准:⑴年龄≥18周岁;⑵中华医学会关于2型糖尿病的诊断标准[1];⑶无其他系统严重疾病者;排除标准:⑴临床资料不全者;⑵合并高血脂、免疫功能障碍等疾病者。根据纳入排除标准共纳入病例数60例,其中男37例,女23例,年龄28-68 岁,平均 49.65±4.83 岁;对照组纳入排除标准:年龄≥18周岁,合并感染等其他疾病者,共纳入对象60例,男35例,女25例,年龄 30~67岁,平均49.67±5.02岁。两组研究对象的一般资料比较无明显差别,具有可比性。
1.2 检测方法 稳态模型 (Homeostasis model assessment,HOMA)计算方式:空腹血糖水平(FPG,mmol/L)×空腹胰岛素水平 (FINS,mIU/L)/22.5,采用ELISA法检测血糖水平并计算HOMA值,检测仪器Merck生化仪器购自南京碧云天生物科技有限公司。
采集空腹静脉血约5ml并分作两份,一份自然凝固后以3000r/min离心10min,取上清液采用酶联免疫吸附法测定血清中 TNF-α、IL-1β、NO、NOS、SOD、MDA水平,检测试剂盒购自北京中杉金桥生物有限公司,具体检测步骤严格按照试剂盒说明书进行操作;另一份置于枸橼酸钠抗凝管内,利用胶体金法检测TC、LDL-C、TG和空腹血糖水平,试剂盒购自上海奥普生物医药有限公司;胰岛素的检测采用全自动生化检测方法,HSO-900系列检测仪器购自南京碧云天生物科技有限公司,配套试剂购自南京凯基生物科技公司,具体检测步骤严格按照试剂盒说明书进行。
1.3 评价指标 观察两组研究对象TNF-α、IL-1β、HOMA-IR水平、血糖波动、血脂、氧化应激指标的差异,分析 2 型糖尿病患者 TNF-α、IL-1β、HOMA-IR水平变化与血糖波动、血脂、炎症因子、氧化应激指标的相关性。
1.4 统计学处理 数据录入后, 采用SPSS 19.0软件进行统计分析。计数和计量资料分别采用例和均数±标准差表示。两组研究对象TNF-α、IL-1β、HOMA-IR水平、血糖波动、血脂、氧化应激指标的比较采用t检验进行分析,采用Pearson相关分析法分析 2 型糖尿病患者 TNF-α、IL-1β、HOMA-IR水平变化与血糖、血脂、氧化应激指标的相关性。P<0.05;差异有统计学意义。
2 结果
2.1 两组研究对象 TNF-α、IL-1β、HOMA-IR 水平的比较 表1显示,观察组患者的血清TNF-α、IL-1β、HOMA-IR 水平均高于对照组 (t=-14.101、-14.747、-6.878,P<0.001)。
2.2 两组研究对象血糖和血脂水平的比较 表2显示,观察组患者的TC、LDL-C、TG和空腹血糖水平均高于对照组,HDL-C水平低于对照组。
2.3 两组研究对象氧化应激指标的比较 表3显示,观察组患者的NO、NOS、SOD水平低于对照组,MDA水平高于对照组。
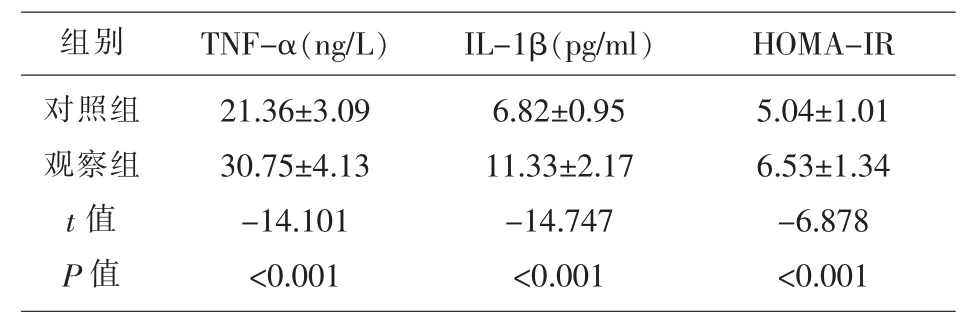
表1 两组研究对象TNF-α、IL-1β、HOMA-IR水平的比较
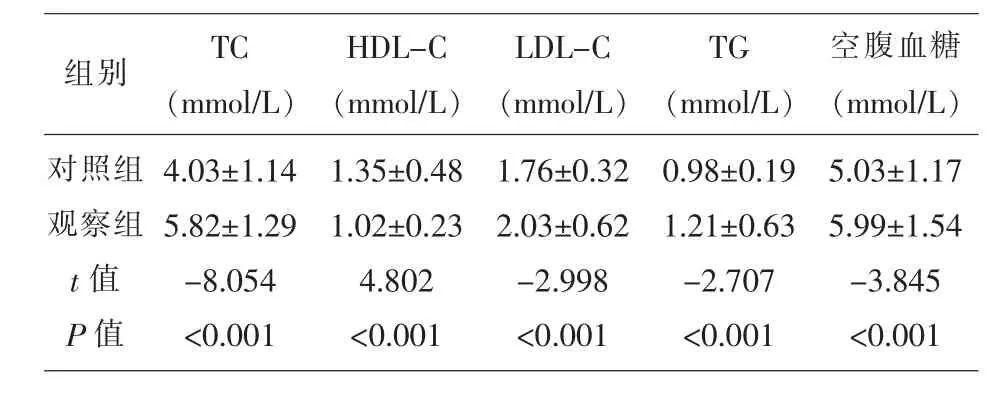
表2 两组研究对象血糖和血脂水平的比较
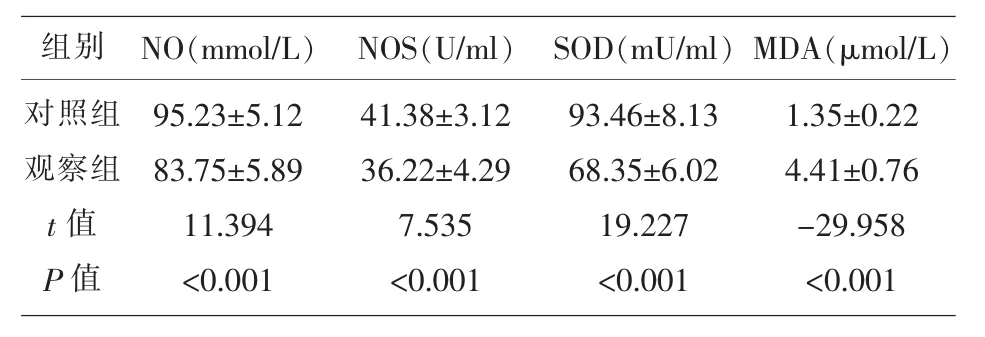
表3 两组研究对象氧化应激指标的比较
2.4 TNF-α、IL-1β、HOMA-IR 水平变化与血糖、血脂、氧化应激指标的相关性 表4显示,2型糖尿病患者的 TNF-α、IL-1β、HOMA-IR 水平与 TC、LDL-C、TG、空腹血糖、MDA 水平正相关,与 HDLC、NO、NOS、SOD 水平负相关。
3 讨论
T2DM的发生主要考虑与胰岛素抵抗的发生或者胰岛素敏感性的下降有关,在年龄大于45岁合并有慢性基础性疾病或者其他不良生活习惯的人群中,T2DM的发病率可进一步上升。T2DM导致的微血管病变,可以导致患者糖尿病肾病或者糖尿病视网膜病变等终末期疾病的发生,增加了不良临床预后的发生风险[8,9]。本次研究通过对于血清中相关指标的分析,可以为揭示胰岛素抵抗的发生病因提供理论依据,从而为改善胰岛素敏感性,提高残存胰岛B细胞的功能提供参考。
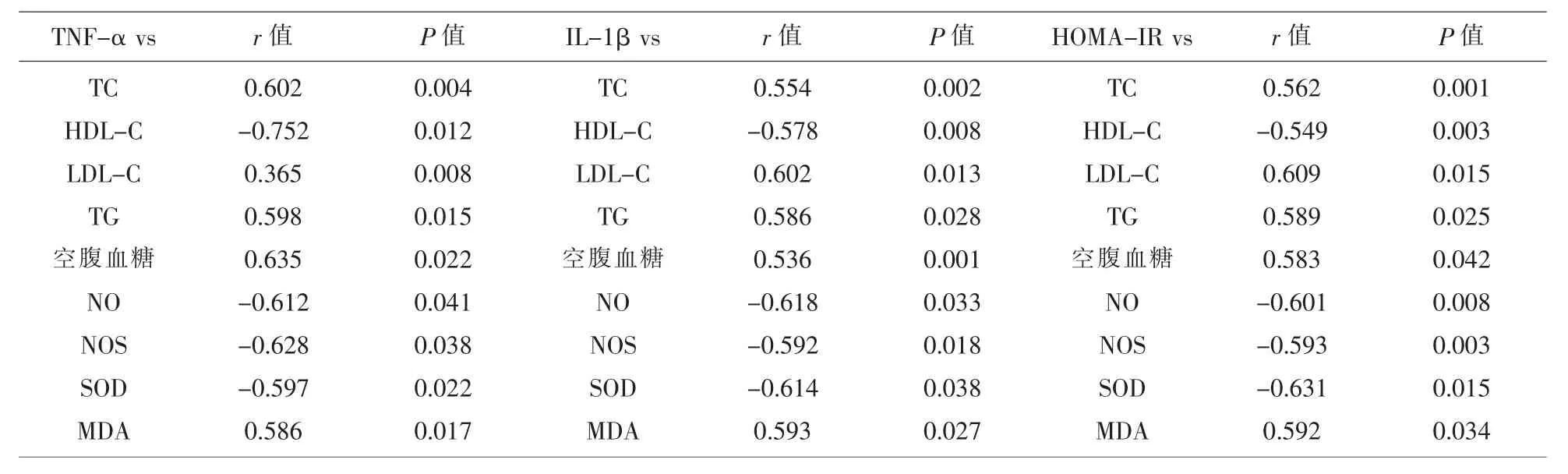
表4 TNF-α、IL-1β、HOMA-IR水平变化与血糖、血脂、氧化应激指标的相关分析
炎症因子或者趋化因子的异常表达在促进T2DM的发生过程中具有重要的作用,其可以通过富集下游趋化因子或者补体成分,促进患者胰岛B细胞膜的炎症损伤,增加B细胞膜内的内质网或者线粒体的损伤,增加患者胰岛素的合成及分泌功能的障碍。TNF-α、IL-1β对于胰岛B细胞的功能损伤作用不仅体现在对于患者炎症损伤方面,同时对于患者的胰岛素的囊泡运输、胰岛素受体结合的效能等方面同样具有一定的作用。同时TNF-α、IL-1β等指标还能够影响到SOD的合成,增加SOD的细胞毒性作用[10]。TNF-α、IL-1β等指标在T2DM患者血清中的高表达表现,认为高表达的相关指标对于胰岛B细胞凋亡具有显著的作用;HOMA-IR是评估胰岛素抵抗的直接指标,HOMA-IR的上升往往提示患者体内组织细胞对于胰岛素的利用及敏感性的不足[11,12], 但对于HOMA-IR与患者体内氧化还原应激指标如NOS、SOD等关系的研究不足。
本次研究发现,在糖尿病组患者血清中存在明显的相关指标的高表达,其中TNF-α、IL-1β的上升主要考虑与体内氧化因反应的加剧,炎症因子趋化效应的激活等因素有关,TNF-α、IL-1β的上升能够在下列几个方面促进T2DM的病情进展:⑴TNF-α、IL-1β可以直接促进患者胰岛B细胞的功能损伤,促进患者胰岛素的蛋白结构的破坏,影响到其降糖效果;⑴TNF-α、IL-1β等还能够在增加糖尿病患者的胰岛细胞的信号转导通路等方面发挥作用,促进患者胰岛细胞的衰竭。邓琳等[13,14]研究者在探讨了部分具有明显合并症的糖尿病患者血清学相关指标的变化后发现,病例组患者血清中TNF-α、IL-1β的上升幅度可达45%以上,且患者的病情越为严重,合并症越多,临床治疗效果越差,TNF-α、IL-1β等指标的上升越为明显。HOMA-IR的上升则主要考虑与患者的胰岛素抵抗的加剧,受体敏感性的下降等有关。总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)等能够影响到胰岛B细胞的局部缺血性血流灌注的发生,增加局部血流灌注阻力,导致胰岛B细胞的功能退化,本次研究中TC、LDL-C、TG等指标的表达水平较高,而HDL-C的表达水平较低,失去了其对于血脂代谢水平的稳定作用。NO、NOS、SOD水平是评估患者体内还原反应的重要指标,而MDA可以评估患者体内的氧化性指标,对于相关指标的研究提示T2DM患者体内存在明显的高氧化反应、低还原反应状体,这主要考虑与长期的氧化还原指标平稳紊乱导致的线粒体损伤,从而促进胰岛B细胞的程序性坏死有关[15]。最后,本次研究发现TNF-α、IL-1β、HOMA-IR等与T2DM患者血脂代谢或者氧化应激还原性指标均具有密切的关系,这主要考虑可能与相关指标能够影响到肝脏对于血脂代谢的调控,或者影响到内脏组织器官对于MDA、SOD的代谢有关。进一步提示了TNF-α、IL-1β、HOMA-IR等与T2DM患者病情的密切关系。
综上所述,2型糖尿病患者的TNF-α、IL-1β、HOMA-IR水平较高,且与患者德血糖、血脂和氧化应激指标密切相关,可作为患者临床监测的重要指标。

