血浆补体因子H相关蛋白2在先天性心脏病合并肺动脉高压儿童中的改变
尉新华 ,张伟涛 ,张金涛 ,徐红亮 ,杨玉齐 ,范顺阳 ,李群
(1、阜外华中心血管病医院儿童心脏中心,河南 郑州450000;2、郑州大学第三附属医院心外科,河南 郑州 450052)
先天性心脏病(congenital heart disease,CHD)是胎儿时期出现的心血管发育异常的一种先天畸形,也是儿童最常见的先天畸形[1]。我国CHD发病率为0.6%~0.8%。有研究表明,10%的CHD患儿合并肺动脉高压 ((pulmonary arterial hypertension,PAH)[2]。CHD患儿合并PAH,尤其是出现艾森曼格综合征时,其致残率和病死率显著升高,严重危害儿童的身心健康[3]。CHD患儿选择药物保守治疗或介入、手术等治疗方式,主要取决于对PAH的准确诊断和评估[4]。PAH诊断的金标准为右心导管检查,但属于有创性检查,临床应用受到限制[5]。PAH相关生物标志物的研究成为近年来的热点。既往研究显示,CHD-PAH患儿血浆中与炎症、补体激活系统和凝血机制密切相关的CFH-R2水平降低[6]。因此,本研究旨在综合评价血浆补体因子H相关蛋白2在先天性心脏病合并肺动脉高压儿童中的变化情况,为临床后续研究提供思路和方法。
1 资料与方法
1.1 一般资料 选取本院2015年6月到2016年12月期间我院心内科和心外科收治的89例CHD患儿。选取同时期来我院体检的健康儿童40例作为对照组。入选标准:①所有入选患儿均符合2010年欧洲心脏病学会制定的CHD诊断标准[7],CHD合并PAH诊断标准符合美国心脏病协会制定的PAH诊疗指南[8];②年龄:6月~12岁;③患儿家属均签署知情同意书。排除标准:①合并其他脏器严重疾病者;②患儿为原发性肺动脉高压,或其他原因导致的肺动脉高压;③入院前1月内服用降低肺动脉压药物者。本研究经过本院伦理委员会审核通过。
1.2 方法 收集所有入选研究对象的基线资料,包括年龄、性别、身高、体重、血压等。CHD患儿术前采用心导管测量肺动脉压,并根据肺动脉压值进行分组:无肺动脉高压组,肺动脉压<30mmHg;轻度组,肺动脉压30~39mmHg;中度组,肺动脉压40~69mmHg;重度组,肺动脉压>70mmHg。CFH-R2采用酶联免疫吸附法(ELISA)测定,ELISA试剂盒购自美国Cusabio biotech公司。采集外周静脉血,全血分离后取上层血浆进行检测,严格按照试剂盒说明书进行检测。
1.3 统计学方法 对所有数据采用SPSS 17.0进行分析,计量资料以均数±标准差(±s)表示,组间比较采用ANOVA检验,两两比较采用LSD-t检验;计数资料用率来表示,采用χ2检验;以P<0.05有统计学差异。
2 结果
2.1 一般基线资料比较 本研究共纳入129例研究对象,其中对照组40例,CHD组患儿89例。两组年龄、性别构成、身高、体重、血压等比较无统计学差异(P>0.05),见表 1。
2.2 4组肺动脉压及CFH-R2水平比较 CHD患儿无肺动脉高压组、轻度组、中度组、重度组血浆CFH-R2水平显著低于对照组,比较差异有统计学意义 (P<0.05);CHD患儿中, 无肺动脉高压组CFH-R2水平最高,重度组CFH-R2水平最低,差异比较有统计学意义(P<0.05),见表 2。
2.3 血浆CFH-R2水平与肺动脉压相关性 Pearson相关分析表明,CHD患儿肺动脉压与血浆CFH-R2 水平负相关(r=-0.638,P<0.05)。 见图 1。
3 讨论
目前,临床上对CHD-PAH的研究主要以临床诊断、治疗以及预后的评估方面,对其发病的病理基础研究,尤其是基因和蛋白水平领域较少。Lavoie等[9]通过诱导PAH动物模型,发现PAH鼠肺组织中存在 CapZα、cathepsin、annexin A4 等差异蛋白,分别与肺组织内蛋白酶体、细胞膜骨架蛋白有关,提示这些蛋白可能参与了PAH时肺组织血管的重塑过程。该研究同时采用定量的蛋白组学研究方法,发现了健康人群与单纯CHD患儿和CHD合并PAH患儿之间血浆蛋白谱的差异,并认为有差异的蛋白与凝血机制、炎症和免疫系统密切相关。本研究中,单纯CHD患儿和CHD合并PAH患儿血浆CFH-R2水平显著低于健康儿童,考虑CFH-R2可能与患儿的免疫系统或凝血机制缺陷相关。

表1 一般基线资料比较
表2 4组肺动脉压及CFH-R2水平比较(±s)
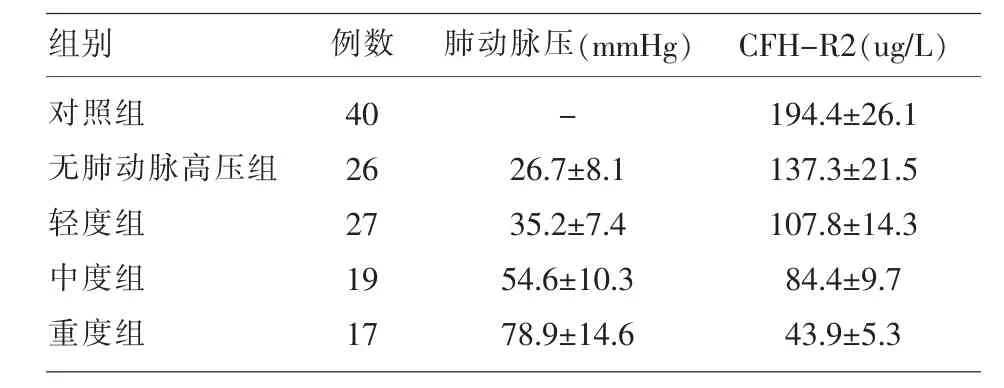
表2 4组肺动脉压及CFH-R2水平比较(±s)
组别对照组无肺动脉高压组轻度组中度组重度组例数40 26 27 19 17肺动脉压(mmHg) CFH-R2(ug/L)-26.7±8.1 35.2±7.4 54.6±10.3 78.9±14.6 194.4±26.1 137.3±21.5 107.8±14.3 84.4±9.7 43.9±5.3
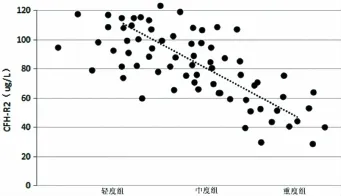
图1 CFH-R2水平与肺动脉压的相关性分析
补体系统是血清中的多种糖蛋白组成的蛋白酶降解系统,是免疫系统的重要组成部分。包括3条途径:经典途径、凝集素途径以及旁路途径。补体因子H(CFH)是旁路途径的重要调控因子,抑制旁路途径的活化和放大反应[10]。CFH相关蛋白由CFH-R1、CFH-R2、CFH-R3、CFH-R4、CFH-R5 等5中相关蛋白构成,每种相关蛋白均可与补体C3b结合。CFH-R2是新型的补体调节因子,在宿主细胞膜的表层通过多价阴离子进行结合,与B因子等竞争性结合补体C3b,干扰C3转化酶功能,调节补体系统的活化[11]。此外,CFH与I因子协同作用可加速C3b的灭活,防止旁路途径过度活化和放大效应损伤集体细胞[12,13]。本结果中可见,CHD患儿血浆中CFH-R2水平显著低于健康对照组儿童,提示CFH-R2在CHD患儿发病的病理生理中起到一定的作用。血浆CFH-R2水平降低考虑可能与其抑制补体系统的激活,进而导致该蛋白过度消耗有关,补体系统活化能能够加速肺组织内血管的重塑,同时促进凝血过程[14]。Humbert[15]研究结果表明,PAH患儿肺部病理学表现为原位微小血栓的形成。CHD患儿中,无肺动脉高压组CFHR2水平最高,重度组CFH-R2水平最低,提示,且病情越严重,也越严重。Pearson相关分析表明,CHD患儿肺动脉压与血浆CFH-R2水平负相关。由此可推测,CHD患儿随着病情进展,心脏损害程度加重,CFH-R2被消耗用于抑制补体系统的活化,延缓肺内血管的重塑和凝血过程;但随着病情加重,肺动脉压升高,CFH-R2大量消耗,水平显著降低。
综上所述,CHD合并PAH患儿血浆CFH-R2水平显著降低,CFH-R2水平与肺动脉压呈负相关,有可能作为CHD合并PAH的生物学标志之一。但本研究仍存在一些不足之处,按照严格的入选标准,样本量较少,导致结果可能存在偏倚,需进一步研究。

