新余地区2013年-2015年H3N2、B型流感病毒NA基因特性分析
文奇 ,周银古 ,付倩 ,敖冬生 ,熊英 ,施勇
(1、新余市疾病预防控制中心,江西 新余338000;2、江西省疾病预防控制中心,江西 南昌 330029)
流感病毒分为甲型(A)、乙型(B)和丙型(C),字母不仅反映了病毒被发现的时间顺序,更反映了对人类的危害程度。目前人类A型流感中,新H1N1亚型自2009年秋季取代原有的季节性H1亚型后,与H3N2亚型共同成为A型流感的流行株。B型流感病毒不分亚型,但根据其抗原性和基因特征可以分为不同抗原谱系。自1983年以来,B型流感病毒分为两个系:B-Victoria系和B-Yamagata系,代表株分别为B-Victoria/2/87和B-Yamagata/16/88,且两个系流感病毒在全球共同流行[1]。C型流感以散发形式存在,主要侵袭婴幼儿,一般不引起流感流行[2],因此没有列入流感监测范围。本文就日常监测中现存时间较长的H3N2亚型和B型流感病毒作为研究对象,通过NA基因序列分析法来阐述新余地区2013-2015年H3N2、B型流感病毒NA基因特性,为新余地区流感的预防控制及临床治疗提供参考依据。
1 材料与方法
1.1 毒株来源 选择来自2013年-2015年不同时间内流感监测医院或流感暴发疫情病例咽拭子标本中分离到的 10株 H3N2、8株 B型 Victoria系(简称 BV)、15株 B型 Yamagata系(简称 BY)流感病毒进行基因扩增和测序,所选毒株均经国家流感中心HA血凝抑制试验复核确认。
1.2 病毒RNA提取 采用德国Qiagen公司的RNeasy Mini Kit 试 剂 盒 (Cat.No:74106,Lot No:145022097)说明书提取病毒RNA。
1.3 RT-PCR扩增NA基因 采用QIAGEN One Step RT-PCR Kit试剂盒进行RT-PCR反应,NA引物及反应条件参照相关文献[3],在BIO-RAD PTC-200仪器上进行扩增。
1.4 核苷酸序列测定 RT-PCR产物送上海生工生物工程技术服务有限公司进行纯化和双向测序。
1.5 序列分析 采用DNAStar5.0、Mage5.0序列分析软件(包)对测序文件的双向序列进行拼接、对比和遗传进化分析,选取2012年-2014年北半球疫苗推荐株A/Vitorvia/361/2011(H3N2)、2014年-2015年北半球疫苗株 A/Texas/50/2012(H3N2)、2009年-2012年北半球疫苗株B/Brisbane/60/2008(BV)、2012年-2013年北半球疫苗株B/Wisconsin/01/2010(BY)、2013年-2015年北半球疫苗株B/Massachusetts/02/2012(BY)作为对比毒株,从 Influenza Research Database中下载NA基因序列,收录 号 分 别 为 KJ942682、KC892237、CY073894、JN993033、KC891815。
2 结果
2.1 H3N2亚型NA基因特性分析
2.1.1 核苷酸进化和同源性 10株H3N2分离株NA基因核苷酸双向序列经拼接、对比后,均获得长度为1407bp的编码序列,编码469个氨基酸,对其构建核苷酸进化树,以疫苗株A/Vitorvia/361/2011(H3N2)作为参照毒株,将独特的氨基酸替换位点标记于核苷酸进化树上(图1)。可以看出NA基因核苷酸进化树分为2支(Clade),Clade 1内的毒株可进一步分为2组 (Group),2013年分离株与疫苗株位于Group 1中,2014年分离株位于Group 2中,2015年分离株单独构成Clade 2,2015年分离株与疫苗株亲缘关系相对较远。与疫苗株A/Vitorvia/361/2011(H3N2)相比较,2013年、2014年、2015年分离株的NA基因同源性分别为99.3%~99.4%、99%、98.6%~98.8%;与疫苗株A/Texas/50/2012(H3N2)相比较,2013 年、2014 年、2015 年分离株的NA基因同源性分别为99.6%~99.7%、99.2%~99.3%、99%~99.2%。
2.1.2 氨基酸替换位点 Group 1未形成共同的变异位点,Group 2具有V412I替换位点,而在Clade 2上有4个替换位点,分别是S245N、S247T、T267K和I380V。
2.1.3 NA蛋白分子上二硫键位点和糖基化位点二硫键通常指在多肽和蛋白质分子中的半胱氨酸(C)残基中的化学键,而潜在糖基化位点由分子中的天冬酰胺(N)所构成。H3N2亚型毒株NA蛋白序列分析结果表明,与参照毒株相比,所有分离株与疫苗株NA蛋白中二硫键位点完全一致,分别是21、53、78、92、124、129、175、183、193、230、232、237、278、280、289、291、318、337、417、421、447 位,但糖基化位点情况则不太相同,参照毒株和分离株A/JiangxiYushui/1359/2015(H3)只有6个共同糖基化位点, 即 61、70、86、146、200、234 位, 其余H3N2分离株除了上述6个糖基化位点外在329位增加了1个糖基化位点。
2.1.4 抗原决定簇 至今已知N2蛋白有7个抗原决定簇,它们是153位、197~199位、328~336位、339~347位、367~370位、400~403位和431~434位[4]。根据我们的分析结果显示,除了分离株A/JiangxiYushui/1359/2015(H3)在 329位是苏氨酸(T)致使它在328~336位抗原决定簇有所不同,其余分离株7个抗原决定簇完全相同。
2.1.5 NA蛋白耐药相关位点 对照A型流感病毒NA蛋白酶催化活性位点(N2 Numbering)(R-118、D-151、R-152、R-224、E-276,R-292、R-371 和 Y-406) 和辅助位点 (E-119、R-156、W-178、S-179、D-198、I-222、E-227、H-274、E-277、N-294 和 E-425),新余地区10株H3N2亚型分离株在以上位点未发生突变,均对NAIs敏感。
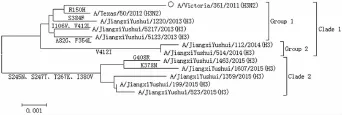
图1 H3N2亚型流感病毒NA基因核苷酸进化树及其氨基酸序列变异位点
2.2 B型NA基因特性分析
2.2.1 核苷酸进化和同源性 23株B型病毒NA基因核苷酸双向序列同样经拼接、对比后均获得长度为1398bp的编码序列,对其构建核苷酸进化树,推导出氨基酸序列(466个氨基酸位点),将氨基酸差异位点一并标于核苷酸进化树上(图2)。核苷酸进化树分为2个支 (Clade),Clade 1再分为2组(Group),8株 BV 分离株与 A/JiangxiYushui/131/2015(BY)位于Group 1,余下8株、6株BY分离株分别位于Group 2、Clade 2。与疫苗株B/Brisbane/60/2008(BV) 进行比较,8株 BV分离株、A/JiangxiYushui/131/2015(BY)、Group 2中 8株 BY 分离株NA基因的同源性分别为98.8%~99%、99.1%、96.5%~96.9%;与疫苗株B/Wisconsin/01/2010(BY)进行比较,Clade 1中9株BY分离株、Clade 2中6株BY分离株NA基因的同源性分别为94.4%~95%、98.3%~99%。综合B型流感HA血凝抑制试验、NA基因系统进化树和同源性分析结果以及我们先前有关B型流感HA1基因的研究结果[26],表明Clade 1中9株BY分离株为种系间BY-HA/BV-NA的重配毒株。
2.2.2 氨基酸序列差异位点 以疫苗株B/Brisbane/60/2008(BV)作为参照毒株,Group 1所有分离株均发生S259R、N340D和K343E替换,所有BV分离株另发生E358K替换;Group 2所有分离株均发生 I262M、V271T、K272Q、N329D、D342G、M375K和D384N替换,Clade 2所有毒株与疫苗株B/Brisbane/60/2008(BV)相比较,至少在 148、198、219、235、244、373、389、392、396、436 位点上存在差异。
2.2.3 NA蛋白分子上二硫键位点和糖基化位点序列分析表明疫苗株和所有分离株均具有9对二硫键和4个潜在糖基化位点,形成二硫键的位点即 54、87、122、127、182、229、231、236、251、277、279、289、291、318、337、420、424、447 位,4 个糖基化位点分别是56、64、144、284位,所有B型分离株NA蛋白上的二硫键位点和糖基化位点非常保守。
2.2.4 抗原决定簇 BNA蛋白上有8个抗原决定簇, 分 别 在 125、148、186、198、244、248、271、272位[5]。新余地区BY分离株与疫苗株B/Brisbane/60/2008(BV)相比,反映在8个抗原决定簇上的差异如下:Clade 2 中所有毒株在 125、148、198、244 位分 别 为 N →K/T、G →E、N →S、S→P, 除 B/JiangxiYushui/1221/2014(BY)外其余毒株在 186、248位分别是K→R、V→I;Group 2中所有毒株在271、272位分别是V→T、K→Q。从前述分析来看,Clade 1中9株BY分离株与疫苗株B/Brisbane/60/2008(BV)具有相同抗原决定簇的数量不小于6个,这个分析结果进一步说明它们是种系间的重配病毒。
2.2.5 NA蛋白耐药相关位点 根据B型流感病毒NA蛋白酶催化活性位点 (B Numbering)(R-116、D-149、R-150、R-223、E-275、R-292、R-374 和 P-406) 和辅助位点 (E-117、R-154、W-177、S-178、D-197、I-221、E-226、H-273、E-276 和 N-294,E-428)以及其他相关位点 E-105、G-108、G-141、N-144、S-249、T-325、R-374、G-407, 分析新余地区23株B型分离株NA基因氨基酸序列,所有B型分离株在相应位点未发生替换,仍然对神经氨酸酶抑制剂保持敏感。
3 讨论

图2 B型流感病毒NA基因核苷酸进化树及其氨基酸序列位点差异
NA是流感病毒基因组第6个片段所编码,其单体包含四个部分:胞内域、跨膜区、茎部和头部[6]。不同NA亚型和不同毒株之间氨基酸残基数在胞内域、跨膜区是固定的,而在茎部、头部是变动的,其中头部约为390个氨基酸包括酶活性中心位点、抗原决定簇和部分糖基化位点[7-9]。NA在病毒膜上以四聚体的形式存在,NA单体在宿主细胞内合成后,首先依靠分子间二硫键形成二聚体,再通过适当的糖基化形成四聚体[7]。在NA三维结构中四聚体的头部呈蘑菇样,通过细长的茎部连接到病毒膜[10]。
NA在病毒脱离宿主细胞过程中发挥着重要作用。病毒入侵细胞时血凝素(HA)分子末端的唾液酸残基(SA)与细胞HA受体分子表面的糖基团(糖蛋白/糖脂质) 以 α-2,6或 α-2,3糖苷键相链接最终完成感染。病毒成熟后NA催化水解相同糖苷键使病毒颗粒脱离宿主细胞,感染新的细胞以帮助病毒扩散[11]。NIAs类药物通过与NA上的特定结构域竞争性、可逆性结合,降低水解酶的活性从而阻止病毒颗粒脱离细胞向外扩散。目前在临床使用的NIAs有三种:奥斯他韦、扎那米韦和帕拉米韦。除了帕拉米韦为新研制药物外,NIAs已经在临床上运用近二十年[12]。然而随着NAIs对抗流感病毒的治疗使用,耐药毒株陆续被国外发现并报道出来,认为这些耐药株的出现与流感病毒NA上酶活性位点等氨基酸位点突变有关,如R152K、D198N、I222T、H274Y、N294S、E105K、G109E、E110K、S250G、G402S[13-17]。 Colman 等人研究认为,H3N2亚型流感病毒的NA基因酶催化活性位点(R-118、D-151、R-152、R-224、E-276,R-292、R-371 和 Y-406) 和辅助位点 (E-119、R-156、W-178、S-179、D-198、I-222、E-227、H-274、E-277、N-294和E-425)、B型流感病毒的NA基因酶催化活 性 位点 (R-116、D-149、R-150、R-223、E-275、R-292、R-374 和 P-406)和辅助位点(E-117、R-154、W-177、S-178、D-197、I-221、E-226、H-273、E-276 和 N-294,E-428)以及其他相关位点E-105、G-108、G-141、N-144、S-249、T-325、R-374、G-407发生一个或多个氨基酸替代都可能引起NIAs敏感性下降甚至完全无效[18]。国内有关监测到H3N2、B型毒株对NAIs产生耐药的报道并不多见,仅限于秦剑秋、梁丽君和刑小会等人的分析研究[19-21]。
本文从基因进化、共同氨基酸差异、二硫键位点、糖基化位点、抗原决定簇和耐药相关位点多个角度入手,对新余地区2013年-2015年H3N2、B型流感病毒分离株的NA基因特性进行探讨。从分析结果来看,与疫苗株A/Vitorvia/361/2011(H3N2)相比较10株H3N2型分离株NA基因同源性均为98.6%以上,但同源程度随年代跨度缓慢下降;在NA氨基酸序列上,H3N2分离株的二硫键位点和耐药相关位点均相同,除分离株A/JiangxiYushui/1359/2015(H3)外,其他H3N2分离株在329位增加了1个糖基化位点,这也导致它们在328~336位抗原决定簇有所不同。糖基化位点的增加可能会掩盖抗原位点,成为病毒逃避宿主免疫压力的一种方式[20]。所有B型分离株NA蛋白的二硫键位点、糖基化位点和耐药相关位点均未发生改变,但NA抗原决定簇在两个谱系间差异较大。60%(9/15)的BY系流感毒株为BY-HA/BV-NA重配毒株。B型流感病毒中发现重配毒株在近几年屡有报道[22-24],这可能与它们在人群中共同流行、进化致使两者增加了基因重配的机会有关[25]。有关共同氨基酸差异位点方面,在H3N2分离株上只体现出不同的进化分支,而在B型分离株还可以反映出两系在抗原决定簇上的差异。本文的分析结果提示新余地区H3N2、B型所有分离株NA基因与相应疫苗株同源性较高;在NA氨基酸序列上除分离株A/JiangxiYushui/1359/2015(H3)外,其余同型别的分离株二硫键位点、糖基化位点和耐药相关位点是相同的,而抗原决定簇在H3N2分离株间也是一致的但在B型不同系谱间差异相当大;所有分离株仍然显示出对NAIs类药物敏感,但我们应该持续监测其变化情况以便在流感防治工作中作出正确的决策。

